代谢异常是肿瘤的重要特征之一,肿瘤细胞即使在氧气充足的条件下也通过糖酵解方式获得能量,而不是通过三羧酸循环和氧化磷酸化。这种现象是细胞恶变过程中最为基础的代谢改变之一,被称为“Warburg效应”或者有氧糖酵解[1]。己糖激酶(hexokinase, HK)是细胞糖酵解的第一个限速酶,直接决定进入糖酵解的葡萄糖的量。目前已知人类己糖激酶有HK Ⅰ、HKⅡ、HKⅢ和HKⅣ4种同工酶。正常情况下,HKⅡ仅在心脏、肌肉和脂肪组织中微量表达。在生长迅速的恶性肿瘤细胞中,以HKⅡ高表达为主[2]。有研究报道,在乳腺恶性肿瘤组织中,HKⅡ的含量明显增高,并且当肿瘤出现转移时,HKⅡ的活性更高[3];同时HKⅡ在三阴性乳腺癌MDA-MB231细胞中表达高于雌激素受体阳性的乳腺癌MCF-7细胞[4]。
马蔺子素(irisquinone)是从中草药马蔺子中提取的一种醌类化合物。Xu等[5]研究表明, 马蔺子素对兔VX2(兔乳头状瘤衍生而来的鳞癌)肺移植瘤模型具有放射增敏作用。发现马蔺子素联合放射治疗后,在PET/CT显像中肿瘤对氟代脱氧葡萄糖(18F-fluorodeoxyglucose, 18F-FDG)摄取值明显减低,继而推测肿瘤增敏治疗与糖代谢关系密切,而Warburg效应是肿瘤主要供能方式。目前,国内外对于肿瘤增敏治疗的研究多侧重临床,肿瘤增敏治疗与Warburg效应的关系及其机制未见明确相关报道。本实验拟在分子生物水平研究马蔺子素放射增敏作用对MDA-MB231细胞Warburg效应的影响,并为临床肿瘤增敏治疗寻找基础理论依据。
材料与方法1.细胞株及主要试剂仪器:人乳腺癌细胞株MDA-MB231购于中科院上海细胞库。DMEM高糖培养基、胎牛血清(FBS)、0.25%胰酶、磷酸盐缓冲液(PBS)均购于美国GIBCO公司。ACTIN内参抗体购自美国Sigma公司。Annexin V-FITC细胞凋亡检测试剂盒购自上海贝博生物公司。TriZOL试剂购自美国Invitrogen公司。Real-time PCR试剂盒购自日本TaKaRa公司。转染试剂Lipofectamine 2000购自上海吉码公司,HKⅡ基因编码序列由上海吉玛公司设计合成。二甲基亚砜(DMSO)购自美国Amresco公司。小鼠抗人HKⅡ单克隆抗体(ab76959)购自英国Abcam公司,兔抗小鼠二抗购自北京中杉金桥公司。马蔺子素胶囊(55 mg/粒)购自山东新华制药公司。流式细胞仪购自美国Beckman Coulter公司,型号为Beckman FC500。
2.细胞培养、转染及体外实验的分组:MDA-MB231细胞培养采用含10%FBS的DMEM高糖培养液于含5%CO2的37℃恒温培养箱(MCO-15AC型,日本SANYO公司)中培养,待细胞贴满培养皿底约80%进行传代培养。选择处于指数生长期的细胞进行实验。实验共分为空白对照组、马蔺子素组、单纯照射组、马蔺子素+照射组、阴性对照组及转染HKⅡsiRNA组。空白对照组予以其他组同等浓度及量的DMSO处理,马蔺子素组予以0.1 mmol/L马蔺子素作用24 h,单纯照射组予以X射线照射,马蔺子素+照射组予以0.1 mmol/L马蔺子素作用24 h后进行照射,阴性对照组转染100 pmol无义序列小RNA后予以0.1 mmol/L马蔺子素作用24 h,随后进行照射,转染HKⅡsiRNA组采用转染siRNA后予以0.1 mmol/L马蔺子素作用24 h,随后进行照射(转染所需RNA核苷酸序列如下,NC:正义链5′ UUCUCCGAACGUGUCACGUTT 3′、反义链5′ACGUGACACGUUCGGAGAATT 3′,siRNA/HKⅡ:正义链5′GCAGAAGGUUGACCAGUAUTT 3′、反义链5′AUACUGGUCAACCUUCUGCTT 3′)。
3.照射条件:采用6 MV X射线(23EX型,美国Varian公司)进行单次照射,细胞距放射源100 cm,照射剂量为4 Gy,吸收剂量率为150 cGy/min,照射野为10 cm×10 cm,表面覆盖1.5 cm厚的胶体。
4.细胞克隆形成实验:取指数生长期肿瘤细胞,常规消化,反复吹打成单细胞悬液,细胞计数并用培养液调节细胞浓度,按照每皿细胞数量100~8 000个接种5 ml细胞悬液到60 mm培养皿中。培养箱中培养约4 h待细胞贴壁后,予以0.1 mmol/L马蔺子素处理后培养24 h,再分别给予0、2、4、6、8 Gy的X射线照射。无菌条件下, 静止培养10 d。肉眼下计数细胞形成的集落数, 对难以判断者, 在显微镜下计数≥50个细胞的集落数。计算存活分数(SF)=每孔克隆数/(每孔细胞种植数×克隆率),以单击多靶模型拟合细胞存活曲线,计算出单纯照射组和马蔺子素+照射组的准阈剂量(D0)、平均致死剂量(Dq)、2 Gy照射的存活分数(SF2)及放射增敏比(SER),SER定义为单纯照射组D0与马蔺子素+照射组D0之比。重复实验3次。
5.流式细胞仪检测细胞凋亡率:收集指数生长期的各组细胞,以每孔2×105个细胞密度接种于6孔板中,培养至贴壁后进行处理,继续培养48 h,用不含乙二胺四乙酸(EDTA)的胰酶消化离心(离心半径10 cm, 1 000 r/min离心10 min)后收集悬浮细胞,预冷PBS洗涤细胞,调整每管细胞浓度为1×106/ml,依次加入Annexin V-FICT和碘化丙啶(PI)试剂,室温避光孵育15 min,流式细胞仪检测。
6.实时定量聚合酶链反应(qRT-PCR)检测HKⅡmRNA的表达水平:收集实验各组处理的细胞,用TriZOL法提取细胞总RNA,用反转录试剂盒反转录mRNA生成cDNA,用PCR扩增试剂盒检测各组样本中HKⅡmRNA的表达,选择GAPDH作为mRNA的内参。HKⅡ引物序列:正义链5′GCCCGCCAGAAGACATTAGAGCAT 3′;反义链5′AGGTCCAAGGCCAAGAAGTCC 3′;GAPDH引物序列:正义链5′ACTTTGGTATCGTGGAAGGACTCAT 3′,反义链5′:GTTTTTCTAGACGGCAGGTCAGG 3′。扩增条件: 95℃ 30 s预变性,95℃ 10 min,60℃ 60 s,循环40次,数据采用2-ΔΔCT法进行分析。
7.Western blot检测HKⅡ蛋白的表达水平:收集各组处理的细胞,细胞裂解液冰上裂解,提取总蛋白,采用二喹啉甲酸(BCA)法进行蛋白定量。取各组等量蛋白样品进行SDS-PAGE凝胶电泳分离,恒压100 V电转移至聚偏二氟乙烯(PVDF)印迹膜,5%脱脂奶粉三羟甲基氨甲烷缓冲液(TBST)室温封闭2 h后,分别加入小鼠抗人HKⅡ抗体(1 :1 000稀释)和ACTIN(1 :1 000稀释)内参抗体,4℃孵育过夜。次日磷酸盐吐温缓冲液(PBST)洗膜,每次洗涤10 min,共洗涤3次。用辣根过氧化物酶(HRP)标记的羊抗兔二抗(1 :10 000稀释),室温孵育1 h。加入洗涤液TBST,每次洗涤10 min,洗涤3次。用化学发光法显色,凝胶成像系统采集成像,MultiGauge图像分析软件对结果进行灰度分析。
8.统计学处理:采用SPSS 17.0统计软件处理数据,计量资料以x±s表示,所有数据均符合正态分布,对细胞存活率、凋亡率、HKⅡ mRNA及蛋白的相对表达水平两组数据比较用独立样本t检验。细胞生存曲线用GraphPad Prism 5软件进行拟合,P < 0.05为差异有统计学意义。
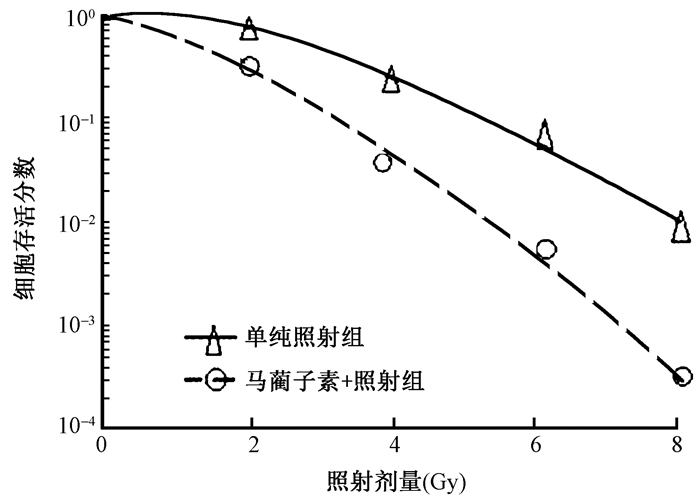
结果1.马蔺子素对MDA-MB231细胞照射敏感性的影响:单纯照射组和马蔺子素+照射组克隆形成后,细胞存活分数见图 1,细胞存活曲线的主要放射增敏参数列于表 1。结果表明,马蔺子素对人乳腺癌MDA-MB231细胞具有明显的放射增敏作用,增敏比为1.52。
|
图 1 X射线照射后MDA-MB231细胞存活曲线 Figure 1 The survival curves of MDA-MB231 cells after X-ray radiation |
|
|
表 1 不同组别MDA-MB231细胞存活曲线的主要参数 Table 1 The main parameters of MDA-MB231 cell survival curve in different groups |
2.各组细胞凋亡率的检测:流式细胞仪检测结果显示(表 2), 马蔺子素组+照射组凋亡率高于空白对照组、马蔺子素组、单纯照射组、转染HKⅡsiRNA组,差异有统计学意义(t=13.29、12.09、5.90、3.83,P<0.05),马蔺子素组+照射组与阴性对照组间差异无统计学意义(P>0.05)。而单纯照射组凋亡率高于空白对照组、马蔺子素组(t=9.50、8.18,P<0.05),空白对照组与马蔺子素组之间差异无统计学意义(P>0.05)。
|
|
表 2 HKⅡmRNA的相对表达及细胞凋亡率(x±s) Table 2 The relative expression of HKⅡ mRNA and apoptosis in cells(x±s) |
3.qRT-PCR检测HKⅡ mRNA的表达水平:qRT-PCR检测结果显示(表 2), 马蔺子素组+照射组HKⅡmRNA的表达水平高于空白对照组、马蔺子素组、单纯照射组,差异有统计学意义(t=9.14、10.48、3.40,P<0.05),马蔺子素+照射组HKⅡmRNA的表达水平与阴性对照组之间无明显差异(P>0.05),马蔺子素+照射组HKⅡmRNA的表达水平高于转染HKⅡ siRNA组,差异有统计学意义(t=5.65,P<0.05)。
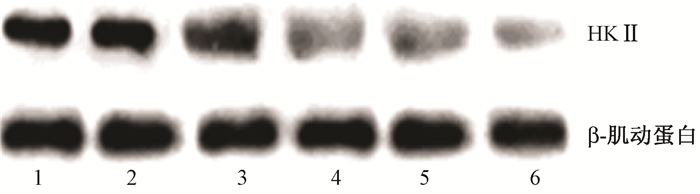
4. Western blot检测HKⅡ蛋白的表达水平:Western blot检测结果显示,各组细胞HKⅡ蛋白表达的相对定量分别为(0.623±0.031)、(0.624±0.013)、(0.388±0.025)、(0.226±0.040)、(0.204 ±0.017)和(0.095±0.012)。马蔺子素组+照射组HKⅡ蛋白的表达水平低于空白对照组、马蔺子素组、单纯照射组,差异有统计学意义(t=13.39、16.08、5.81,P<0.05)。
|
图 2 Western blot检测HKⅡ蛋白的表达量 注:1.空白对照组;2.马蔺子素组;3.单纯照射组;4.马蔺子素+照射组;5.阴性对照组;6.转染HKⅡsiRNA组 Figure 2 The expression of HKⅡ protein detected by Western blot |
讨论
在肿瘤的放射治疗中,恶性肿瘤组织中存在的乏氧细胞,可对放疗的效果存在明显的影响。国内外研究表明,肿瘤放疗增敏剂,尤其是乏氧细胞增敏剂是解决肿瘤内乏氧细胞抗拒性的有效途径之一。马蔺子素是我国自主研发的放射增敏剂,是从中草药马蔺子中提取的一种醌类化合物,其主要作用机制为:抑制恶性肿瘤细胞呼吸,降低耗氧量;选择性降低恶性肿瘤细胞内谷胱甘肽含量,增加乏氧细胞DNA单链断裂;抑制恶性肿瘤细胞DNA合成及断裂后的修复;将恶性肿瘤细胞生长周期阻滞于对射线敏感的G1期[6]。
肿瘤高代谢与肿瘤发生、发展密切相关,Warburg效应是肿瘤主要供能方式,即大多数恶性肿瘤细胞即使在有氧情况下也以糖酵解为主要产能方式[7]。HKⅡ作为糖酵解途径中的第一个限速酶,在许多肿瘤细胞中异常高表达,促进肿瘤的生长和转移[8]。樊知桐和江瑛[9]在HKⅡ与Warburg效应文中表述HKⅡ与恶性肿瘤的高糖酵解代谢的生物学特性有着密切的关系。同时也有研究表明,与正常细胞相比较,生长迅速的肿瘤细胞中的HKⅡ活力明显升高,使肿瘤细胞能获得足够的6-磷酸葡萄糖,这是其在缺氧条件下特别有意义的能量来源[10]。同时,蓝海兵等[11]在关于miR-181c靶向HKⅡ抑制癌相关成纤维细胞的糖酵解研究中发现,抑制HKⅡ基因后,能够抑制肿瘤细胞的糖酵解能力。本实验拟在生物分子水平研究放射增敏剂马蔺子素与MDA-MB231细胞Warburg效应之间的联系,为临床治疗提供基础理论依据。
本实验结果显示,在克隆形成实验中,与单纯照射组相比,马蔺子素+照射组的D0、Dq及SF2值均降低,马蔺子素的放射增敏比为1.52,表明马蔺子素对人乳腺癌MDA-MB231细胞具有明显的放射增敏作用。在细胞凋亡率检测实验中,马蔺子素+照射组肿瘤细胞凋亡率明显高于空白对照组、马蔺子素组、单纯照射组,单纯照射组细胞凋亡率也高于空白对照组、马蔺子素组,空白对照组与马蔺子素组之间无明显区别,说明单纯使用马蔺子素不能增加肿瘤细胞凋亡率,而单纯照射可以增加肿瘤细胞凋亡率。而马蔺子素联合照射后能明显提高肿瘤细胞的放射敏感性,这与徐慧琴等[6]关于18F-FDG PET/CT显像评估马蔺子素放射增敏作用研究中马蔺子素+照射组肿瘤组织对18F-FDG的摄取即最大标准摄取值(SUVmax)明显低于其他各组的结果相一致。也验证了马蔺子素对人乳腺癌MDA-MB231细胞具有明显的放射增敏作用。沉默HKⅡ基因后,凋亡检测实验显示转染HKⅡsiRNA组细胞凋亡率低于马蔺子素+照射组,说明沉默HKⅡ基因能使马蔺子素的放射增敏作用效果明显减弱。qRT-PCR及Western blot检测实验结果显示,马蔺子素+照射组与空白对照组、马蔺子素组、单纯照射组相比,HKⅡmRNA的相对表达水平明显降低,HKⅡ蛋白的相对表达水平也明显降低。而沉默HKⅡ基因后转染HKⅡsiRNA组的HKⅡmRNA及蛋白相对表达水平较马蔺子素+照射组明显降低,这与凋亡实验检测结果相一致。综合上述实验结果可以说明,马蔺子素对人乳腺癌MDA-MB231细胞具有放射增敏作用,机制是其通过下调HKⅡ基因的表达来抑制MDA-MB231细胞的Warburg效应。
利益冲突 所有作者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 苏晓雨负责实验操作、论文撰写;徐慧琴负责课题设计、指导及论文修改;汪会、张丹指导实验;谯凤、余文静负责数据分析
| [1] |
Justus CR, Sanderlin EJ, Yang LV. Molecular connections between cancer cell metabolism and the tumor microenvironment[J]. Int J Mol Sci, 2015, 16(5): 11055-11086. DOI:10.3390/ijms160511055 |
| [2] |
Hwang MH, Lee SW, Kim JE, et al. Enhanced anti-proliferative effects of combination hexokinase Ⅱ shRNA and NIS gene therapy on vascular smooth muscle cells[J]. Nucl Med Biol, 2012, 39(2): 269-278. DOI:10.1016/j.nucmedbio.2011.07.006 |
| [3] |
赵迎超, 伍钢. 己糖激酶与恶性肿瘤关系的研究进展[J]. 肿瘤防治研究, 2006, 33(9): 694-696. Zhao YC, Wu G. Research progress on the relationship between hexokinase and malignant tumors[J]. Cancer Res Prev Treat, 2006, 33(9): 694-696. DOI:10.3971/j.issn.1000-8578.2006.09.023 |
| [4] |
Geng C, Li JU, Ding F, et al. Curcumin suppresses 4-hydroxytamoxifen resistance in breast cancer cells by targeting SLUG/Hexokinase 2 pathway[J]. Biochem Biophys Res Commun, 2016, 473(1): 147-153. DOI:10.1016/j.bbrc.2016.03.067 |
| [5] |
Xu HQ, Sun GP, Wang H, et al. Dynamic observation of the radiosensitive effect of irisquinone on rabbit VX2 lung transplant tumors by using 18F-fluorine-18-deoxyglucose positron emission tomography/computed tomography[J]. Nucl Med Commun, 2013, 34(3): 220-228. DOI:10.1097/MNM.0b013e32835d3730 |
| [6] |
徐慧琴, 汪会, 薛杨央, 等. 18F-FDG PET/CT显像评估马蔺子素放射增敏作用[J]. 中华核医学与分子影像杂志, 2013, 33(2): 150-153. Xu HQ, Wang H, Xue YY, et al. The role of 18F-FDG PET/CT in evaluation of radiosensitivity enhancement by irisquinone[J]. Chin J Nucl Med Mol Imaging, 2013, 33(2): 150-153. DOI:10.3760/cma.j.issn.2095-2848.2013.02.013 |
| [7] |
Yang W, Zheng Y, Xia Y, et al. ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect[J]. Nat Cell Biol, 2012, 14(12): 1295-1304. DOI:10.1038/ncb2629 |
| [8] |
Wolf A, Agnihotri S, Micallef J, et al. Hexokinase 2 is a key mediator of aerobic glycolysis and promotes tumor growth in human glioblastoma multiforme[J]. J Exp Med, 2011, 208(2): 313-326. DOI:10.1084/jem.20101470 |
| [9] |
樊知桐, 江瑛. 己糖激酶Ⅱ与Warburg效应[J]. 临床与病理杂志, 2016, 36(12): 2053-2059. Fang ZT, Jiang Y. Hexokinase-Ⅱand Warburg effect[J]. J Clin Pathol Res, 2016, 36(12): 2053-2059. DOI:10.3978/j.issn.2095-6959.2016.12.03 |
| [10] |
Mathupala SP, Rempel A, Pedersen PL, et al. Glucose catabolism in cancer cells:identification and characterization of a marked activation response of the type Ⅱ hexokinase gene to hypoxic conditions[J]. J Biol Chem, 2001, 276(46): 43407-43412. DOI:10.1074/jbc.M108181200 |
| [11] |
蓝海兵, 罗亮, 齐协飞, 等. miR-181c靶向己糖激酶2抑制癌相关成纤维细胞的糖酵解[J]. 南方医科大学学报, 2015, 35(11): 1619-1623. Lan HB, Luo L, Qi XF, et al. miR-181c inhibits glycolysis by targeting hexokinase 2 in cancer-associated fibroblasts[J]. J South Med Univ, 2015, 35(11): 1619-1623. DOI:10.3969/j.issn.1673-4254.2015.11.20 |
 2018, Vol. 38
2018, Vol. 38


