粒子治疗计划系统利用计算机断层扫描(CT)作为基础输入数据,将CT值(Hounsfield Unit, HU)转换为粒子的相对阻止本领(relative stopping power,RSP),从而计算粒子在介质中的射程、能量沉积及剂量分布[1]。转换过程需要借助CT值与RSP转换曲线。转换曲线的准确性直接影响组织/器官的阻止本领的准确性,从而影响剂量分布[2]。获取CT值相对阻止本领转换曲线有几种常用方法,如利用动物器官进行直接测量[3-4],或是利用参考人组织和器官的化学元素组成进行计算得到[3-7],还可以利用组织等效模体进行测量得到[8-11]。本研究利用12个圆柱形组织等效模体,经CT扫描后,测得各组织等效模体的CT值。再利用德国PTW®公司生产的PeakFinder寻峰设备,经163.3 MeV质子和312.7 MeV/u碳离子照射,测量12个组织等效材料的RSP。最后通过线性插值获得CT值与RSP转换曲线。
材料与方法1.组织等效模体及CT值测量:Gammex组织等效模型(Model 467,美国CIRS®公司生产),包含肺部、骨皮质、肝脏、脂肪、乳腺等12个组织等效模体。将上述模体放置在配套的卡槽内,利用预设参数采用德国西门子CT (Siemens SOMATOM Definition AS)进行扫描,其扫描野500 mm,管电压120 kV,管电流300 mAs,扫描层厚3 mm,图像重建层厚1.5 mm。利用软件自带的球形选取工具获得各组织等效模体在卡槽中的平均CT值及标准偏差。组织等效模体的CT扫描示意图见图 1。

|
图 1 组织等效模体的CT扫描示意图 Figure 1 CT scan of tissue equivalent phantom |
2.质子重离子设备和束流:上海市质子重离子医院采用德国西门子全套质子重离子放疗设备,拥有1套同步加速器,配有4间质子重离子治疗室,包括3间90°束流治疗室和1间45°束流治疗室。该质子重离子装置目前可以引出质子和碳离子束流。质子束流能量范围为48~221 MeV,碳离子束流能量范围为85~430 MeV/u,束流在该能量范围内可以调节多达290个能量层。本研究采用能量为163.3 MeV、半高宽11 mm的单能质子和能量为312.7 MeV/u、半高宽为3.8 mm的单能碳离子进行测量,质子和碳离子在该能量下水中布拉格峰的深度分别为182.5和183.9 mm。
3.单能碳离子和质子束流测量相对阻止本领:对组织等效模体的相对阻止本领的测量需要用到PTW®PeakFiner寻峰设备。首先将寻峰设备放置于束流中心位置,在前端不放置任何模体的前提下,测量记录其峰值(最大剂量沉积位置深度)90%剂量沉积位置。再将组织等效模体水平放置于寻峰设备与治疗机头之间,测量记录其峰值90%剂量沉积位置。利用公式(1) 可以得到不同组织等效模体的相对阻止本领[12]:
| $RSP = \frac{{({R_{90,{\rm{ }}w}} - {R_{90,{\rm{ }}m}})}}{{{t_m}}}$ | (1) |
式中,R90, w为单能粒子照射时测量在束流末端方向上水中90%剂量沉积的深度,cm;R90, m为单能粒子照射时组织等效模体置于寻峰设备前方,测量在束流末端方向上的水中90%剂量沉积的深度,cm;tm为等效模体的物理长度,cm。
结果1. CT值的测量结果:表 1是12个组织等效模体以及水的CT值测量结果,该数据是采用针对前列腺患者的系统预设参数进行扫描而得到的。
|
|
表 1 组织等效模体的CT值(HU, x±s) Table 1 Hounsfield unit of tissue equivalent phantom(HU, x±s) |
2.相对阻止本领的测量结果:图 2显示的是312.7 MeV/u碳离子在水中的射程测量结果,以及放置骨松质、脂肪、肺-450组织等效模体后的测量结果。放置组织等效模体后,束流的射程变短,通过计算两者之间的差异,可以得到组织等效模体的相对阻止本领。表 2给出了利用碳离子和质子以及PTW寻峰设备测量得到的相对阻止本领。测量得到的各组织等效模体的阻止本领在0.281到1.629之间。大部分等效模体利用质子和碳离子束流测量结果的差异较小,≤0.64%。但是对于肺部等效模体肺-300和肺-450的测量结果差异较大,分别为4.18%和1.51%。主要原因是肺部模体平均密度低,其内部结构具有较高的不确定性,测量结果受内部结构影响较大。
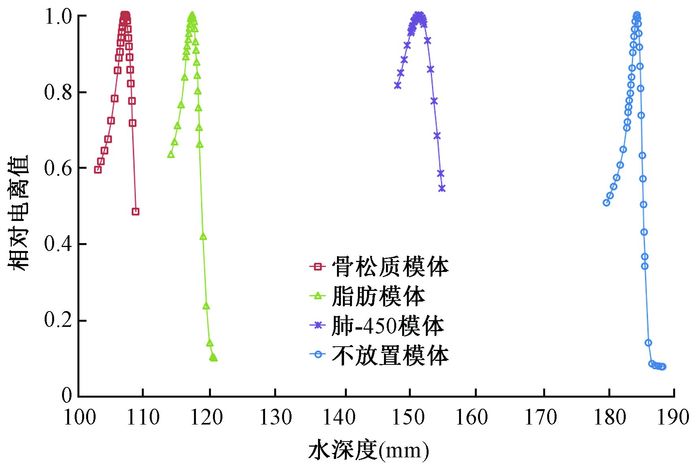
|
图 2 312.7 MeV/u碳离子参考深度剂量峰值曲线及在寻峰设备和治疗头之间放置骨松质、脂肪和肺-450模体后的测量结果 Figure 2 Depth dose profiles in water from 312.7 MeV/u carbon beam and corresponding depth dose profile with inner bone, adipose, lung-450 tissue equivalent phantom between PeakFinder and nozzle |
|
|
表 2 碳离子和质子束流相对阻止本领的测量结果 Table 2 Results of relative stopping power measured by proton and carbon ion beam |
3. CT值-相对阻止本领转换曲线:图 3是通过质子、碳离子测量并计算得到的CT值-阻止本领转换曲线。图中还展示了Witt等[13]的测量结果。大部分人体软组织的CT值集中在-150到250之间,这部分的曲线经放大示于图 3。由图中可见,对于大部分组织等效模体质子和碳离子转换曲线测量结果基本一致。同时该测量结果与文献数据也比较接近。
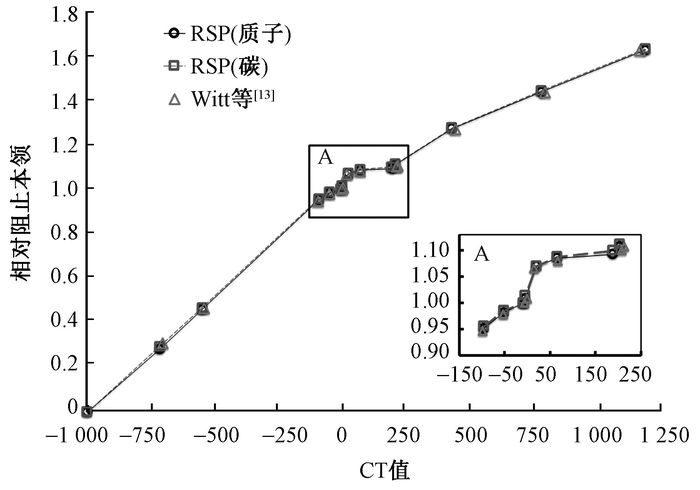
|
图 3 CT值-相对阻止本领转换曲线 注:RSP.相对阻止本领 Figure 3 CT value and relative stopping power conversion curve |
讨论
粒子治疗作为精准放射治疗手段,受到国内外越来越多的关注。CT值与相对阻止本领转换曲线对于粒子放射治疗计划制定的准确程度起到十分重要的作用[2]。本研究通过测量组织等效模体的CT值,再利用质子、碳离子束流测量得到各组织等效模体的相对阻止本领从而得到CT值-相对阻止本领转换曲线。
利用患者定位CT,使用预设参数对组织等效模体的CT值进行测量。对于同一种组织等效材料,使用不同CT设备、不同扫描参数、扫描时模体所在位置以及模体周围的材料等均会对CT值产生影响,其差异可以达到3%[5]。因此,有必要针对不同CT设备,不同扫描参数指定各自的CT值-相对阻止本领转换曲线。
对于同一种组织等效材料,利用质子和碳离子进行实验测量时,大部分材料的相对阻止本领结果相近,差异≤0.64%。然而,对于阻止本领较低的材料,如肺部组织等效模体,两者之间的差异可以达到4.18%。而Witt等[13]通过理论计算得到的数据与测量数据进行比较,在肺部模型中差异可达5%~15%,这主要是因为多孔材料在制作过程中具有较大的不确定性[14]。因此,在实际应用中,对低密度组织的相对阻止本领进行进一步校正,且应利用不同粒子束流分别进行测量。利用对组织等效模体的测量数据,可以得到CT值-阻止本领转换曲线。由于组织等效模体与人体器官/组织在组成上、物理特性上仍有一定的差异,因此该测量数据的临床应用仍需更进一步的研究工作。
值得注意的是,由转换曲线引起的射线射程不确定性一般<1.6%[1-2],即等效水深度在10 cm左右时,其射程的不确定性为1.6 mm左右[3]。例如对于质子放射治疗典型的头颈部肿瘤,因CT值及相对阻止本领转换曲线引起的射程的不确定性约为1.4 mm[1],这些不确定性需要通过对临床靶区的外扩才能确保靶区剂量的完整覆盖。在临床使用中,还应注意非常规材料的CT值与相对阻止本领之间的转换,如金属植入物、补偿组织等,必要时在临床应用中对这些材料指定其相对阻止本领。
利益冲突 本文作者未因进行该研究而接收任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 盛尹祥子负责数据分析、整理结果并起草论文;王巍伟、黄志杰负责相对阻止本领数据测量;赵静芳负责CT值测量和论文修改;Wen Chien Hsi负责数据审核和论文修改;Kambiz Shahnazi负责实验设计,指导论文写作
| [1] | Schaffner B, Pedroni E. The precision of proton range calculations in proton radiotherapy treatment planning: experimental verification of the relation between CT-HU and proton stopping power[J]. Phys Med Biol, 1998, 43 (6): 1579-1592. DOI:10.1088/0031-9155/43/6/016. |
| [2] | Mustafa AA, Jackson DF. The relation between X-ray CT numbers and charged particle stopping powers and its significance for radiotherapy treatment planning[J]. Phys Med Biol, 1983, 28 (2): 169-176. DOI:10.1088/0031-9155/28/2/006. |
| [3] | Rietzel E, Schardt D, Haberer T. Range accuracy in carbon ion treatment planning based on CT-calibration with real tissue samples[J]. Radiat Oncol, 2007, 2 (1): 1-9. DOI:10.1186/1748-717X-2-14. |
| [4] | Kanematsu N, Matsufuji N, Kohno R, et al. A CT calibration method based on the polybinary tissue model for radiotherapy treatment planning[J]. Phys Med Biol, 2003, 48 (8): 1053-1064. DOI:10.1088/0031-9155/48/8/307. |
| [5] | Schneider U, Pedroni E, Lomax A. The calibration of CT Hounsfield units for radiotherapy treatment planning[J]. Phys Med Biol, 1996, 41 (1): 111-124. DOI:10.1088/0031-9155/41/1/009. |
| [6] | Mills GC, Alperin JB, Trimmer KB. Studies on variant glucose-6-phosphate dehydrogenases: G6PD Fort Worth[J]. Biochem Med, 1975, 13 (3): 264-275. DOI:10.1016/0006-2944(75)90084-8. |
| [7] | Menzel HG, Clement C, DeLuca P. [1] Schaffner B, Pedroni E. The precision of proton range calculations in proton radiotherapy treatment planning: experimental verification of the relation between CT-HU and proton stopping power[J]. Phys Med Biol, 1998, 43(6):1579-1592. DOI: 10.1088/0031-9155/43/6/016.[J]. Ann ICRP, 2009, 39 (2): 1-164. DOI:10.1016/j.icrp.2011.08.009. |
| [8] | Coolens C, Childs PJ. Calibration of CT Hounsfield units for radiotherapy treatment planning of patients with metallic hip prostheses: the use of the extended CT-scale[J]. Phys Med Biol, 2003, 48 (11): 1591-1603. DOI:10.1088/0031-9155/48/11/308. |
| [9] | Jäkel O. Ranges of ions in metals for use in particle treatment planning[J]. Phys Med Biol, 2006, 51 (9): N173-177. DOI:10.1088/0031-9155/51/9/N01. |
| [10] | Szymanowski H, Oelfke U. CT calibration for two-dimensional scaling of proton pencil beams[J]. Phys Med Biol, 2003, 48 (7): 861-874. DOI:10.1088/0031-9155/48/7/304. |
| [11] | Jäkel O, Jacob C, Schardt D, et al. Relation between carbon ion ranges and x-ray CT numbers[J]. Med Phys, 2001, 28 (4): 701-703. DOI:10.1118/1.1357455. |
| [12] | Moyers MF, Sardesai M, Sun S, et al. Ion stopping powers and CT numbers[J]. Med Dosim, 2010, 35 (3): 179-194. DOI:10.1016/j.meddos.2009.05.004. |
| [13] | Witt M, Weber U, Kellner D, et al. Optimization of the stopping-power-ratio to Hounsfield-value calibration curve in proton and heavy ion therapy[J]. Z Med Phys, 2015, 25 (3): 251-263. DOI:10.1016/j.zemedi.2014.11.001. |
| [14] | Urie M, Goitein M, Holley WR, et al. Degradation of the Bragg peak due to inhomogeneities[J]. Phys Med Biol, 1986, 31 (1): 1-15. DOI:10.1088/0031-9155/31/1/001. |
 2017, Vol. 37
2017, Vol. 37


