目前,放疗仍是头颈部恶性肿瘤治疗的主要方法之一,但其引起的干燥综合征严重影响患者后期生活质量。涎腺细胞分化程度高而分裂能力低,本应具有很好的放射耐受性,但其在放射早期就表现出高度敏感性[1],确切原因现在仍不明确,也没有一种防治唾液腺放射损伤的可靠方法[2]。电离辐射会导致细胞发生DNA双链断裂(double-stranded breaks,DSBs),而细胞本身DSBs修复能力很大程度上会影响其后期的存活。Richard等[3]发现人类单链DNA结合蛋白1(human single-stranded DNA-binding protein 1,hSSB1) 在DSBs修复中起着重要的作用,并参与着DNA损伤过程中的不同阶段[4]-[5]。本研究运用沉默单链DNA结合蛋白1(SSB1) 的腺病毒载体,转染原代大鼠颌下腺(submandibular gland,SMG)细胞,通过体外实验初步分析SSB1对大鼠SMG细胞放射性损伤后增殖和修复的影响,进一步丰富涎腺放射敏感机制理论。
材料与方法1.实验动物:出生3 d SPF级SD大鼠,雌雄不限,购于广西医科大学实验动物中心。生产许可证号SCXK桂2014-0002,实验动物使用许可证号SYXK桂2014-0003。
2.主要试剂和仪器:高糖型DMEM培养基、胰酶(美国HyClone公司);胎牛血清、青霉素、链霉素(美国GIBCO公司);胰岛素、转铁蛋白、氢化可的松(美国Sigma公司);表皮生长因子(美国Peprotech公司);角蛋白(Pan CK)抗体、α-淀粉酶(α-Amylase)抗体、DAPI核染剂(北京Bioss公司);γ-H2AX兔多克隆一抗(美国Abcam公司);山羊抗兔FITC荧光二抗(美国KPL公司);免疫组织化学试剂盒SP-9000(北京中杉金桥公司);CCK-8试剂盒(南京Vazyme公司);rAdE5-SSB1-1p2shRNA-EGFP重组腺病毒液(武汉淅玛生物有限公司);荧光定量PCR试剂盒(日本TaKaRa公司);SteponePlus荧光定量PCR仪(美国Life Technologies公司);GWXJ80型60Co远距离治疗机(中国核动力研究设计院设备制造厂)。
3.SMG细胞原代培养及鉴定:参照柳康等[6]的培养方法并稍加改进,仔细分离颌下腺包膜,将剪碎洗净的组织加入1 ml稀释的0.125%胰酶消化30 min,每5 min摇匀,用含血清培养基终止,离心半径15 cm,800 r/min离心5 min,弃上清,加入3 ml 10%血清高糖培养基(含5 μg/ml胰岛素、5 μg/ml转铁蛋白、0.01 μg/ml表皮生长因子、0.1 μg/ml氢化可的松、青霉素100 U/ml、链霉素0.1 mg/ml)重悬细胞和组织块,均匀接种至25 cm2培养瓶,培养3 d。然后,磷酸盐缓冲液(PBS)轻轻漂洗2次。之后,每3天换液1次,培养7~10 d后,利用酶差速消化法和差速贴壁法纯化并传代。取第1代SMG细胞,以2×104/ml的密度接种6孔板爬片,待细胞贴壁达50%以上,PBS洗净后4%多聚甲醛固定15 min,0.5%Triton X-100孵育20 min,利用免疫组织化学试剂盒链霉亲和素-生物素复合物(SABC)进行Pan CK和α-Amylase检测。
4.1p2shRNA质粒的设计和腺病毒载体构建包装:从GenBank中找出大鼠SSB1的cDNA序列,依据shRNA设计原则,采用美国Ambion公司在线设计软件,选定针对SSB1的RNA联合干扰的2条靶序列,分别为SSB1(844):5′CCAGAACGGGAATGGACTGAG 3′和SSB1(539):5′GGCAGCATCAACATCTCAGTGT 3′。选取一段无同源性的碱基序列HK作为阴性对照,靶序列为:5′ACTACCGTTGTTATAGGTG 3′。重组质粒构建和腺病毒载体构建包装服务均由武汉淅玛生物公司提供,得到含绿色荧光蛋白基因(EGFP)的阳性重组腺病毒液和阴性对照重组腺病毒液,浓度均达1×109 PFU/ml。
5.细胞转染效率评估:取第1代细胞,将密度为2×104 /ml的细胞悬液分别接种于24孔培养板中,培养过夜。24 h后弃培养液,按感染复数(multiplicity of infection,MOI)为50,将阳性病毒液(Ad-SSB1-shRNA)和阴性对照病毒液(Ad-HK)分别用无血清培养基稀释后加入培养板中,每孔500 μl。培养2 h后,换成含10%血清的培养基,继续培养72 h。倒置荧光显微镜下观察EGFP表达情况。每孔按5点法(即上、下、左、右和中间)选取5个视野进行细胞计数,至少计数500细胞,设3个复孔,计算EGFP表达阳性率。
6.qRT-PCR检测SSB1沉默效果:取第1代SMG细胞,以2×105/ml的密度接种6孔板,按上述步骤转染72 h后,按总RNA提取试剂盒步骤提取实验组(Ad-SSB1-shRNA组)、阴性对照组(Ad-HK组)和正常细胞组的细胞总RNA,测定纯度与浓度后按反转录试剂盒合成cDNA。引物由大连宝生物公司合成(表 1),反应条件参照说明书进行。每组3个复孔,并重复3次,采用2-△△Ct法计算基因的相对表达量。
|
|
表 1 qRT-PCR引物序列 Table 1 Primer sequences of qRT-PCR |
7.CCK-8法检测细胞增殖的情况:将细胞分为正常细胞组、Ad-HK组、Ad-SSB1-shRNA组、单纯照射(IR)组、Ad-HK+IR组、Ad-SSB1-shRNA+IR组,共6组。96孔板细胞接种密度为每孔2×103,培养24 h后按分组及MOI=50加入病毒液,培养48 h后更换新鲜培养液,并送至60Co放射源,按文献[7]方法,一次性照射5 Gy,吸收剂量率为0.5 Gy/min,源靶距80 cm。继续培养24、48、72、96和120 h后,每孔加入10 μl CCK-8试剂,继续培养2 h。每组设3个复孔并设调零孔,酶联仪450 nm波长测定各孔吸光度(A)值,取均值绘制细胞增殖曲线。存活率(%)=(处理组A值-调零孔A值)/(正常组A值-调零孔A值)× 100%。
8.γ-H2AX免疫荧光法检测焦点形成动态变化:以2×104 /ml的密度接种6孔板爬片,分为Ad-SSB1-shRNA组、Ad-HK组,按上法进行转染72 h后,以5 Gy一次性照射,检测各组照射后1、4和16 h的γ-H2AX焦点形成情况。细胞爬片按免疫荧光法操作步骤制片,荧光显微镜下采集图像,每个样品至少计数50细胞,每组设3个复孔,求其平均焦点数,进行3次独立实验。
9.统计学处理:数据用x±s表示。采用SPSS 16.0软件进行分析,经正态性检验,符合正态分布。成组设计资料采用独立样本t检验,两样本率比较采用χ2检验,多组计量资料的比较采用方差分析,多个均数之间两两比较采用LSD检验。P<0.05为差异有统计学意义。
结果1.SMG细胞原代培养及鉴定:第3天大部分组织块已贴壁并爬出少量细胞,第7天组织块周围爬出许多铺路石样细胞,大部分细胞呈多边形或三角形、少数为长梭形,组织块周边会有散在少量成纤维样梭形细胞。经纯化并传代后,第1、2代细胞形态较好、增殖生长能力较强,第3代之后细胞开始出现老化,生长缓慢。Pan-CK及α-Amylase免疫组织化学染色均呈阳性,细胞呈三角形或多边形。细胞伸展良好,核膜及包膜清晰,胞核蓝染,胞质呈棕黄色。
2.细胞转染效率评估:培养72 h后,在倒置荧光显微镜下观察Ad-SSB1-shRNA组和Ad-HK组的EGFP表达情况(图 1),EGFP表达阳性率分别为(87.14±4.65)%和(85.26 ±3.17)%,转染效率均接近90%。Ad-SSB1-shRNA组和Ad-HK组间EGFP表达阳性率差异无统计学意义(P>0.05)。

|
图 1 转染72 h后荧光显微镜下的EGFP表达 ×40 A.Ad-SSB1-shRNA组;B. Ad-HK组 Figure 1 The image of EGFP expressed cells under fluorescence microscope at 72 h after gene transfection ×40 A. Ad-SSB1-shRNA group; B. Ad-HK group |
3. qRT-PCR检测shRNA沉默效果:正常细胞组、Ad-HK组和Ad-SSB1-shRNA组的相对表达量分别为1.00±0.02、0.98±0.05和0.22±0.12。Ad-SSB1-shRNA组SSB1相对表达量明显低于正常细胞组,差异有统计学意义(t=16.24,P<0.05)。而Ad-HK组SSB1的相对表达量与正常细胞组比较,差异无统计学意义(P>0.05)。
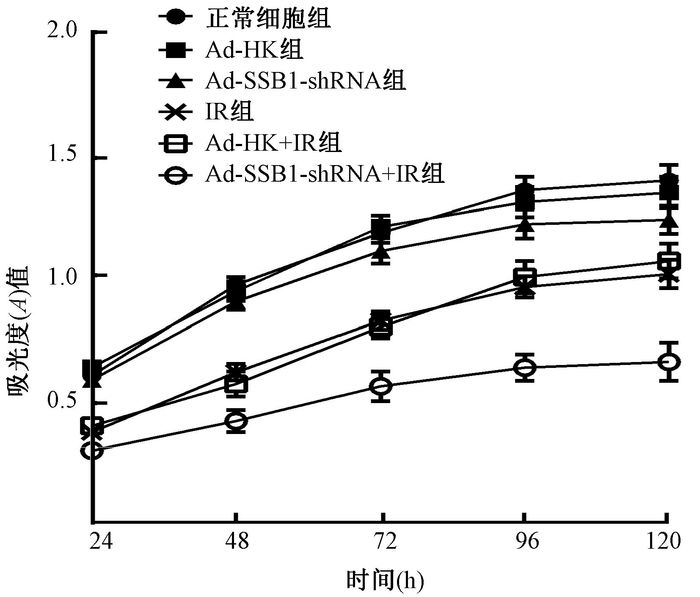
4.CCK-8法检测细胞增殖情况:在不照射情况下,24、48、72和96 h各时间点A值均呈上升趋势,但不同时间点各组之间A值比较,差异无统计学意义(P>0.05),120 h Ad-SSB1-shRNA组A值明显低于正常细胞组,差异有统计学意义(t=3.29,P<0.05)。予以5 Gy照射后,24、48、72、96和120 h各时间点A值也呈上升趋势,但都明显低于正常细胞组。不同时间点Ad-SSB1-shRNA+IR组A值均低于IR组、Ad-HK+IR组,差异有统计学意义(F=10.19~30.13,P<0.05),但IR组和Ad-HK+IR组吸光度(A)值比较,差异无统计学意义(P>0.05,图 2)。照射后120 h时Ad-SSB1-shRNA组存活率较Ad-HK组存活率下降了(7.89±0.99)%。经照射后Ad-SSB1-shRNA+IR组存活率较Ad-HK+ IR组存活率下降了(29.32±0.09)%,差异有统计学意义(t=37.34,P<0.05),提示Ad-SSB1-shRNA+IR组细胞存活率下降更明显(表 2)。
|
图 2 CCK-8法检测细胞受照5 Gy后的增殖情况 注:IR.单纯照射 Figure 2 Time-response of the growth of SMG cells after 5 Gy irradiation |
|
|
表 2 照射后120 h 6组细胞的存活情况(%,x±s) Table 2 Survival rate of SMG cells of 6 groups at 120 h after irradiation(%, x±s) |
5.免疫荧光法检测γ-H2AX焦点形成动态变化:予以5 Gy照射后1 h,两组γ-H2AX焦点数均达到最大值,差异无统计学意义(P>0.05)。而后Ad-HK+IR组γ-H2AX焦点数急剧减少,16 h时γ-H2AX焦点数已基本消退,接近正常水平。但Ad-SSB1-shRNA+IR组γ-H2AX焦点数消退明显减缓,16 h时γ-H2AX焦点数水平相当于4 h时Ad-HK+IR组γ-H2AX焦点数水平(表 3)。
|
|
表 3 不同细胞处理组照射后不同时间点γ-H2AX焦点形成数(x±s) Table 3 The number of γ-H2AX foci in different groups of SMG cells at different time points after irradiation(x±s) |
讨论
正常涎腺细胞是高度分化的终末细胞,容易受到成纤维细胞竞争性抑制, 因此,体外分离、培养涎腺腺上皮细胞具有一定难度。本研究在以往的培养方法上进行改进,取材选自出生3 d的SD乳鼠颌下腺,此时的颌下腺细胞增殖能力旺盛而易于培养,且包膜及结缔组织发育尚未成熟,易于显微镜下分离剔除。此外,用组织块联合胰酶消化法取代单纯组织块法,更利于分散的组织块中细胞爬出。所培养的细胞经免疫组织化学法检测广谱角蛋白和α-淀粉酶表达均呈阳性,证实为上皮来源并具有分泌淀粉酶能力的颌下腺细胞。重组腺病毒载体作为近年来一种新型的载体,具有非稳定转染性、低离体细胞毒性和高滴度的特性,非常适合一些传代能力较差的原代细胞。因此,本研究选择重组腺病毒载体,其携带的增强型1plus2 shRNA中,每个shRNA均能独立地有效转录[8],极大地提高了下调目的基因表达的能力。经qRT-PCR检测,SSB1基因mRNA表达较对照组明显下调。当前研究表明,细胞辐射敏感性与其DSBs的修复能力有关[9-11],而DSBs则是电离辐射所致的最主要的损伤形式。近年来发现两种SSBs,包括hSSB1和hSSB2,其中hSSB1被证实在DSBs后的同源重组修复中至关重要[12]。研究证明,hSSB1在招募MRN复合体(Mre11、Rad50和NBS1) 至DSBs以及有效切除DSBs过程中是必不可少的[4-5]。除了参与到hSSB1-MRN复合体中,hSSB1也是SOSS1复合体(hSSB1、INTS3和C9orf80) 中的成员,在同源重组介导的DNA修复通路中起到重要作用[13-15]。此外,hSSB1在DNA损伤反应早期时就能直接与单链DNA结合,早于并且不依赖MRN复合体或SOSS1复合体[4-5, 15]。
经细胞增殖实验发现在未照射组中,Ad-shRNA组细胞率先进入平台期,增殖活力较对照组稍有下降。Shi等[16]利用SSB1基因敲除的胚胎小鼠成纤维细胞进行细胞增殖实验,也发现较对照组出现轻微下降的增殖活性。这种不显著的增殖活性下降可能是因为随着培养基中毒性物质的增多及堆积抑制,正常复制过程中复制叉的不稳定性增高但得不到有效修复,使DNA损伤积累,最终导致细胞死亡[17]。受损复制叉出现后,SSB1能快速募集到损伤点,并通过激活ATR酶介导的修复路径[18],使得停滞的复制叉重新启动或受损的复制叉得以修复。但在SSB1缺陷的细胞中,ATR酶不再聚集到受损复制叉上,从而阻碍修复进程。此外,前期SSB2代偿性地维持着复制稳定性,参与受损复制叉的修复[19],但这种代偿性修复能力是有限的。而Ad-SSB1-shRNA+IR组增殖活力明显受损,存活率下降明显。这种较显著的增殖活力下降很大程度上可能是由于细胞DSBs修复进程受阻。Richard等[3]认为辐射处理后,缺乏SSB1的细胞对辐射敏感,并对DSBs的修复反应丧失, 包括ATM介导的损伤信号传导、细胞周期检测点的激活、同源重组修复等都将消失或者受损。ATM酶介导的信号传导通路是细胞受辐射后存活的重要途径。研究发现,抑制SSB1的活性会导致ATM酶以及下游的靶蛋白的磷酸化受限[3],从而削弱ATM酶介导的损伤信号传导,减缓修复进程。在细胞周期进程调控方面,当DSBs发生时,SSB1能够分别与p53及p21直接作用来阻止它们被泛素化的方式降解,保证G-1S期转换与G-2M检测点正常运行,从而为损伤修复提供宝贵的时间[20-21]。SSB1缺乏将使细胞DNA损伤检测点受损及细胞周期进程紊乱。
DSBs发生后诱导产生γ-H2AX,且γ-H2AX和DSBs的量存在一一对应关系,因此被认为是一种早期检测DSBs最有效的生物学标志物[22]。本研究中,5 Gy照射后1 h,Ad-SSB1-shRNA+IR组和Ad-HK+IR组γ-H2AX焦点数均达到了峰值,说明SSB1沉默后,放射引起的DSBs应答反应活化均正常。而后Ad-SSB1-shRNA+IR组γ-H2AX焦点数下降趋势明显慢于Ad-HK+IR组,说明前者的DSBs修复进程减缓,充分体现了SSB1在DSBs损伤修复中的重要作用。此外,未照射时的Ad-SSB1-shRNA组存在接近正常水平的γ-H2AX焦点,说明沉默SSB1后早期对正常SMG细胞并未造成明显DSBs。但近期Feldhahn等[19]发现在敲除SSB1的小鼠B淋巴细胞中,没有找到证据来支持SSB1参与辐射导致的DNA损伤反应的启动,因此提出质疑。可见SSB1关于DNA损伤修复的组织细胞特异性的研究还有待进一步探索。本研究初步明确了SSB1对大鼠SMG细胞照射后DSBs修复的重要作用,为后续的研究奠定了基础,也将进一步揭示涎腺细胞照射后SSB1动态表达变化及其与MRN复合体在DSBs修复信号通路中的关系,完善涎腺放射敏感机制理论。
利益冲突 无作者贡献声明 陈龙负责实验操作、收集分析数据和论文撰写;吕秋丽、义彬玲协助实验操作;孙喆负责动物养殖及放射操作;王代友负责实验设计、指导写作和修改
| [1] | Konings AW, Coppes RP, Vissink A. On the mechanism of salivary gland radiosensitivity[J]. Int J Radiat Oncol Biol Phys, 2005, 62 (4): 1187-1194. DOI:10.1016/j.ijrobp.2004.12.051. |
| [2] | Vissink A, Mitchell JB, Baum BJ, et al. Clinical management of salivary gland hypofunction and xerostomia in head-and-neck cancer patients: successes and barriers[J]. Int J Radiat Oncol Biol Phys, 2010, 78 (4): 983-991. DOI:10.1016/j.ijrobp.2010.06.052. |
| [3] | Richard DJ, Bolderson E, Cubeddu L, et al. Single-stranded DNA-binding protein hSSB1 is critical for genomic stability[J]. Nature, 2008, 453 (7195): 677-681. DOI:10.1038/nature06883. |
| [4] | Richard DJ, Savage K, Bolderson E, et al. hSSB1 rapidly binds at the sites of DNA double-strand breaks and is required for the efficient recruitment of the MRN complex[J]. Nucleic Acids Res, 2011, 39 (5): 1692-1702. DOI:10.1093/nar/gkq1098. |
| [5] | Richard DJ, Cubeddu L, Urquhart AJ, et al. hSSB1 interacts directly with the MRN complex stimulating its recruitment to DNA double-strand breaks and its endo-nuclease activity[J]. Nucleic Acids Res, 2011, 39 (9): 3643-3651. DOI:10.1093/nar/gkq1340. |
| [6] |
柳康, 王越, 彭慧敏, 等. 大鼠下颌下腺细胞培养及其生物学特性研究[J].
口腔医学研究, 2016, 32 (8): 816-818. Liu K, Wang Y, Peng HM, et al. A study of submandibular gland cell culture and its biological characteristics[J]. J Oral Sci Res, 2016, 32 (8): 816-818. DOI:10.13701/j.cnki.kqyxyj.2016.08.010. |
| [7] | Xiang B, Han L, Wang X, et al. Nicotinamide phosphoribosyl transferase upregulation by phenylephrine reduces radiation injury in submandibular gland[J]. Int J Radiat Oncol Biol Phys, 2016, 96 (3): 538-546. DOI:10.1016/j.ijrobp.2016.06.2442. |
| [8] | Moore CB, Guthrie EH, Huang MT, et al. Short hairpin RNA (shRNA): design, delivery, and assessment of gene knockdown[J]. Methods Mol Biol, 2010, 629 : 141-158. DOI:10.1007/978-1-60761-657-3_10. |
| [9] | Granzotto A, Benadjaoud MA, Vogin G, et al. Influence of nucleoshuttling of the ATM protein in the healthy tissues response to radiation therapy: toward a molecular classification of human radiosensitivity[J]. Int J Radiat Oncol Biol Phys, 2016, 94 (3): 450-460. DOI:10.1016/j.ijrobp.2015.11.013. |
| [10] | Maeda J, Froning CE, Brents CA, et al. Intrinsic radiosensitivity and cellular characterization of 27 canine cancer cell lines[J]. PLoS One, 2016, 11 (6): e0156689 DOI:10.1371/journal.pone.0156689. |
| [11] | Mumbrekar KD, Goutham HV, Vadhiraja BM, et al. Polymorphisms in double strand break repair related genes influence radiosensitivity phenotype in lymphocytes from healthy individuals[J]. DNA Repair(Amst), 2016, 40 : 27-34. DOI:10.1016/j.dnarep.2016.02.006. |
| [12] | Touma C, Kariawasam R, Gimenez AX, et al. A structural analysis of DNA binding by hSSB1 (NABP2/OBFC2B) in solution[J]. Nucleic Acids Res, 2016, 44 (16): 7963-7973. DOI:10.1093/nar/gkw617. |
| [13] | Huang J, Gong Z, Ghosal G, et al. SOSS complexes participate in the maintenance of genomic stability[J]. Mol Cell, 2009, 35 (3): 384-393. DOI:10.1016/j.molcel.2009.06.011. |
| [14] | Li Y, Bolderson E, Kumar R, et al. HSSB1 and hSSB2 form similar multiprotein complexes that participate in DNA damage response[J]. J Biol Chem, 2009, 284 (35): 23525-23531. DOI:10.1074/jbc.C109.039586. |
| [15] | Skaar JR, Richard DJ, Saraf A, et al. INTS3 controls the hSSB1-mediated DNA damage response[J]. J Cell Biol, 2009, 187 (1): 25-32. DOI:10.1083/jcb.200907026. |
| [16] | Shi W, Bain AL, Schwer B, et al. Essential developmental, genomic stability, and tumour suppressor functions of the mouse orthologue of hSSB1/NABP2[J]. PLoS Genet, 2013, 9 (2): e1003298 DOI:10.1371/journal.pgen.1003298. |
| [17] | Bolderson E, Petermann E, Croft L, et al. Human single-stranded DNA binding protein 1 (hSSB1/NABP2) is required for the stability and repair of stalled replication forks[J]. Nucleic Acids Res, 2014, 42 (10): 6326-6336. DOI:10.1093/nar/gku276. |
| [18] | Lupardus PJ, Byun T, Yee MC, et al. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint[J]. Genes Dev, 2002, 16 (18): 2327-2332. DOI:10.1101/gad.1013502. |
| [19] | Feldhahn N, Ferretti E, Robbiani DF, et al. The hSSB1 orthologue Obfc2b is essential for skeletogenesis but dispensable for the DNA damage response in vivo[J]. EMBO J, 2012, 31 (20): 4045-4056. DOI:10.1038/emboj.2012.247. |
| [20] | Xu S, Feng Z, Zhang M, et al. hSSB1 binds and protects p21 from ubiquitin-mediated degradation and positively correlates with p21 in human hepatocellular carcinomas[J]. Oncogene, 2011, 30 (19): 2219-2229. DOI:10.1038/onc.2010.596. |
| [21] | Xu S, Wu Y, Chen Q, et al. hSSB1 regulates both the stability and the transcriptional activity of p53[J]. Cell Res, 2013, 23 (3): 423-435. DOI:10.1038/cr.2012.162. |
| [22] |
刘敏, 赵苒. γH2AX检测在DNA双链断裂研究中应用[J].
中国公共卫生, 2015, 31 (6): 742-746. Liu M, Zhao R. Application of γH2AX assay in measurement of DNA double stand breaks[J]. Chin J Public Health, 2015, 31 (6): 742-746. DOI:10.11847/zgggws2015-31-06-14. |
 2017, Vol. 37
2017, Vol. 37


