2. 450052 郑州大学第一附属医院放疗科;
3. 450052 郑州大学第一附属医院妇科
2. Department of Radiotherapy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
3. Department of Gynaecology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
宫颈癌的发病率在女性生殖器官恶性肿瘤中位居第2位,严重危害着女性的生命健康。目前放射治疗是宫颈癌的主要治疗方法之一。据统计有超过80%的宫颈癌患者需要接受放射治疗,临床上Ⅰ和Ⅱ期的患者经过放射治疗后5年生存率为65%~85%[1]。并且放射治疗容易引起并发症,如放射性直肠炎、膀胱炎、盆腔纤维化等,因此降低放射剂量、提高宫颈癌细胞放射敏感性一直是临床研究的热点。
小檗碱又称为黄连素,是提取至毛莨科植物黄连的一种生物碱,属于异喹啉类,对心律失常、高血压、心力衰竭等有一定的改善作用[2-4]。近年来的研究表明,小檗碱能够影响癌细胞的生长,促进癌细胞的凋亡,对肿瘤具有一定的抑制作用[5-6]。本研究主要探讨小檗碱对宫颈癌细胞生长、凋亡及放射敏感性的影响,以期为小檗碱治疗宫颈癌提供理论依据。
材料与方法1.细胞、试剂及仪器:人宫颈癌细胞Siha、HeLa、Caski均购自于中国科学院细胞库。胎牛血清购自美国GIBCO公司;RPMI 1640培养基、胰蛋白酶购自美国Sigma公司;Cell Counting Kit(CCK-8) 试剂盒购自上海前尘生物科技有限公司;BD 556547 AnnexinV-FITC/PI细胞凋亡双染试剂盒、BD 340242细胞周期检测试剂盒均购自美国BD公司;P0012二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自上海碧云天生物技术研究所;活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3) 单克隆抗体、细胞周期素B1(Cyclin Bl)单克隆抗体、细胞周期蛋白依赖性激酶1(CDK1) 单克隆抗体、信号转导和转录因子(STAT)单克隆抗体、磷酸化的STAT3(p-STAT3) 单克隆抗体、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体均购自于美国Cell Signaling公司;Attune NxT流式细胞仪购自美国Thermo公司;Clinac 23EX直线加速器购自美国Varian公司。
2.细胞培养:将人宫颈癌细胞Siha、HeLa、Caski加入到含有10%胎牛血清的RPMI 1640细胞培养液中,800 r/min,离心半径5 cm,离心5 min,弃上清液,加入5 ml的细胞培养液混合后,放在饱和湿度、5%CO2培养箱中培养,观察细胞融合度达到80%时,吸除细胞培养液,加入含有0.25%胰蛋白酶消化液2 ml,37℃消化2 min,观察细胞变成圆形时,加入RPMI 1640培养基,800 r/min,离心半径5 cm,离心5 min,用细胞培养液悬浮细胞后,接种到细胞培养板中继续培养。
3.细胞增殖活性检测:细胞增殖能力检测用CCK-8法。取培养至对数生长期的宫颈癌细胞,去除上清液,加入胰蛋白酶消化后,用细胞培养液悬浮细胞,以每孔中加入5 000细胞接种到96孔细胞培养板中,每孔中加入100 μl的细胞悬浮液,培养24 h后,弃上清,用小檗碱终浓度为5、10、15、20 μmol/L的细胞培养液培养细胞48 h,记为给药组。同时将只加入二甲基亚砜(DMSO)溶液的细胞记为对照组,不加细胞的记为空白组,每组设置6个复孔。培养结束后,加入10 μl的CCK-8溶液,放在37℃孵育2 h后,检测490 nm处的吸光度值(A)。细胞增殖活性=(给药组A值-空白组A值)/(对照组A值-空白组A值)×100%。
4.细胞凋亡检测:取105/ml的人宫颈癌细胞Siha,接种到35 cm2的细胞培养瓶中,每个细胞培养瓶中加入5 ml的细胞悬浮液,细胞贴壁后,弃去上清液,加入含有半数抑制浓度的小檗碱培养液,培养48 h后,加入胰蛋白酶消化,收集106个细胞,加入5 μl的膜联蛋白V-FITC(Annexin V-FITC),混合均匀后,放在4℃避光环境下反应15 min,再加入10 μl的碘化丙啶(PI)溶液,同样放在4℃避光环境下反应5 min,流式细胞仪检测细胞凋亡。
5.细胞周期检测:取培养至对数生长期的宫颈癌细胞Siha,接种到6孔细胞培养板中,每孔中加入6×104细胞,培养过夜后,更换为含有半数抑制浓度的小檗碱培养液,培养48 h后,离心半径5 cm,800 r/min离心5 min,吸除上清液,用冰预冷的75%的乙醇放在4℃固定24 h后,收集106个细胞,用磷酸盐缓冲液悬浮细胞,离心5 min,收集细胞,用含有5 μl的浓度为1 mg/ml的PI和10 μl的浓度为10 mg/ml的核糖核酸酶A(RNAseA)的磷酸盐缓冲液悬浮细胞,放在37℃中反应30 min,流式细胞仪检测细胞周期。
6.照射条件:采用6 MV X射线,吸收剂量率400 cGy/min,源靶距100 cm。
7.细胞克隆形成实验:含有半数抑制浓度的小檗碱培养液培养宫颈癌细胞Siha 24 h后,用0、2、4、6、8 Gy照射细胞,放在37℃,5%CO2培养箱中培养12 d,期间每隔3天更换1次培养液。观察细胞培养板中出现细胞克隆后,吸除细胞培养液,用甲醇固定20 min,姬姆萨染色,计算分析细胞克隆形成率。利用Graphpad Prism软件进行曲线拟合,绘制存活曲线。克隆形成率(PE)=克隆数/接种细胞数×100%;存活分数(SF)=受照射细胞克隆形成率/对照细胞克隆形成率×100%。
8.细胞中Cleaved Caspase-3、Cyclin B1、CDK1、STAT3、p-STAT3水平检测:收集细胞,用半数抑制浓度的小檗碱培养液培养Siha细胞48 h后,将细胞加入磷酸盐缓冲液重悬细胞,800 r/min,离心半径5 cm,离心5 min,吸除上清液,加入细胞裂解液(苯甲基磺酰氟与蛋白裂解液体积比例为1 :100),每组加入80 μl的裂解液,放在冰上裂解30 min后,4℃,12 000 r/min离心半径5 cm,离心10 min。吸取蛋白上清液,BCA法对蛋白进行定量检测。将蛋白样品与5×上样缓冲液混合,其中每40 μg的蛋白样品加入5 μl的缓冲液,放在100℃煮沸反应5 min,加入到蛋白凝胶上样孔中(每孔50 μl),蛋白凝胶用10%的分离胶和6%的浓缩胶,80V电压电泳30 min后,130 V直至溴酚蓝进入分离胶的下端边缘。取出凝胶,在4℃,100 V电压条件下转膜60 min,用5%脱脂奶粉在室温下封闭60 min后,在800倍稀释的一抗(4℃,过夜)、1 000倍稀释的二抗(37℃,60 min)中充分反应后,曝光,洗片,分析目的蛋白的表达趋势。
9.统计学处理:所得的实验数据均采用SPSS 22.0软件分析。计量资料以x ±s表示。所有数据符合正态分布,对细胞存活率、凋亡率、周期、蛋白相对表达量、存活分数两组数据比较用独立样本t检验。P < 0.05为差异有统计学意义。
结果1.小檗碱对3种细胞增殖活性的影响:宫颈癌细胞Siha、HeLa、Caski经过5、10、15、20 μmol/L的小檗碱作用后,细胞增殖活性降低,半数抑制浓度依次为(16.84±3.52)、(23.54±8.67)、(21.86±6.35)μmol/L。从表 1中可以看出,小檗碱对Siha细胞的生长抑制作用比其他两组更强,对后续选用17 μmol/L的小檗碱作用于Siha细胞进一步研究。
|
|
表 1 不同浓度小檗碱对3种细胞增殖活性的影响(%,x ±s) Table 1 Effects of different concentrations of berberine on the proliferation of 3 kinds of cervical cancer cell lines(%, x ±s) |
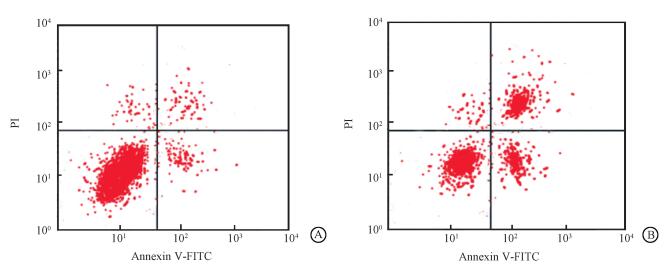
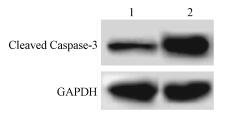
2.小檗碱对细胞凋亡影响:见图 1,2。流式细胞仪检测结果显示,对照组和给药组细胞凋亡率依次为:(9.32±0.95)%、(32.25±1.25)%。小檗碱作用后的宫颈癌Siha细胞凋亡增多(t=56.847,P < 0.05)。小檗碱作用后的宫颈癌细胞中Cleaved Caspase-3表达增多,以GAPDH为内参,计算对照组和小檗碱作用组中Cleaved Caspase-3表达量依次为0.23±0.06、0.97±0.09。提示小檗碱可能通过提高Cleaved Caspase-3表达,促进宫颈癌细胞凋亡。
|
图 1 小檗碱对宫颈癌Siha细胞凋亡的影响A.对照组;B.给药组 Figure 1 Effect of berberine on apoptosis of Siha cells A.Control group; B.Berberine group |
|
图 2 小檗碱对宫颈癌Siha细胞中凋亡相关蛋白Cleaved Caspase-3表达影响 注:1.对照组;2.给药组 Figure 2 Effects of berberine on expression of apoptosis relatedprotein Cleaved Caspase-3 in Siha cells |
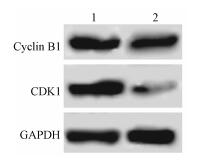
3.小檗碱对宫颈癌细胞周期的影响:结果列于表 2,3。小檗碱作用后的细胞G2/M期数目增多,说明小檗碱能够将细胞阻滞在G2/M期,随着药物浓度的增加,G2/M期比例增加(明显,浓度依赖t=47.251, P < 0.05),S期几乎没有变化,而G1期比例减少(t=36.514, P < 0.05)。检测细胞周期相关蛋白Cyclin B1、CDK1表达情况,如图 3中所示,Cyclin B1、CDK1蛋白水平下降,以GAPDH为内参,对照组和给药组中Cyclin B1蛋白表达量依次为1.14±0.08、0.85±0.07,CDK1蛋白表达量依次为1.09±0.12、0.36±0.04。提示小檗碱可能通过降低Cyclin B1、CDK1蛋白水平影响宫颈癌细胞周期。
|
|
表 2 小檗碱对宫颈癌Siha细胞周期影响(%,x ±s) Table 2 Effects of berberine on cell cycle of Siha cells(%, x ±s) |
|
|
表 3 单击多靶模型参数值 Table 3 Multiple target model parameters |
|
图 3 小檗碱对宫颈癌Siha细胞中周期相关蛋白Cyclin B1、CDK1表达影响 注:1.对照组;2.给药组 Figure 3 Effects of berberine on the expression of Cyclin B1 and CDK1 in Siha cells |
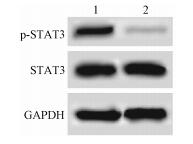
4.细胞中STAT3、p-STAT3水平检测:结果见图 4。小檗碱作用后的宫颈癌细胞中p-STAT3水平下降,而STAT3水平没有变化。以GAPDH为内参,对照组和小檗碱作用组中p-STAT3蛋白表达量依次为0.82±0.06、0.15±0.04,STAT3蛋白表达量依次为1.04±0.08、1.05±0.07。提示小檗碱可能通过作用于STAT3磷酸化影响宫颈癌细胞的生长和凋亡。
|
图 4 小檗碱对宫颈癌细胞中STAT3/p-STAT3表达影响 注:1.对照组;2.给药组 Figure 4 Effect of berberine on STAT3/p-STAT3 expression in Siha cells |
5.小檗碱对宫颈癌细胞放疗敏感性影响:通过细胞克隆实验检测小檗碱对宫颈癌细胞放射敏感性的作用,对照组和给药组集落形成数依次为:(172.58±28.64)、(68.25±16.18)(t=56.241,P < 0.05)。从图 5可以看出,小檗碱作用后的细胞存活分数降低,表 3结果显示,小檗碱能够提高宫颈癌的放射敏感性,增敏比为1.550。

|
图 5 X射线照射后Siha细胞存活曲线 Figure 5 The survival curves of siha cells after X-ray irradiation |
讨论
小檗碱最初常用来治疗糖尿病、心律失常等疾病,随着研究的不断发展,小檗碱对白血病、胶质瘤、前列腺癌、胃癌、食管癌等癌症均具有抑制作用[7]。小檗碱能够抑制乳腺癌细胞的生长,能够阻滞黑色素瘤细胞周期,诱导黑色素瘤细胞在G1期停滞[8]。还有研究表明,小檗碱能够下调Cyclin B1的表达,抑制胃癌、肝癌细胞增殖,使癌细胞周期阻滞在G2期[9-11]。本研究选取3种人宫颈癌细胞,用5、10、15、20 μmol/L的小檗碱作用后,CCK-8法检测了细胞的增殖活性,发现小檗碱能够抑制宫颈癌细胞Siha、HeLa、Caski的增殖,而对Siha细胞的抑制作用最为明显。
癌细胞的生长、凋亡受到多种细胞因子的共同调控,是一个极其复杂的过程[12]。Caspase是一个目前公认的与细胞凋亡有关的蛋白家族,而在这个蛋白家族中Caspase-3是凋亡执行因子,当细胞凋亡信号发出时,传递至Caspase-3,导致Caspase-3活化,细胞凋亡发生[13-15]。Cyclin B1和CDK1是与细胞周期相关的蛋白[16]。有研究表明,小檗碱能够作用于Cyclin B1和CDK1而导致癌细胞周期阻滞在G2期[17-19]。本研究用17 μmol/L的小檗碱作用后,宫颈癌细胞Siha早期凋亡和晚期凋亡数目均升高,细胞周期在G2/M期受到阻滞,而进一步检测发现,小檗碱作用后的细胞中Caspase-3活化水平升高,细胞中Cyclin B1和CDK1表达水平下降。说明小檗碱可能促进Caspase-3活化影响宫颈癌细胞凋亡,可能通过下调Cyclin B1和CDK1表达水平使宫颈癌细胞周期阻滞在G2/M期。
STAT3在肿瘤的发生过程中发挥重要作用[20]。有研究表明,STAT3在肿瘤组织中磷酸化异常增多,STAT3信号通路异常活化,而抑制STAT3活化后,肿瘤细胞的凋亡增多,生长受到明显的抑制作用[21-22]。本研究进一步探讨了小檗碱对宫颈癌细胞中STAT3信号通路的影响,发现小檗碱作用后宫颈癌细胞中STAT3磷酸化水平降低。提示小檗碱可能通过抑制STAT3信号通路的激活促进宫颈癌细胞凋亡,抑制宫颈癌细胞生长,阻滞宫颈癌细胞周期。
本研究中,通过细胞克隆实验检测了小檗碱对宫颈癌细胞放疗敏感性的影响,发现小檗碱可降低宫颈癌细胞存活分数,放射增敏比为1.550。提示小檗碱能够提高宫颈癌细胞放射敏感性。
综上所述,小檗碱能够抑制宫颈癌细胞生长,促进宫颈癌细胞凋亡,提高宫颈癌细胞放疗敏感性。随着药物浓度的增加,G2/M期比例明显增加,S期几乎没有变化,而G1期比例减少。本研究结果为后续在体内研究小檗碱对宫颈癌细胞的作用及机制提供了实验依据。
利益冲突 所有作者共同认可文章无相关利益冲突作者贡献声明 刘明珠负责实验操作和论文撰写;樊锐太负责实验设计和论文审校;顾浩和王新杰负责资料收集和协助实验;刘艳杰参与论文修改
| [1] | Bhosale PR, Iyer RB, Ramalingam P, et al. Is MRI helpful in assessing the distance of the tumour from the internal os in patients with cervical cancer below FIGO Stage IB2?[J]. Clin Radiol, 2016, 71 (6): 515-522. DOI:10.1016/j.crad.2016.02.009. |
| [2] | Zhao GL, Yu LM, Gao WL, et al. Berberine protects rat heart from ischemia/reperfusion injury via activating JAK2/STAT3 signaling and attenuating endoplasmic reticulum stress[J]. Acta Pharmacol Sin, 2016, 37 (3): 354-367. DOI:10.1038/aps.2015.136. |
| [3] | Shin JS, Choi HE, Seo S, et al. Berberine decreased inducible nitric oxide synthase mRNA stability through negative regulation of human antigen R in lipopolysaccharide-induced macrophages[J]. J Pharmacol Exp Ther, 2016, 358 (1): 3-13. DOI:10.1124/jpet.115.231043. |
| [4] | Vivoli E, Cappon A, Milani S, et al. NLRP3 inflammasome as a target of berberine in experimental murine liver injury:interference with P2X7 signalling[J]. Clin Sci (Lond), 2016, 130 (20): 1793-1806. DOI:10.1042/CS20160400. |
| [5] | Naveen CR, Gaikwad S, Agrawal-Rajput R. Berberine induces neuronal differentiation through inhibition of cancer stemness and epithelial-mesenchymal transition in neuroblastoma cells[J]. Phytomedicine, 2016, 23 (7): 736-744. DOI:10.1016/j.phymed.2016.03.013. |
| [6] | Su YH, Tang WC, Cheng YW, et al. Targeting of multiple oncogenic signaling pathways by Hsp90 inhibitor alone or in combination with berberine for treatment of colorectal cancer[J]. Biochim Biophys Acta, 2015, 1853 (10 Pt A): 2261-2272. DOI:10.1016/j.bbamcr.2015.05.012. |
| [7] | Varghese FS, Thaa B, Amrun SN, et al. The antiviral alkaloid berberine reduces chikungunya virus-induced mitogen-activated protein kinase signaling[J]. J Virol, 2016, 90 (21): 9743-9757. DOI:10.1128/JVI.01382-16. |
| [8] | Kou Y, Li L, Li H, et al. Berberine suppressed epithelial mesenchymal transition through cross-talk regulation of PI3K/AKT and RARα/RARβ in melanoma cells[J]. Biochem Biophys Res Commun, 2016, 479 (2): 290-296. DOI:10.1016/j.bbrc.2016.09.061. |
| [9] | Wen C, Wu L, Fu L, et al. Berberine enhances the antitumor activity of tamoxifen in drugsensitive MCF7 and drugresistant MCF7/TAM cells[J]. Mol Med Rep, 2016, 14 (3): 2250-2256. DOI:10.3892/mmr.2016.5490. |
| [10] | Refaat A, Abdelhamed S, Saiki I, et al. Inhibition of p38 mitogen-activated protein kinase potentiates the apoptotic effect of berberine/tumor necrosis factor-related apoptosis-inducing ligand combination therapy[J]. Oncol Lett, 2015, 10 (3): 1907-1911. DOI:10.3892/ol.2015.3494. |
| [11] | Mittal A, Tabasum S, Singh RP. Berberine in combination with doxorubicin suppresses growth of murine melanoma B16F10 cells in culture and xenograft[J]. Phytomedicine, 2014, 21 (3): 340-347. DOI:10.1016/j.phymed.2013.09.002. |
| [12] | Serresi M, Gargiulo G, Proost N, et al. Polycomb repressive complex 2 is a barrier to KRAS-driven inflammation and epithelial-mesenchymal transition in non-small-cell lung cancer[J]. Cancer Cell, 2016, 29 (1): 17-31. DOI:10.1016/j.ccell.2015.12.006. |
| [13] | Okada K, Hakata S, Terashima J, et al. Combination of the histone deacetylase inhibitor depsipeptide and 5-fluorouracil upregulates major histocompatibility complex class Ⅱ and p21 genes and activates caspase-3/7 in human colon cancer HCT-116 cells[J]. Oncol Rep, 2016, 36 (4): 1875-1885. DOI:10.3892/or.2016.5008. |
| [14] | Anwar S, Fratantonio D, Ferrari D, et al. Berry anthocyanins reduce proliferation of human colorectal carcinoma cells by inducing caspase-3 activation and p21 upregulation[J]. Mol Med Rep, 2016, 14 (2): 1397-1403. DOI:10.3892/mmr.2016.5397. |
| [15] | Sohn D, Peters D, Piekorz RP, et al. miR-30e controls DNA damage-induced stress responses by modulating expression of the CDK inhibitor p21WAF1/CIP1 and caspase-3[J]. Oncotarget, 2016, 7 (13): 15915-15929. DOI:10.18632/oncotarget.7432. |
| [16] | Rattani A, Vinod PK, Godwin J, et al. Dependency of the spindle assembly checkpoint on Cdk1 renders the anaphase transition irreversible[J]. Curr Biol, 2014, 24 (6): 630-637. DOI:10.1016/j.cub.2014.01.033. |
| [17] | Zhang YY, Liu ZB, Ye XG, et al. Iodine regulates G-2/M progression induced by CCL21/CCR7 interaction in primary cultures of papillary thyroid cancer cells with RET/PTC expression[J]. Mol Med Rep, 2016, 14 (4): 3941-3946. DOI:10.3892/mmr.2016.5686. |
| [18] | Liu L, Xu Y, Reiter RJ, et al. Inhibition of ERK1/2 signaling pathway is involved in Melatonin's antiproliferative effect on human MG-63 osteosarcoma cells[J]. Cell Physiol Biochem, 2016, 39 (6): 2297-2307. DOI:10.1159/000447922. |
| [19] | Danilov AV, Hu S, Orr B, et al. Dinaciclib induces anaphase catastrophe in lung cancer cells via inhibition of cyclin-dependent kinases 1 and 2[J]. Mol Cancer Ther, 2016, 15 (11): 2758-2766. DOI:10.1158/1535-7163.MCT-16-0127. |
| [20] | Sanchez-Lopez E, Flashner-Abramson E, Shalapour S, et al. Targeting colorectal cancer via its microenvironment by inhibiting IGF-1 receptor-insulin receptor substrate and STAT3 signaling[J]. Oncogene, 2016, 35 (20): 2634-2644. DOI:10.1038/onc.2015.326. |
| [21] | Kumar V, Cheng P, Condamine T, et al. CD45 phosphatase inhibits STAT3 transcription factor activity in myeloid cells and promotes tumor-associated macrophage differentiation[J]. Immunity, 2016, 44 (2): 303-315. DOI:10.1016/j.immuni.2016.01.014. |
| [22] | Nagathihalli NS, Castellanos JA, VanSaun MN, et al. Pancreatic stellate cell secreted IL-6 stimulates STAT3 dependent invasiveness of pancreatic intraepithelial neoplasia and cancer cells[J]. Oncotarget, 2016, 7 (40): 65982-65992. DOI:10.18632/oncotarget.11786. |
 2017, Vol. 37
2017, Vol. 37
