放射性粒子植入治疗已发展为国际公认的早期前列腺癌标准治疗手段之一[1-4]。中国学者将CT引导技术引入粒子植入治疗领域,提高了治疗的精度,扩展了应用范畴[5-10]。近年来,3D打印模板技术辅助CT引导技术的发展,使粒子植入治疗成为可计划、可控制、可评估的低剂量率近距离微创外科技术,治疗精度进一步提高[11-12]。粒子植入治疗的三维剂量分布已经可以得到精确的控制,因其剂量学特点,尤其适合于治疗外照射后局部失败部位。但经常遇到的问题是,如何给予处方剂量以及)正常组织限量。因患者通常已接受了一程或多程的外照射放疗,且放疗技术,分割模式各不相同。回答这一问题涉及到不同放疗技术,不同分割模式的剂量转换,目前在放射生物学研究中已经有生物有效剂量(biologically effective dose,BED)的模型可应用。本文将通过简单介绍BED的概念和基本公式,引出适合于放射性粒子植入临床应用的简化经验公式。
材料与方法1.放射性粒子植入治疗的BED计算公式:BED是1989年基于放射生物中的L-Q模型提出的,目的是将任意的放射治疗的生物效应量化,考虑到不同的剂量分割模式或剂量率、总剂量和总治疗时间。经过多年的临床应用和理论优化,BED如今广泛的应用于外照射、立体定向外科放疗、近距离放疗、高-LET的粒子束放疗、核素治疗等领域。
对于经典的公式本研究直接引用结论。首先给出外照射分次照射的BED计算公式[13],原始公式较复杂,包含时间参数,而临床应用常去掉时间参数,定义为:
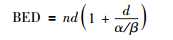
|
(1) |
式中,n为分割次数;d为单次剂量,Gy;α/β值是放射生物学中的经典概念,由L-Q模型引出,反映了肿瘤或者器官对于剂量分割(分次照射)或剂量率(持续低剂量照射)的内在敏感性,Gy。
持续低剂量照射BED计算公式如下[14],本研究后续的推导将围绕此公式开展:
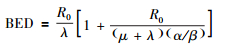
|
(2) |
式中,R0为植入粒子的初始剂量率,Gy/d;λ为核素的衰变常数;μ为修复指数。对于两个常数还有:
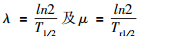
|
(3) |
式中,Tr1/2定义为正常组织或肿瘤的修复半衰期;T1/2为放射性核素的半衰期。其中,如果定义D为持续低剂量照射的总的物理剂量,则有:
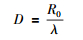
|
(4) |
将公式(4) 代入式(2),可得到:
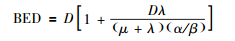
|
(5) |
式(5) 是式(2) 的另一种形式,因为在近距离治疗的计划系统中,肿瘤和器官组织的物理剂量是可以直接读取的,所以运用式(5) 更加方便。
2.放射性粒子植入治疗EQD2的引入:临床上,常用的照射分割单次为2 Gy,而实际应用中,BED并不能直观地与外照射的经验连接起来,所以这里还有必要引入外照射中常用的EQD2的概念,即达到实际给予的治疗方案相同的生物等效剂量需要按照2 Gy的分割给予多少总剂量。按照定义有:
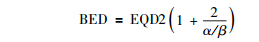
|
(6) |
那么代入公式(2),可得:
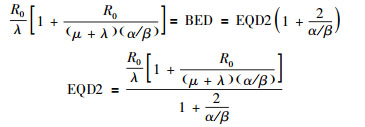
|
(7) |
或

|
(8) |
公式(7) 即为EQD2的定义式,精确计算近距离治疗的EQD2,必须采用公式(7)。公式(8) 为变式,利用公式(7) 或(8) 可以将近距离治疗的物理剂量精确的换算为外照射放疗常用分割方案2 Gy分割的等效生物剂量。
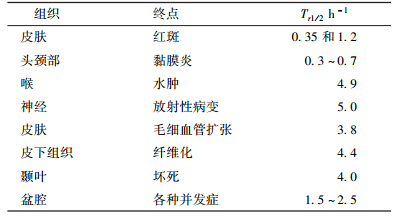
3.放射性粒子植入治疗EQD2计算常用参数和简化公式:公式(7) 涉及的参数繁多,计算复杂,在特殊情况下,可进一步简化为更适合临床应用的公式。将逐步增加约束条件,得到不同限定条件下公式(7) 的近似公式。为方便读者计算使用,笔者总结了见于文献资料的常见肿瘤的α/β值[15]。主要包括:头颈部肿瘤10.5,喉癌14.5,声门癌13,颊黏膜癌6.6,扁桃体癌7.2,鼻咽癌16,皮肤癌8.5,前列腺癌1.1,乳腺癌4.6,食管癌4.9,黑色素瘤0.6。常见组织的α/β值总结见表 1。表 2总结了文献报道的正常组织的Tr1/2值[16]。
|
|
表 1 常见人体正常组织α/β值[15] Table 1 α/β value of human normal tissues |
根据表 2,可以估算晚反应组织的μ值约为3~4 d-1,早反应组织的μ值约为20~60 d-1(此处将单位h-1换算为d-1)。而国内近距离放射性粒子植入治疗最常用的是125I粒子,125I粒子的半衰期是固定的59.4 d,将其带入公式(3),可得出125I粒子的λ值为0.011 67 d-1。无论对于早反应组织还是晚反应组织λ值与μ值均相差两个数量级,相加时几乎可以忽略不计,于是公式(7)、(8) 可以进一步简化为:
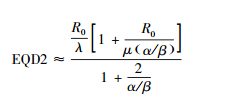
|
简化后可得到125I粒子植入治疗EQD2的初步简化公式
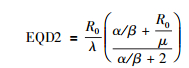
|
(9) |
或
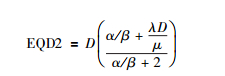
|
(10) |
公式(9) 和(10) 若要进一步简化,应用于日常的临床实践,则需更加缩小范围,增加预设条件。早反应组织的α/β值一般为10左右,μ值为20~60,对于粒子植入治疗常用的剂量范围R0值处于1~2 Gy/d之间。根据公式(9),发现相对于α/β=10,R0/μ≈0可以忽略不计。将其余数值带入公式(9),并将R0/λ替换为D,引出第1个经验公式。EQD2≈10D/12,即王-彭公式1,在临床上要求大致估算时甚至可以近似认为:EQD2≈D,注意始终有EQD2<D。
肿瘤的修复半衰期较短类似于早反应组织,故而王-彭公式1对于一般的恶性肿瘤也适用,不过需要除外α/β值较小的肿瘤,如前列腺癌、乳腺癌、黑色素瘤等。
晚反应组织的简化较为复杂,其α/β值一般为2~3,μ值约为3~4。理想情况下,假设α/β=2,代入公式(10),可知
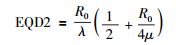
|
忽略R0/4μ项,将R0/λ替换为D,引出第2个经验公式:EQD2≈D/2,即王-彭公式2,注意始终有EQD2>D/2。王-彭公式2的精确程度不如王-彭公式1,由于实际剂量越低R0越低,所以晚反应组织物理受量越低时王-彭公式2的估算越接近于实际;而晚反应组织物理受量越高时,王-彭公式2的估算越偏离实际,临床医师应牢记该经验公式总是低估实际的受量。虽然王-彭公式2精确度不高,但可以为临床实践提供最快捷有效的评估方法。笔者推荐对初诊患者,初步评估风险时可采用两个经验公式,以除外风险极高的患者;而在决定治疗方案,进行治疗计划设计和评估时应采用公式(9)、(10) 进行精确的评估,从而达到最佳的疗效和最小的不良反应。
基于以上的理论基础,本研究的推论,显示了放射性粒子植入治疗的放射生物学优势,以及如何利用将这些优势运用于临床实践。
结果1.放射性粒子植入治疗的放射生物学优势:植入粒子组织的吸收剂量率随距离按照“平方反比定律”衰减,决定了粒子植入治疗可应用于多程放疗后局部失败的病例。根据王-彭经验公式可以得到放射性粒子植入治疗的重要生物学剂量优势,即在给予肿瘤一定剂量的同时,肿瘤临近晚反应组织的EQD2约为肿瘤组织受量的一半。而放射性粒子植入治疗的剂量限制性不良反应多为晚反应组织的不良反应,如神经损伤(瘫痪或麻痹)、血管损伤(大出血等)、肠管穿孔等。故而根据王-彭经验公式,放射性粒子植入治疗“天然的”从生物等效剂量上对晚反应组织进行了保护。
2.实际临床应用举例
例1:不宜手术的原发性肺癌,PET-CT提示局部高代谢SUV值13.4。患者要求接受活检的同时接受粒子植入治疗,计算应给予的物理剂量。
对于根据既往报道,可知要达到肺癌良好的控制剂量,BED应至少达到100 Gy[17]。肺癌取α/β=10,Tr1/2取0.5,则μ=33.26。代入公式(5),解方程可得D≈100 Gy。提示肺癌放射性粒子植入的物理剂量至少应在100 Gy以上才有可能达到良好的局部控制。
例2:食管癌锁骨上淋巴结复发,既往锁骨上区曾接受50 Gy分25次的预防照射,本次拟给予125I粒子植入治疗,计划系统中显示,复发淋巴结mPD为110 Gy,臂丛神经的最大剂量点为60 Gy。计算本次复发淋巴结受到的剂量换算为EQD2,以及臂丛神经两次照射受到的总的EQD2。
根据王-彭经验公式立即可估算,复发淋巴结受到的剂量换算为EQD2=110×10/12=91.6 Gy,臂丛神经本次受量为EQD2=60/2=30 Gy,两次照射总剂量为30+50=80 Gy。
精确计算食管癌取α/β=10,Tr1/2取0.5,代入公式(8),EQD2为92.0Gy。臂丛神经为晚反应组织,取α/β=5,Tr1/2取4,代入公式(8),本次EQD2为44.3Gy,两次总剂量为44.3+50=94.3 Gy。
可见经验公式估算肿瘤或早反应组织的剂量是相当精确的,估算晚反应组织剂量会存在略微低估的现象。
例3:宫颈癌腹膜后淋巴结复发后失败,初程放疗给予调强放射治疗,剂量分割为50.4 Gy分28次,计划系统显示小肠最大剂量点剂量为35 Gy。本次拟给予放射性粒子植入治疗,计划系统显示,复发淋巴结mPD为140 Gy,临近小肠组织的最大剂量点为55 Gy。计算小肠穿孔不良反应的两次总EQD2最高估计为多少。
例3中要求估计EQD2的最高值,则将前后两次最大剂量点剂量叠加即可,不过需先换算为EQD2。首先计算初程放疗小肠穿孔不良反应的EQD2,总剂量35 Gy,分次剂量为35/28=1.25 Gy,查表α/β=3.9。代入公式(1) 和公式(6),计算的EQD2为30.6 Gy。二程治疗的Tr1/2取4,代入公式(8),经计算得EQD2为37.8 Gy。故总剂量为30.6+37.8=68.4 Gy。
解决本题需注意现代外照射放疗采用调强治疗技术之后,实际正常组织的受量的单次剂量与肿瘤的剂量并不相同。
讨论10年来,放射性粒子植入治疗历经了数次技术改进,已做到了精准控制实际给予的剂量[11-12]。但是对于粒子治疗如何给予处方剂量,正常组织剂量如何限定的问题,总是没有明确的答案,甚至没有明确的方向。临床上的处方剂量的依据一般参考国际上前列腺癌的推荐剂量给予,而对于正常组织的受量的回答只能是尽可能低。解答这一问题有实际困难,一是粒子植入治疗的精度受到医师个人经验、技术、医疗设备的影响非常大,没有精确的剂量学,就谈不上剂量学的比较;二是没有标准的剂量学模型用来对比和换算持续低剂量照射和外照射的物理剂量。第1个困难已经随着3D打印模板技术的引入和推广逐渐降低了技术门槛,治疗的精度得以保证,有了精确的剂量学才有可能进行剂量效应关系的研究。第2个困难因为第1个困难的存在往往被忽略,实际的放射生物学模型早在国际上20世纪末期已有报道,但多为理论推导,至少需要初步的高等数学知识才能完全理解,使得即便有心了解的读者也望而却步;另一方面由于国际上体部放射性粒子植入治疗技术发展缓慢,阻碍了理论向实践转化的速度。
随着第一个困难的解决,对于放射性粒子植入治疗的放射生物学模型的需求显得更加迫切。本研究首先引入国际上已存在的计算模型(省去复杂的论证过程),然后进行数学上的简化,最终提出了几乎无需数学基础的极简化公式。目的在于推动BED与EQD2模型在临床上的应用,帮助打通外照射内照射剂量换算、叠加的障碍,从而推进放射性粒子植入治疗的疗效关系的研究上升到一个新的高度。有了此模型,不仅可以研究放射性粒子植入正常组织受量与不良反应发生率的关系,还可以将既往受量考虑在内,研究总剂量与不良反应之间的关系;也可以研究放射性粒子植入肿瘤的EQD2与外照射剂量之间的关系。
目前关于BED是否影响放射性粒子植入治疗的疗效仍没有确定性的结论,相关研究仅见于前列腺癌。Stock等[18]分析1990年至2003年间收治的1 377例接受放射性粒子植入治疗的前列腺癌患者,以D90作为处方剂量计算的BED在多因素分析中,发现治疗后活检阳性率是无前列腺特异抗原(prostate specific antigen,PSA)复发生存的独立预后因素。Miles等[19]总结杜克大学1997年至2003年收治的140例前列腺癌患者,均接受放射性粒子植入治疗,中位随访50个月,结果显示BED,D90、V100均没有预测总生存的统计学意义。
除前列腺癌外,对于放射性粒子植入治疗剂量与疗效关系的报道较少。王皓等[20]回顾性分析2003—2011年间36例复发直肠癌患者接受放射性粒子植入,结果显示术后验证计划D90>140 Gy、V100>90%有利于提高肿瘤局部控制率和总生存期。可惜该研究没有分析正常组织并发症的量效关系。
目前,放射性粒子植入有关的放射生物学有效剂量的计算尚无完美的模型。本研究介绍模型的缺陷包括:计算所需的参数包括α/β值,μ值散在见于不同级别的文献报道,没有系统的,全面的研究,也未获得所有计算所需的精确数据;无论肿瘤还是早反应组织、晚反应组织,其本身即存在异质性,不同个体之间差异更加明显,数学模型只能利用统计学数据得到大致的拟合,而不能作为决策的唯一依据;运用王-彭经验公式时更需小心,需时刻注意作者增加了许多预设条件,该公式仅适用于125I粒子植入治疗的研究,不适用于其他粒子。如需应用于其他粒子或外照射需选择相应的精确计算公式,而非经验公式。即使所有条件均符合应用限制条件,王-彭公式2仍为粗略估计,需知该公式总是会低估实际的EQD2。本研究中,临床计算实例为纯理论推导,真正用于指导临床工作仍需经过大量临床数据资料的验证,目前不推荐没有粒子植入治疗经验和放射生物学基础的医师直接应用于临床,公式计算结果的解读仍需结合临床经验。
对了获得最佳的公式使用条件,需要开展更多的实验室和临床研究,以获得更精确的α/β值和μ值,同时应进行更多的临床试验,以验证EQD2是否可以取代物理剂量获得更加的精确的量效关系。
综上,本文引入见于国际报道的BED计算公式,通过推导给出了适合临床应用的王-彭经验公式。希望有助于放射性粒子植入治疗的研究事业,同时提醒读者谨慎应用公式,注意预设条件,慎重解读计算得出的结果。
利益冲突 无作者贡献声明 彭冉负责搜集资料,公式推导及论文撰写;姜玉良、吉喆、郭福新、庄洪卿负责提供临床典型案例,协助计算及部分论文撰写;孙海涛负责协助公式推导,提供案例的治疗计划;王俊杰负责提出核心问题及思路,并指导论文写作
| [1] | Fellin G, Mirri MA, Santoro L, et al. Low dose rate brachytherapy (LDR-BT) as monotherapy for early stage prostate cancer in Italy: practice and outcome analysis in a series of 2 237 patients from 11 institutions[J]. Br J Radiol, 2016, 89 (1065): 20150981 DOI:10.1259/bjr.20150981. |
| [2] | Rasmusson E, Gunnlaugsson A, Kjellén E, et al. Low-dose rate brachytherapy with I-125 seeds has an excellent 5-year outcome with few side effects in patients with low-risk prostate cancer[J]. Acta Oncol, 2016, 55 (8): 1016-1021. DOI:10.1080/0284186X.2016.1175659. |
| [3] | Ohashi T, Yorozu A, Saito S, et al. Urinary and rectal toxicity profiles after permanent iodine-125 implant brachytherapy in Japanese men: nationwide J-POPS multi-institutional prospective cohort study[J]. Int J Radiat Oncol Biol Phys, 2015, 93 (1): 141-149. DOI:10.1016/j.ijrobp.2015.05.014. |
| [4] | Nag S, Beyer D, Friedland J, et al. American Brachytherapy Society (ABS) recommendations for transperineal permanent brachytherapy of prostate cancer[J]. Int J Radiat Oncol Biol Phys, 1999, 44 (4): 789-799. DOI:10.1016/S0360-3016(99)00069-3. |
| [5] |
王俊杰. 影像引导组织间介入近距离治疗肿瘤概念的提出与实践[J].
中华放射医学与防护杂志, 2014, 34 (11): 801-802. Wang JJ. Practice and principle of image-guided interstitial brachytherapy[J]. Chin J Radiol Med Prot, 2014, 34 (11): 801-802. DOI:10.3760/cma.j.issn.0254-5098.2014.11.001. |
| [6] | Lin L, Wang J, Jiang Y, et al. Interstitial 125I seed implantation for cervical lymph node recurrence after multimodal treatment of thoracic esophageal squamous cell carcinoma[J]. Technol Cancer Res Treat, 2015, 14 (2): 201-207. DOI:10.7785/tcrt.2012.500409. |
| [7] | Wang H, Wang J, Jiang Y, et al. The investigation of 125I seed implantation as a salvage modality for unresectable pancreatic carcinoma[J]. J Exp Clin Cancer Res, 2013, 32 : 106 DOI:10.1186/1756-9966-32-106. |
| [8] |
王俊杰, 修典荣, 冉维强, 等. 术中超声引导放射性125I粒子植入治疗胰腺癌[J].
中华放射医学与防护杂志, 2005, 25 (5): 441-443. Wang JJ, Xiu DR, Ran WQ, et al. Iodine-125 seed implantation for unresectable pancreatic carcinoma guided by intraoperative ultrasound[J]. Chin J Radiol Med Prot, 2005, 25 (5): 441-443. DOI:10.3760/cma.j.issn.0254-5098.2005.05.011. |
| [9] |
张福君, 吴沛宏, 顾仰葵, 等. CT导向下125I粒子植入治疗肺转移瘤[J].
中华放射学杂志, 2004, 38 (9): 906-909. Zhang FJ, Wu PH, Gu YK, et al. CT guided radioactive seed 125I implantation in treating lung metastasis[J]. Chin J Radiol, 2004, 38 (9): 906-909. DOI:10.3760/j.issn:1005-1201.2004.09.003. |
| [10] |
郑广钧, 柴树德, 毛玉权, 等. 放射性125I粒子植入近距离放疗联合化疗治疗晚期肺癌的近期疗效[J].
中国微创外科杂志, 2008, 8 (2): 122-124-136. Zheng GJ, Chai SD, Mao YQ, et al. Short-term efficacy of interstitial implantation of 125I seeds combined with chemotherapy for advanced lung cancer[J]. Chin J Minim Inva Surg, 2008, 8 (2): 122-124-136. DOI:10.3969/j.issn.1009-6604.2008.02.010. |
| [11] |
吉喆, 姜玉良, 郭福新, 等. 3D打印个体化非共面模板辅助放射性粒子植入治疗恶性肿瘤的剂量学验证[J].
中华放射医学与防护杂志, 2016, 36 (9): 662-666. Ji Z, Jiang YL, Guo FX, et al. Dosimetry verification of radioactive seed implantation for malignant tumor assisted by 3D printing individual guide template[J]. Chin J Radiol Med Prot, 2016, 36 (9): 662-666. DOI:10.3760/cma.j.issn.0254-5098.2016.09.005. |
| [12] |
姜玉良, 王皓, 吉喆, 等. CT引导辅助3D打印个体化非共面模板指导125I粒子治疗盆腔复发肿瘤剂量学研究[J].
中华放射肿瘤学杂志, 2016, 25 (9): 959-964. Jiang YL, Wang H, Ji Z, et al. Computed tomographyimage-guided and personalized 3D printed template-assisted 125-iodine seed implantation for recurrent pelvic tumor:adosimetric study[J]. Chin J Radiat Oncol, 2016, 25 (9): 959-964. DOI:10.3760/cma.j.issn.1004-4221.2016.09.012. |
| [13] | Fowler JF. The linear-quadratic formula and progress in fractionated radiotherapy[J]. Br J Radiol, 1989, 62 (740): 679-694. DOI:10.1259/0007-1285-62-740-679. |
| [14] | Dale RG, Jones B. The clinical radiobiology of brachytherapy[J]. Br J Radiol, 1998, 71 (845): 465-483. DOI:10.1259/bjr.71.845.9691890. |
| [15] | Joiner M, Van der Kogel A. Basic clinical radiobiology[M]. The Great Britain: Hodder Arnold London, 2009: 122. |
| [16] | Joiner M, Van der Kogel A. Basic clinical radiobiology[M]. The Great Britain: Hodder Arnold London, 2009: 124. |
| [17] | Chang JY, Roth JA. Stereotactic body radiation therapy for stage I non-small cell lung cancer[J]. Thorac Surg Clin, 2007, 17 (2): 251-259. DOI:10.1016/j.thorsurg.2007.03.011. |
| [18] | Stock RG, Stone NN, Cesaretti JA, et al. Biologically effective dose values for prostate brachytherapy: effects on PSA failure and posttreatment biopsy results[J]. Int J Radiat Oncol Biol Phys, 2006, 64 (2): 527-533. DOI:10.1016/j.ijrobp.2005.07.981. |
| [19] | Miles EF, Nelson JW, Alkaissi AK, et al. Biologically effective dose (BED) correlation with biochemical control after low-dose rate prostate brachytherapy for clinically low-risk prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77 (1): 139-146. DOI:10.1016/j.ijrobp.2009.04.052. |
| [20] |
王皓, 王俊杰, 袁慧书, 等. CT引导125I粒子植入治疗局部复发直肠癌疗效和剂量学分析[J].
中华放射肿瘤学杂志, 2016, 25 (10): 1096-1099. Wang H, Wang JJ, Yuan HS, et al. Efficacy and dosimetry of computed tomographyimage-guided 125I radioactive seed implantation for locally recurrent rectal cancer[J]. Chin J Radiat Oncol, 2016, 25 (10): 1096-1099. DOI:10.3760/cma.j.issn.1004-4221.2016.10.016. |
 2017, Vol. 37
2017, Vol. 37