唾液腺肿瘤中约8%~15%位于下颌下腺,其中约37%~43%为恶性。不同部位的唾液腺恶性肿瘤治疗效果不一,位于下颌下腺的恶性肿瘤较腮腺区效果差,其治疗为原发灶行手术扩大切除,对切缘阳性、侵犯神经、局部晚期、病理类型高度恶性等高危因素术后辅助外放射治疗能够显著提高局部控制率和生存率[1-3]。125I放射性粒子组织间植入近距离放疗因其肿瘤局部组织接受的剂量高、周围组织剂量低的特点,在头颈部肿瘤,特别是在唾液腺恶性肿瘤的治疗取得了良好的疗效,在腮腺癌的综合治疗中具有显著的优势[4-5]。本研究对发生于下颌下腺的腺源性恶性肿瘤行手术联合125I放射性粒子组织间植入治疗,评估其治疗疗效。
资料与方法1.研究对象:选取2005年12月至2012年12月就诊于北京大学口腔医学院口腔颌面外科、发生于下颌下腺的腺源性恶性肿瘤患者32例。其中,男15例,女17例,年龄18~84岁,中位年龄54岁。病理类型:腺样囊性癌(ACC)18例,涎腺导管癌4例,中低分化黏液表皮样癌4例,嗜酸细胞腺癌1例,其他腺源性癌5例。TNM分期:Ⅰ期5例,Ⅱ期21例,Ⅲ期3例,Ⅳ期3例。所有患者均行下颌下腺肿物及下颌下腺切除术,术后联合125I放射性粒子组织间植入近距离放射治疗。
2.放射性粒子及相关植入用设备:125I放射性粒子(宁波君安药业科技有限公司及原子高科股份有限公司生产),半衰期59.4 d,放射性活度为18.5~25.9 MBq; 放射性粒子植入枪(宁波君安药业科技有限公司提供); 放射性粒子源植入治疗计划系统(北京天航科霖科技发展有限公司)。
3.手术治疗:32例患者均行肿物及下颌下腺切除术,术后病理证实为腺源性恶性肿瘤,临床及影像学检查未见淋巴结转移,未行扩大切除术或颈部淋巴结清除术。
4.125I放射性粒子组织间植入近距离放射治疗:手术后2~6周内行125I放射性粒子组织间植入。粒子植入前常规行CT检查,结合手术前CT检查所见、肿瘤位置、大小、术中所见及手术后病理学分型确定靶区。靶区范围需涵盖原肿物外1.0~1.5 cm,并包括颏下、颌下区,如病理学类型为腺样囊腺癌,其靶区范围需包括颌下区、口底区、翼颌间隙区及舌神经走行区域。参考点选择在靶区周界外0.5 cm处,定义90%等剂量线为参考点剂量,种植间距为1.0~1.5 cm,处方剂量为90~110 Gy。全麻下在3D个体化模板引导下按放射性粒子植入治疗计划将125I粒子植入靶区,植入后1周内行CT检查,验证D90、V100以及危及器官剂量。
5.随访及疗效评估:术后2、6个月常规行CT检查,之后按腺源性恶性肿瘤随诊要求常规复查。记录肿瘤复发、远处转移、皮肤放射性损伤、舌体感觉及舌运动情况,有无口干、张口受限、放射性颌骨骨髓炎等并发症表现。
6.统计学处理:采用SPSS 13.0软件进行数据分析,应用Kaplan-Meier法进行生存分析,计算局部-颈部控制率、生存率。P<0.05为差异有统计学意义。
结果1.粒子分布:32例患者植入125I放射性粒子1 394颗,人均43颗,术后验证D90和V100满足治疗需要,D90为90~110 Gy,周围重要器官如颌骨、脊髓均在耐受剂量以内(图 1)。
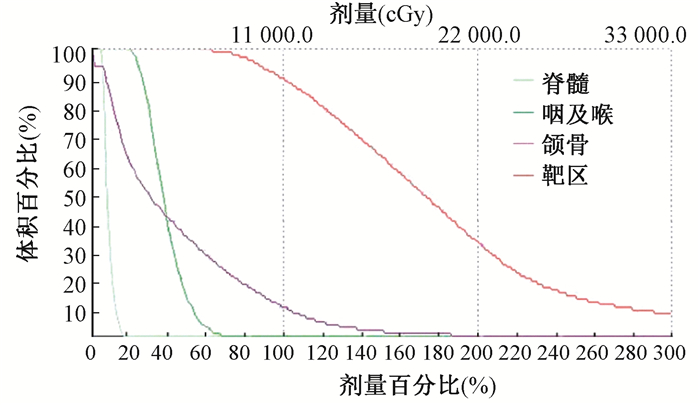
|
图 1 粒子植入后靶区、危及器官的剂量-体积直方图 Figure 1 Dose-volume histogram of target and organs at risk after implantation |
2.疗效:32例患者随访15~126个月,中位随访时间61个月,在随访时间内5例(4例腺样囊性癌,1例涎腺导管癌)出现局部复发,5例(2例腺样囊性癌,2例涎腺导管癌,1例低分化黏液表皮样癌)出现远处转移,其中3例(2例腺样囊性癌,1例涎腺导管癌)局部复发伴有远处转移。4例(3例腺样囊性癌,1例低分化黏液表皮样癌)死亡,1例腺样囊性癌为局部复发,其余3例均为远处多发转移。3年、5年的局部-颈部控制率93.1%、87.9%,3年、5年的总生存率93.3%、84.5%(图 2)。
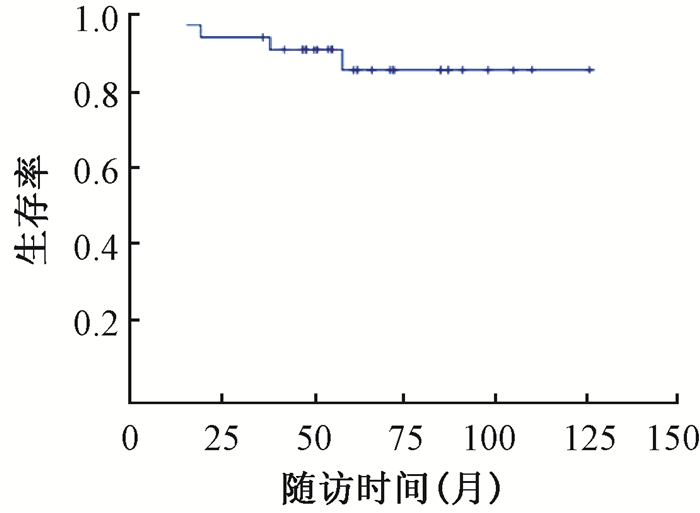
|
图 2 下颌下腺腺源性恶性肿瘤患者生存率曲线 Figure 2 Survival rate curve for treatment of malignant submandibular gland tumors |
3.不良反应:32例患者4例在125I放射性粒子植入后出现局部皮肤色素沉着,4例出现患侧舌麻木、舌肌萎缩和舌运动障碍,均未发现放射性龋齿、放射性颌骨骨髓炎、张口受限,未发现外耳道听力下降。
讨论唾液腺肿瘤较为少见,可发生于头颈部大、小唾液腺,其病理类型具有多样特点,恶性肿瘤可分为24类。下颌下腺为唾液腺第2大腺体,对于下颌下腺腺源性恶性肿瘤的治疗,因其发病率低、病理类型多样性以及随访时间长等原因,目前缺少较大数据支持的治疗指南。有关下颌下腺腺源性恶性肿瘤的治疗报道,多提倡用原发灶行手术扩大切除,术后辅助放射治疗能够提高局部-颈部控制率和长期生存率,特别是对切缘阳性、侵犯神经、T3~T4、淋巴结阳性等高危因素,术后放射治疗的优势更为明显。Bissett和Fitzpatrick[6]回顾分析91例下颌下腺癌患者的治疗,5年生存率单纯手术组为30%,手术联合术后辅助放射治疗组为69%。Storey等[3]报道对具有高危因素的下颌下腺癌,手术辅助术后放射治疗将10年局部控制率由单纯手术的50%提升到88%。虽然下颌下腺癌的病例数、病理类型的构成和临床分期报道不一,局部控制率和长期生存率亦有较大的差异,但趋向基本一致,他们均强调了放射治疗在提高局部控制率和长期生存率的贡献。本研究32例患者行手术切除肿瘤和下颌下腺后,术后行125I放射性粒子组织间植入近距离放射治疗,3年、5年局部-颈部控制率和生存率,基本持平或高于文献报道中手术联合放射治疗结果,而高于单纯手术治疗。本研究病例的随访结果也提示了125I放射性粒子组织间近距离放射治疗作为放射治疗的一种模式,在提高下颌下腺腺源性恶性肿瘤局部控制率和长期生存率的贡献。
下颌下腺腺源性恶性肿瘤手术后行放射治疗,照射野包括原发灶和淋巴引流区,同时依据病理学特点,如腺样囊性癌照射野需包括颅底区。照射剂量视肿瘤范围、切缘情况、淋巴结是否转移而定,原发灶靶区照射剂量在50~69 Gy,颈部40~50 Gy[3]。因外耳道、腮腺、下颌骨处于照射野内,放射治疗常伴有口腔黏膜溃疡、口干,严重可出现鼓膜穿孔、中耳炎、放射性颌骨骨坏死等并发症。125I放射性粒子应用于唾液腺癌的治疗,肿瘤局部高剂量、周围组织低剂量,具有局部控制率高、不良反应小的特点[4]。本研究病例行术后放射性粒子植入,粒子植入靶区主要为下颌下区,同时结合肿瘤侵及范围及病理学特点适当调整靶区。外耳道、腮腺及下颌骨所受照剂量较小,在随访期间未发现鼓膜穿孔、颌骨骨髓炎等并发症。
唾液腺腺源性恶性肿瘤的颈部淋巴结转移率较低,而发生于下颌下腺的腺源性恶性肿瘤具有较高的颈部淋巴结转移。对于临床证实有颈部淋巴结转移需行颈部淋巴结清除术,而对于临床无淋巴结转移(cN0) 下颌下腺癌的颈部淋巴结处理目前存有争议,治疗方案包括有观察、选择性颈部淋巴结清除术和放射治疗[7-10]。关于下颌下腺癌的颈部cN0处理,Sood等[8]建议行Ⅰ区和ⅡA区选择性颈淋巴结清除术,而对高度恶性或影像学上考虑颈部有淋巴结转移则需行选择性颈淋巴结清除术。Kaszuba等[9]随访28例下颌腺癌cN0病例,原发灶行下颌下腺腺体和肿物切除术,未行颈部淋巴结清除术,辅助放射治疗,平均随访85个月,未发现局部复发或颈部淋巴结转移。本研究32例患者,临床检查未发现有明显淋巴结转移,对于Ⅰ区和ⅡA区的颈部淋巴结,因其位于放射性粒子近距离治疗的靶区内,均未再次行淋巴结清除术,选择密切观察。在随访期内发生了3例出现颈部淋巴结转移,其中2例为腺样囊腺癌,1例为涎腺导管癌。腺样囊性癌的颈部淋巴结转移率低,出现淋巴结的转移一般考虑为肿瘤直接侵犯,2例转移淋巴结均在125I放射性粒子治疗的靶区外,可能和腺样囊腺癌跳跃性生长的特性有关。而其余29例随访期内均未发现颈部淋巴结转移,但仍需密切观察。
在本研究中,下颌下腺癌行肿物和下颌下腺切除后植入125I放射性粒子放射治疗,取得了良好的局部-颈部控制率和生存率。手术联合粒子治疗原发下颌下腺癌具有局部控制率高、生存率高、并发症小的特点,临床疗效良好,为原发下颌下腺癌的综合治疗提供新的手段,但需要更大样本量和长期观察。
利益冲突 无作者贡献声明 吕晓鸣负责论文设计、资料收集和撰写;石妍、刘树铭、黄明伟、郑磊、张杰负责病例资料收集和患者随访;张建国指导论文撰写和修改
| [1] | Rapidis AD, Stavrianos S, Lagogiannis G, et al. Tumors of the submandibular gland: Clinicopathologic analysis of 23 patients[J]. J Oral Maxillofac Surg, 2004, 62 (10): 1203-1208. DOI:10.1016/j.joms.2003.12.033. |
| [2] | Ziglinas P, Arnold A, Arnold M, et al. Primary tumors of the submandibular glands: a retrospective study based on 41 cases[J]. Oral Oncol, 2010, 46 (4): 287-291. DOI:10.1016/j.oraloncology.2010.01.011. |
| [3] | Storey MR, Garden AS, Morrison WH, et al. Postoperative radiotherapy for malignant tumors of the submandibular gland[J]. Int J Radiat Oncol Biol Phys, 2001, 51 (4): 952-958. DOI:10.1016/S0360-3016(01)01724-2. |
| [4] |
张建国, 张杰, 宋铁砾, 等. 125I放射性粒子组织间植入治疗面神经受侵的腮腺恶性肿瘤初步临床观察[J].
中华口腔医学杂志, 2008, 43 (3): 132-135. Zhang JG, Zhang J, Song TL, et al. Preliminary study of treating parotid gland malignant tumor with saving facial nerve (surgery associated 125I seed implant brachytherapy)[J]. Chin J Stomatol, 2008, 43 (3): 132-135. |
| [5] | Zhang J, Zhang JG, Song TL, et al. 125I seed implant brachytherapy-assisted surgery with preservation of the facial nerve for treatment of malignant parotid gland tumors[J]. Int J Oral Maxillofac Surg, 2008, 37 (6): 515-520. DOI:10.1016/j.ijom.2008.04.013. |
| [6] | Bissett RJ, Fitzpatrick PJ. Malignant submandibular gland tumors[J]. Malignant submandibular gland tumors. A review of 91 patients, 1988, 11 (1): 46-51. |
| [7] | Silver NL, Chinn SB, Bradley PJ, et al. Surgery for malignant submandibular gland neoplasms[J]. Adv Otorhinolaryngol, 2016, 78 : 104-112. DOI:10.1159/000442130. |
| [8] | Sood S, McGurk M, Vaz F. Management of salivary gland tumours: United Kingdom national multidisciplinary guidelines[J]. J Laryngol Otol, 2016, 130 (S2): S142-S149. DOI:10.1017/S0022215116000566. |
| [9] | Kaszuba SM, Zafereo ME, Rosenthal DI, et al. Effect of initial treatment on disease outcome for patients with submandibular gland carcinoma[J]. Arch Otolaryngol Head Neck Surg, 2007, 133 (6): 546-550. DOI:10.1001/archotol.133.6.546. |
| [10] | Feinstein AJ, Alonso J, Yang SE, et al. Diagnostic accuracy of fine-needle aspiration for parotid and submandibular gland lesions[J]. Otolaryngol Head Neck Surg, 2016, 155 (3): 431-436. DOI:10.1177/0194599816643041. |
 2017, Vol. 37
2017, Vol. 37


