2. 300211 天津医科大学第二医院胸外科;
3. 100191 北京大学第三医院肿瘤放疗科
2. Department of Thoracic Surgery, Second Hospital of Tianjin Medical University, Tianjin 300211, China;
3. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China
肺癌是发生率及死亡率最高的恶性肿瘤之一[1]。早期非小细胞肺癌(NSCLC)约占所有肺癌患者的25%,肺叶切除是早期NSCLC的标准治疗[2]。然而,有将近25%的早期NSCLC患者由于其他合并症被视为医学原因不可手术,有2%~3.5%的患者拒绝手术。这部分患者采用常规分割放疗,3年总生存率仅为19%~30%[3]。立体定向放疗(SBRT)已成为当前不可手术的早期NSCLC的推荐选择[4]。然而,随着放射性粒子近距离治疗(RSBT)自2001年引入我国实现自主研发,并在北京大学第三医院完成全国首例模板引导RSBT,开启了我国放射性粒子治疗肿瘤的全新里程[5]。由于125I粒子随距离平方反比梯度衰减的放射物理学特性,可使肿瘤靶区达到超高照射剂量,而靶区周围剂量迅速跌落,使正常组织和危及器官受量极低。且对于早期非小细胞肺癌,由于靶区体积相对较小,治疗费用与病灶大小呈正相关,总体治疗费用明显低于SBRT。众多的单一机构回顾性研究表明,RSBT在NSCLC治疗中的有效性和良好的耐受性[6-8]。本研究回顾性分析行CT联合模板引导下RSBT治疗不可手术或拒绝手术的21例早期NSCLC患者,旨在探讨其疗效与安全性。
资料与方法1.入组标准:① 通过组织病理检查证实为NSCLC。② 美国东部肿瘤协作组(ECOG)体力状态评分0~2,预测生存时间>6个月。③ 因医学原因不能手术或患者本身拒绝手术、常规放疗及SBRT。入组前,患者需要进行评估,即由经验丰富的胸外科医生或呼吸专家确定是否可手术。低氧血症或高碳酸血症,严重的肺动脉高压,糖尿病末稍器官损伤,严重的脑、心血管疾病或严重的慢性心脏病。④ 入组患者未接受针对该癌症的其他治疗(常规放疗、化疗、手术、靶向及免疫治疗等)。⑤ 所有患者通过强化CT、PET-CT、头颅MRI及腹部影像学检查,临床排除肺门、纵隔淋巴结及远处转移。
2.排除标准:① 未取得组织学病理。② 预计生存期<6个月。③ 合并其他严重疾病,如6个月内发生过心衰、呼吸衰竭、精神病等。④ 有严重出血倾向和凝血功能严重紊乱者(凝血酶原时间>18 s,凝血酶原活动度<40%)。3.一般临床资料:收集2010年12月到2016年11月于天津医科大学第二医院行放射性粒子植入的肺癌患者21例,年龄58~80岁(中位69岁)。T1为14例,T2为7例。所有患者治疗前签署知情同意书。一般临床资料见表 1。
|
|
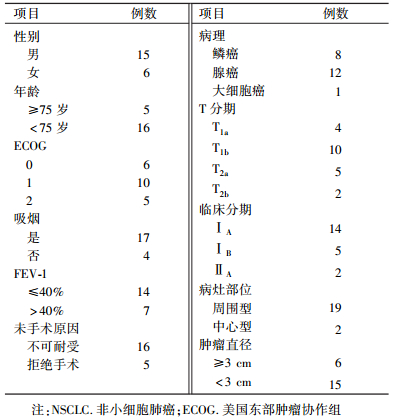
表 1 21例不可手术早期NSCLC患者的临床资料 Table 1 Clinical data of 21 patients with inoperable early NSCLC |
4.粒子植入技术流程:患者术前按照手术体位行CT扫描,数据以DICOM格式导入近距离治疗计划系统(TPS),设定处方剂量、粒子活度,进行术前计划。靶区勾画,进针方向生成虚拟模板模拟进针路径,除常规针道设计外,对于因肋骨遮挡产生剂量冷区的靶区层面模拟经肋骨预置针道,以达到剂量要求。粒子植入手术时,采用负压真空垫固定患者体位,安放定位导航仪,夹持模板,控制进针位置及角度,术中依据术前预计划,对于部分靶区层面采用肋骨打孔技术建立真实进针通道,CT扫描验证插植针位置满意后植入粒子。术后即刻行TPS剂量验证。观察并记录术中及术后并发症。
5.靶区勾画及计划设计:由临床医师、物理师共同完成。参考国际辐射单位与测量委员会(ICRU)58号报告,靶区要求勾画大体肿瘤靶区(GTV),GTV向各个方向外扩2~3 mm得到临床靶区(CTV),CTV=计划靶区(PTV)。本组患者靶区勾画肿瘤GTV需在肺窗勾画(窗宽/窗位:1 600/-600);密集而短的毛刺勾画在GTV内,稀疏而长的毛刺则不必全部包括。除非确有外侵存在,CTV不应超出解剖学边界。
6.评价指标:主要研究终点为肿瘤局部控制率(LC)。次要研究终点为剂量验证满意率、总生存时间(OS)、无进展生存期(PFS)、术中及术后不良事件。患者治疗后第1年内第1、3、6个月各随访1次,以后2年内每3个月随访1次,然后每半年随访1次。每次均需CT扫描图像进行疗效和不良事件评估。肿瘤测量应用实体瘤疗效评价标准(RECIST 1.1) 进行[9]。不良反应评价参照美国国立卫生研究院(NIH)的常见不良反应事件评价标准(CTCAE 4.03)。粒子植入质量评价标准采用英国哥伦比亚癌症研究中心粒子植入质量评价标准[10],根据术后即刻验证靶区D90、V100评价为优、良、中、差4组。优:V100≥90%,125%≥D90≥100%;良:90%>V100>85%,100%>D90>90%;中:85%≥V100≥75%;90%≥D90≥80%,或D90>125%;差:V100<75%,D90<80%。
7.统计学处理:计量资料采用x±s表示,计数资料以百分比或率表示。采用SPSS 19.0软件进行分析。采用Kaplan-Meier法计算对生存率、局部控制率,并行Log-rank检验。P<0.05为差异有统计学意义。
结果1.剂量学指标:术后即刻剂量验证靶区D90、V100评价均为优。植入放射性粒子数为31±13,植入针数为10±3,粒子活度(25.6±4.9) MBq,D90为(168.6±42.3) Gy,V90为(97.6±6.2)%,V100为(96.2±7.6)%,V150为(85.4±12.4)%,适形指数(CI)为0.98±0.12,靶区外体积指数(EI)为(39.6±7.9)%,均匀性指数(HI)为(23.1±6.6)%。
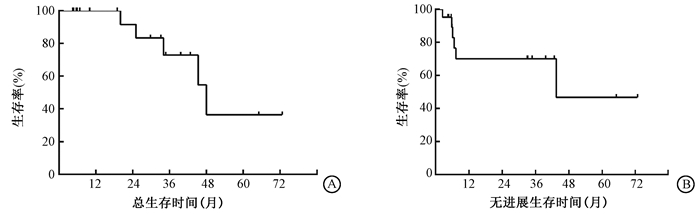
2.疗效:对21例患者的中位随访时间为25.1个月(范围4.4~72.7个月)。患者仍生存16例,中位随访时间为14个月(4.4~72.7个月)。18例患者(85.7%)治疗后在中位数为3个月(范围1~6个月)的时候达到CR。3例患者达到PR,治疗后的完全加部分缓解率为100%。只有1例(T2bN0M0)患者在13.8个月时发生原位复发。1、2、3年的原发肿瘤局部控制率为100%、95.2%、95.2%。所有患者的中位总生存期为48个月,中位无进展生存期为43.4个月。1年生存率为100%,2年生存率为91.7%,3年生存率为72.9%。3年无进展生存为70.2%。生存曲线见图 1。
|
图 1 21例不可手术早期非小细胞肺癌患者总生存(A)及无进展生存(B)情况 Figure 1 Total survival (A) and progression-free survival (B) in 21 patients with inoperable early NSCLC |
6例患者出现肿瘤进展,其失败模式包括:1例原位复发伴肺门复发,1例为同侧非累及叶转移,1例为纵隔转移,1例为胸壁及对侧肺转移,1例多发椎体骨转移,以及1例颈3、腰4、左侧第5前肋、左侧肾上腺多发转移。3年的播散性转移率为28.5%,其中有5例发生在12个月内。鳞癌患者3年播散性转移率为9.5%,然而这个比率在非鳞癌患者为19.1%。
3.不良反应:本组21例患者中,7例患者(33.3%)发生了治疗相关的1级不良事件,4例患者(19%)发生了2级不良事件。其中,气胸1级7例,2级3例;支气管出血1级5例,2级1例;胸膜出血1级2例;咳嗽1级3例,肺部纤维化1级2例;均未发生3级及以上的治疗相关不良事件。
讨论本回顾性研究的主要发现是RSBT对于原发肿瘤具有很高的局部控制率(3年为95.2%)。与本组患者类似的常规放疗系列报告的结果显示,其2~3年OS在20%~35%[11-13],显著低于此报告中3年72.9%的比率。与近年来国内外报道的SBRT治疗早期不可手术NSCLC疗效相当(局部控制率80%~97%)[14-18],但不良反应事件显著降低,且未见3级以上治疗相关不良反应和死亡。
此项研究中,3年的播散性复发率为28.5%,也与SBRT报道的相当(3年22.1%)[19]。因为原发肿瘤,累及叶及区域失败率均较低且治疗后转移出现的相当快,可能是因为这些患者的某些隐匿性肿瘤诊断,在初始分期时未被诊断。鉴于在肺门及纵隔区域的失败率较低,即使增加治疗之前的肺门或纵隔病理分期,像可手术的患者通常做的一样,也不太可能改变播散性复发率。反而这些结果意味着,为了改善结果,一方面是更好的全身分期确定隐匿性转移性疾病;一方面是针对低分化的病理分型辅助以有效的全身疗法,如化疗、靶向治疗等,以根除这种疾病是必要的。
放射性肺炎(radiation pneumonitis, RP)是放射治疗早期NSCLC后最常见的并发症之一。本组研究中,有2例患者分别在24和26个月出现照射野内的小范围肺纤维化,均未发生过RP,且对肺功能影响较小。
尽管SBRT已成为因医学原因不能手术的周围型早期NSCLC的标准治疗方式,然而,SBRT在治疗靠近大气管、食管和脊髓的中心型肺癌、靠近胸壁及肺尖部臂丛神经的周围型肺癌时,由于有潜在发生危及器官的损伤、肋骨骨折、胸壁疼痛等严重不良反应的可能,其应用剂量、范围等仍存在争议[20-22]。本组有2例靠近肺门的中心型肺癌,2例肺尖部病灶及4例靠近胸壁病灶,均未出现治疗相关放射性损伤。本研究中的不良事件为气胸、支气管出血、胸膜出血、咳嗽、肺部纤维化及粒子移位。气胸发生率为47.6%,其中7例为1级,自行吸收缓解或术中预留一根植入针于胸膜腔内,外接负压吸引球,连续抽气后缓解。3例为2级,行胸腔闭式引流后缓解。其中7例为穿刺过程中出现,2例为拔针后即刻出现,1例为12 h后出现1级迟发性气胸,自行吸收缓解。本组共6例支气管出血有5例为腺癌,胸膜出血2例,无大咯血。2例患者出现粒子移位,共3颗粒子脱落至胸膜腔肋膈角处,均未观察到相应部位的放射性损伤。
基于此研究是在本中心开展的第一个RSBT治疗不可手术的早期NSCLC的临床研究,为确保每次手术操作流程的一致性和高质量,本中心致力于开发基础设施以及建立标准流程[23-25],包括术中固定患者体位用负压真空垫、CT联合模板引导技术、骨钻经肋骨钻孔技术、DICOM数据术中实时传输TPS剂量优化技术等。通过本研究可观察到,这种基础设施大大促进了高遵守性,并最终将允许从后续随访的更多的事件中评估剂量、顺应性和不良事件之间的关系。本组术后剂量学验证显示出了良好的剂量满意度,可见CT联合模板引导在保证粒子植入的空间分布及剂量学要求方面具有优势,操作具备可重复性,也易于临床推广。当前,中国北方放射性粒子多中心协作组正在多个医疗中心开展RSBT治疗不可手术早期NSCLC的前瞻性研究,进一步的多中心数据值得期待。
利益冲突 本研究所有作者均来自于中国北方放射性粒子多中心协作组(CNRBG)。全体作者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 霍彬负责整理临床资料、采集数据结果并起草论文;霍小东、王磊负责手术及数据处理;曹强、王金焕负责粒子植入计划的制作;王丽丽、臧立负责审核数据及粒子植入计划;王海涛、王俊杰指导论文写作;柴树德负责共面模板和导航定位架的设计和制作
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65 (1): 5-29. DOI:10.3322/caac.21254. |
| [2] | Detterbeck FC, Lewis SZ, Diekemper R, et al. Executive summary: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143 (5 Suppl): 7S-37S. DOI:10.1378/chest.12-2377. |
| [3] | Kavanagh BD. Stereotactic body radiation therapy as a derivative of stereotactic radiosurgery: clinically independent but with enduring common themes[J]. J Clin Oncol, 2014, 32 (26): 2827-2831. DOI:10.1200/JCO.2014.56.7362. |
| [4] | Jones GC, Kehrer JD, Kahn J, et al. Primary treatment options for high-risk/medically inoperable early stage NSCLC patients[J]. Clin Lung Cancer, 2015, 16 (6): 413-430. DOI:10.1016/j.cllc.2015.04.001. |
| [5] |
王俊杰. 中国大陆地区影像引导介入近距离治疗学发展概述[J].
中华放射肿瘤学杂志, 2016, 25 (4): 301-303. Wang JJ. An overview of the development of image-guided interventional brachytherapy in Mainland China[J]. Chin J Radiat Oncol, 2016, 25 (4): 301-303. DOI:10.3760/cma.j.issn.1004-4221.2016.04.001. |
| [6] | Wang ZM, Lu J, Liu T, et al. CT-guided interstitial brachytherapy of inoperable non-small cell lung cancer[J]. Lung Cancer, 2011, 74 (2): 253-257. DOI:10.1016/j.lungcan.2011.03.006. |
| [7] | Huo X, Wang H, Yang J, et al. Effectiveness and safety of CT-guided 125I seed brachytherapy for postoperative locoregional recurrence in patients with non-small cell lung cancer[J]. Brachytherapy, 2016, 15 (3): 370-380. DOI:10.1016/j.brachy.2016.02.001. |
| [8] | Zhang T, Lu M, Peng S, et al. CT-guided implantation of radioactive 125I seed in advanced non-small-cell lung cancer after failure of first-line chemotherapy[J]. J Cancer Res Clin Oncol, 2014, 140 (8): 1383-1390. DOI:10.1007/s00432-014-1655-x. |
| [9] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45 (2): 228-247. DOI:10.1016/j.ejca.2008.10.026. |
| [10] | Keyes M, Morris WJ, Spadinger I, et al. Radiation oncology and medical physicists quality assurance in British Columbia Cancer Agency Provincial Prostate Brachytherapy Program[J]. Brachytherapy, 2013, 12 (4): 343-355. DOI:10.1016/j.brachy.2012.03.006. |
| [11] | Dosoretz DE, Katin MJ, Blitzer PH, et al. Medically inoperable lung carcinoma: the role of radiation therapy[J]. Semin Radiat Oncol, 1996, 6 (2): 98-104. DOI:10.1053/SRAO00600098. |
| [12] | Kaskowitz L, Graham MV, Emami B, et al. Radiation therapy alone for stage Ⅰ non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 1993, 27 (3): 517-523. DOI:10.1016/0360-3016(93)90374-5. |
| [13] | Haffty BG, Goldberg NB, Gerstley J, et al. Results of radical radiation therapy in clinical stage Ⅰ, technically operable non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 1988, 15 (1): 69-73. DOI:10.1016/0360-3016(88)90348-3. |
| [14] | Onishi H, Shirato H, Nagata Y, et al. Stereotactic body radiotherapy (SBRT) for operable stage Ⅰ non-small-cell lung cancer: can SBRT be comparable to surgery?[J]. Int J Radiat Oncol Biol Phys, 2011, 81 (5): 1352-1358. DOI:10.1016/j.ijrobp.2009.07.1751. |
| [15] | Timmerman RD, Paulus R, Pass HI, et al. RTOG 0618: stereotactic body radiation therapy (SBRT) to treat operable early-stage lung cancer patients[J]. Proc Am Soc Clin Oncol, 2013, 31 (15 suppl): S75232 |
| [16] | Palma D, Visser O, Lagerwaard FJ, et al. Impact of introducing stereotactic lung radiotherapy for elderly patients with stage Ⅰ non-small-cell lung cancer: a population-based time-trend analysis[J]. J Clin Oncol, 2010, 28 (35): 5153-5159. DOI:10.1200/JCO.2010.30.0731. |
| [17] | Palma D, Visser O, Lagerwaard FJ, et al. Treatment of stage Ⅰ NSCLC in elderly patients: a population-based matched-pair comparison of stereotactic radiotherapy versus surgery[J]. Radiother Oncol, 2011, 101 (2): 240-244. DOI:10.1016/j.radonc.2011.06.029. |
| [18] | Shirvani SM, Jiang J, Chang JY, et al. Lobectomy, sublobar resection, and stereotactic ablative radiotherapy for early-stage non-small cell lung cancers in the elderly[J]. JAMA Surg, 2014, 149 (12): 1244-1253. DOI:10.1001/jamasurg.2014.556. |
| [19] | Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303 (11): 1070-1076. DOI:10.1001/jama.2010.261. |
| [20] | Kang KH, Okoye CC, Patel RB, et al. Complications from stereotactic body radiotherapy for lung cancer[J]. Cancers (Basel), 2015, 7 (2): 981-1004. DOI:10.3390/cancers7020820. |
| [21] | Onishi H, Araki T. Stereotactic body radiation therapy for stage Ⅰ non-small-cell lung cancer: a historical overview of clinical studies[J]. Jpn J Clin Oncol, 2013, 43 (4): 345-350. DOI:10.1093/jjco/hyt014. |
| [22] | Welsh J, Amini A, Ciura K, et al. Evaluating proton stereotactic body radiotherapy to reduce chest wall dose in the treatment of lung cancer[J]. Med Dosim, 2013, 38 (4): 442-447. DOI:10.1016/j.meddos.2013.08.001. |
| [23] |
霍彬, 王磊, 王海涛, 等. 模板联合肋骨钻孔技术辅助放射性粒子植入治疗肺癌的可行性[J].
山东大学学报(医学版), 2017, 55 (2): 26-31. Huo B, Wang L, Wang HT, et al. Feasibility study of radioactive seed implantation in the treatment of lung cancer assisted by template combined with rib drilling technique[J]. J Shandong Univ(Health Sci), 2017, 55 (2): 26-31. DOI:10.6040/j.issn.1671-7554.0.2016.1451. |
| [24] |
霍彬, 侯朝华, 叶剑飞, 等. CT引导术中实时计划对胸部肿瘤125I粒子植入治疗的价值[J].
中华放射肿瘤学杂志, 2013, 22 (5): 400-403. Huo B, Hou ZH, Ye JF, et al. The study of intraoperative real-time planning by CT-guided in 125I seed implantation for thoracic malignancie[J]. Chin J Radiat Oncol, 2013, 22 (5): 400-403. DOI:10.3760/cma.j.issn.1004-4221.2013.05.019. |
| [25] |
韩明勇, 霍彬, 张颖, 等. CT联合模板引导放射性粒子植入治疗肺癌技术流程[J].
山东大学学报(医学版), 2017, 55 (2): 14-20. Han MY, Huo B, Zhang Y, et al. The techinique procedure of template combine with CT guided radioactive seeds implantation of lung cancer[J]. J Shandong Univ (Health Sci), 2017, 55 (2): 14-20. DOI:10.6040/j.issn.1671-7554.0.2016.1537. |
 2017, Vol. 37
2017, Vol. 37