2. 073000 定州, 河北省定州市人民医院肿瘤科;
3. 442000 十堰, 湖北省十堰市人民医院肿瘤科
2. Department of Oncology, Dingzhou City People's Hospital, Dingzhou 073000, China;
3. Department of Oncology, Shiyan City People's Hospital, Shiyan 442000, China
放射性粒子植入治疗恶性肿瘤是一种微创、安全和疗效肯定的治疗方法,对头颈部复发肿瘤具有较好的姑息治疗效果[1-4]。近年来有学者利用计算机辅助(computer aided design,CAD)与快速成形技术(rapid prototyping,RP)设计制作3D打印个体化非共面模板(简称3D打印非共面模板,3D-printing non-coplanar template, 3D-PNCT)辅助肿瘤粒子植入[5-10],提高了手术精确性。但目前对于放射性粒子植入应用3D-PNCT后不良反应的相关研究情况尚未见报道。本研究回顾性分析了头颈部恶性肿瘤应用3D-PNCT辅助联合CT引导粒子植入治疗患者不良反应情况,为标准化、规范化粒子植入流程的建立提供理论基础。
资料与方法1.临床一般资料:选择2016年1—12月于北京大学第三医院接受3D-PNCT辅助CT引导下放射性125I粒子植入治疗的头颈部复发/转移恶性肿瘤患者42例,其中男性28例,女性14例。年龄29~79岁,中位年龄61岁。原发头颈部肿瘤复发为26例,包括鼻咽癌4例,口腔癌4例,鼻腔副鼻窦癌4例,头颈部软组织肉瘤3例,下咽癌、口咽癌、喉癌、涎腺癌各2例,甲状腺癌、脊索瘤、原发不明颈部淋巴结转移癌各1例;颈部转移肿瘤16例,包括食管癌颈部淋巴结转移8例,宫颈癌、肺癌各3例,乳腺癌、结肠癌各1例。64.3%(27/42) 病例既往有头颈部手术史,85.7%(36/42) 病例有局部外放疗史,69.0%(29/42) 有化疗史。既往放疗累积剂量≤50 Gy为2例,51~70 Gy为25例,71~135 Gy为6例,剂量不详3例。患者KPS评分均>70分。患者均签署了知情同意书。根据文献报道和本中心临床经验[11-19],给予处方剂量为110~160 Gy。
2.术前计划设计:所有患者术前2 d内行CT扫描(荷兰Philips公司生产的Brilliance Bigbore CT机),按病灶部位选择俯卧位或仰卧位,真空垫固定,体表标记定位线。CT数据传输至近距离放疗计划系统(北京航空航天大学图像中心开发的放射性粒子植入计划系统,KL-SIRPS-3D),行术前预计划设计:勾画肿瘤靶区(gross tumor volume,GTV)及临近危及器官, 设定处方剂量和粒子活度, 确定插植针道(方向、分布、深度), 计算粒子数目和模拟粒子空间位置分布,以及GTV与危及器官(腮腺、脊髓、气管、黏膜、皮肤、重要的颈部血管等)剂量。通过优化,使GTV D90(90% GTV接受的剂量)尽量达到处方剂量,满足肿瘤处方剂量情况下,尽量降低危及器官剂量。
3.个体化模板设计和制作:将近距离放疗计划系统中的数据导入三维影像及逆向工程软件行个体化模板数字建模,并加入粒子空间点坐标和针道方向点坐标信息。利用三维光固化快速成型机和医用光固化树脂材料加工得到3D个体化模板。模板含有患者治疗区的体表解剖特征、定位标记和模拟针道等信息。
4.穿刺及植入粒子:全部患者采用局部麻醉。将3D-PNCT放置在患者治疗区的体表,借助患者外轮廓解剖特征、体表标记线及激光线准确对位。通过3D-PNCT导向孔将插植针(美国MickRadio Nuclear公司)经皮穿刺至预定深度,行CT扫描验证插植针位置,必要时进行微调。复扫CT,必要时行术中实时计划优化,最后参考术前计划和(或)术中计划,以Mick枪(美国MickRadio Nuclear公司)后退式植入粒子。植入完成后再次CT扫描,观察粒子实际分布情况(是否均匀和有无脱落移位等);若靶区内粒子分布不满意,补种粒子。
5.术后验证:根据术后CT图像,行肿瘤及周围危及器官的剂量学评估。肿瘤评价包括D90、D100,100%、150%和200%处方剂量所包含的体积百分比、V100、V150、V200等。危及器官评价包括D2 cm3(2 cm3的皮肤、黏膜等器官所受的剂量)、D0.1 cm3等。
6.随访:术后1、3、6、9和12个月(之后间隔3个月)进行随访,定期复诊及电话随访。
7.观察内容:与穿刺相关的不良反应有出血、疼痛、感染、穿刺点不愈合、种植转移;与放射相关的不良反应有皮肤损伤、黏膜反应、脊髓损伤、外周神经损伤、口干、血液毒性等。皮肤、黏膜根据所受剂量参数D2 cm3与D0.1 cm3的大小,D2 cm3<30 Gy、D2 cm3≥30 Gy、D0.1 cm3<60 Gy、D0.1 cm3≤ 60 Gy时观察其不良反应情况。放射性不良反应采用RTOG/EORTC标准[20],神经损伤采用CTCAE 4.0分级标准[21]。粒子植入特异性合并症,如粒子移位等。
8.统计学处理:采用SPSS16.0软件进行统计处理。对放射性粒子治疗后发生的皮肤与黏膜不良反应率,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结果1.治疗及随访情况:42例患者均顺利完成CT引导辅助3D-PNCT粒子植入治疗。单个粒子活度为0.34~0.7 mCi,中位活度为0.6 mCi(1 Ci=3.7×1010Bq)。粒子数目为10~126枚,中位为34枚。插入粒子植入针为4~31根,中位针数为11。
患者均接受随访,随访率100%。随访时间为4~14个月,中位随访8.5个月。
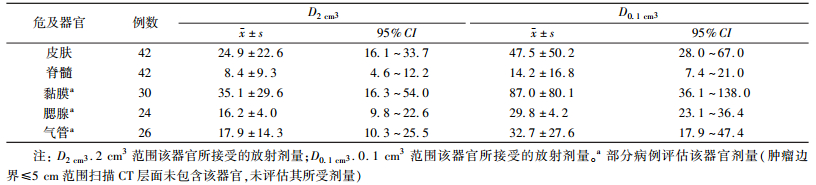
所有患者均有术前计划、术中优化及术后验证,由术后验证计划计算出危及器官所受放射剂量,具体见表 1。
|
|
表 1 3D打印非共面模板辅助放射性粒子植入挽救性治疗头颈部恶性肿瘤中危及器官所受剂量(Gy, x±s) Table 1 Dose of organ at risk for radioactive 125I seed implantation in recurrent malignant tumor of head and neck assisted by 3D-PNCT(Gy, x±s) |
2.穿刺相关并发症:术中疼痛均可耐受,术后疼痛皆消失。1例术中出现重度疼痛,勉强耐受;术后自然缓解;术中出血不明显。所有病例均未出现穿刺及粒子植入后感染,穿刺处皮肤愈合较好。2例术后因穿刺点有渗出,约1周后延迟愈合。随访期间,所有病例均未发现穿刺路径种植转移。
3.不良反应:所有患者均无3级以上急性反应。皮肤Ⅰ度反应3例(3/42),黏膜Ⅰ度反应1例、Ⅱ度反应2例(总3/42)。血液毒性反应均未出现。随访期间,所有病例均未出现放射性脊髓损伤。口干均未加重。出现1例Ⅲ度神经反应。该患者术前肿瘤侵犯臂丛神经,伴感觉异常,抬举力弱(肌力4级)。术后3个月肿瘤接近消失,但神经症状加重,感觉异常较前明显,力弱加重(肌力3级)。神经损伤从术前2级升为3级(CTC 4.0分级)。考虑放射性神经损伤可能性大。但尚无法完全排除因肿瘤侵犯,术前已经出现不可逆神经损伤且术后渐行加重的可能情况。所有病例均无咳嗽加重及气管瘘情况,未出现放射性粒子移位发生。
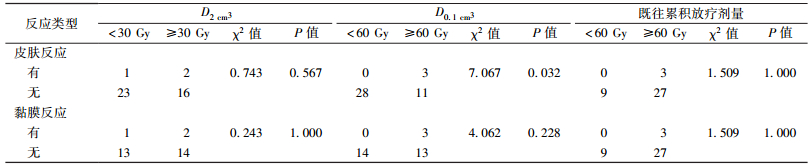
4.危及器官所受剂量:皮肤在D0.1 cm3≥60 Gy与D0.1 cm3<60 Gy两种剂量间,其不良反应差异有统计学意义(χ2=7.067,P=0.032),其他如D2 cm3、既往放疗剂量等情况未见相关(P>0.05)。黏膜反应与黏膜所受剂量(D2 cm3、D0.1 cm3)、既往放疗剂量等未见明显相关(P>0.05)。见表 2。
|
|
表 2 42例肿瘤患者粒子植入治疗中皮肤、黏膜所受不同剂量与其不良反应结果 Table 2 The statistical results of the difference between the radiation dose and the adverse reactions of the skin and mucous membranes |
讨论
头颈部复发恶性肿瘤治疗包括再手术、再放疗与全身化疗等。因既往多有手术和(或)放疗史,增加了再手术、放疗的难度。此外,头颈部重要解剖结构较多,其重要的生理功能及容貌,同样限制了再手术、放疗的实施。研究表明,放射性粒子植入治疗复发性头颈部癌,具有很好的姑息挽救治疗作用,局部控制较好,不良反应轻微。
近年随着3D打印技术的发展,3D-PNCT辅助粒子植入提高了治疗的准确性,术中能够准确实施术前计划,使该治疗的质量控制大大提高[5-10]。术后验证表明,无论是肿瘤处方剂量、CI、EI等计划参数与术前计划符合率皆较高。应用3D-PNCT辅助粒子植入技术,术前可以很好地预测肿瘤及正常组织所受的剂量。理论上,这有利于预测肿瘤控制情况、判断正常组织不良反应概率,有利于探索肿瘤控制及正常组织不良反应与所受剂量之间的关系。但仍需临床实践来证明。本研究采用回顾性分析,进行初步探讨应用3D-PNCT后不良反应发生情况。
粒子植入因为其物理特点,周围组织剂量跌落较快,发生的不良反应相应较低。本中心既往治疗中未采用模板引导粒子植入治疗头颈部复发转移肿瘤时,无Ⅲ度以上不良反应发生,Ⅰ、Ⅱ度不良反应发生率为21%[2-3]。头颈部淋巴结复发转移癌粒子植入,Ⅰ、Ⅱ度不良反应发生率为2.8%,Ⅲ度以上不良反应2.8%[4]。刘建国等[22]对70例头颈部复发肿瘤患者行放射性粒子植入治疗,发生Ⅰ、Ⅱ度不良反应主要为皮肤、黏膜反应,约占24%(17/70);无Ⅲ度以上不良反应。张建国等[23]对153例口腔颌面部肿瘤患者术后辅助放射性粒子植入治疗,处方剂量为60 Gy,Ⅲ度皮肤反应3例,Ⅰ、Ⅱ级皮肤反应为8例(5.2%,8/153)。以上研究表明,无论既往有无放疗史,处方剂量高低,放射性粒子植入治疗头颈部肿瘤的不良反应均不高。
本研究结果显示,1例患者随访过程中神经反应由术前的Ⅱ度发展为Ⅲ度,为可疑治疗相关不良反应,其余皮肤、黏膜均为Ⅱ度以下反应,且发生率较低,与既往不良反应相关文献报道[1-4, 22-23],大致相当。初步统计分析,3例Ⅰ度皮肤反应其发生与危及器官所受剂量(D0.1 cm3)相关,而与所受剂量D2 cm3及既往放疗累积剂量等无明显相关。本研究中,分析不同组别间的差异,而放射性粒子植入治疗本身不良反应发生率较低,导致理论频数小于4,故采用确切概率方法计算χ2及P值,本身存在一定的统计偏差。后续研究需要增加病例样本量。
综上,3D-PNCT辅助粒子植入头颈部复发转移肿瘤,操作精准,剂量可靠,为标准化、规范化粒子植入治疗提供了有效工具,有很好的应用前景。本研究拟继续扩大病例数,在临床层面进一步探讨其疗效及安全性。
利益冲突 全体作者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 姜玉良采集数据结果并起草论文;吉喆、郭福新、彭冉、范京红、李卫燕负责协助完善数据及粒子植入计划的实施;孙海涛负责粒子植入计划及3D打印模板的的设计和制作;刘锴、雷金华负责整理临床资料;王俊杰负责审核患者粒子植入计划并指导论文写作
| [1] | Meng N, Jiang YL, Wang JJ, et al. Permanent implantation of iodine-125 seeds as a salvage therapy for recurrent head and neck carcinoma after radiotherapy[J]. Cancer Invest, 2012, 30 (3): 236-242. DOI:10.1002/hed.23648. |
| [2] | Jiang YL, Meng N, Wang JJ, et al. Percutaneous computed tomography/ultrasonography-guided permanent iodine-125 implantation as salvage therapy for recurrent squamous cell cancers of head and neck[J]. Cancer Biol Ther, 2010, 9 (12): 959-966. DOI:10.4161/cbt.9.12.11700. |
| [3] | Jiang YL, Meng N, Wang JJ, et al. CT-guided iodine-125 seed permanent implantation for recurrent head and neck cancers[J]. Radiat Oncol, 2010, 5 : 68 DOI:10.1186/1748-717X-5-68. |
| [4] |
姜玉良, 马月, 王俊杰, 等. 125I粒子治疗头颈部肿瘤颈淋巴结放疗后复发的结果分析[J].
中华放射肿瘤学杂志, 2011, 20 (2): 91-94. Jiang YL, Ma Y, Wang JJ, et al. Implantation of 125I seeds for recurrence cervical node of head and neck tumor after external beam radiotherapy[J]. Chin J Radiat Oncol, 2011, 20 (2): 91-94. DOI:10.3760/cma.j.issn.1004-4221.2011.02.002. |
| [5] |
刘树铭, 张建国, 黄明伟, 等. 个体化模板辅助颅底区永久性组织间近距离治疗的可行性研究[J].
中华放射医学与防护杂志, 2013, 33 (1): 42-45. Liu SM, Zhang JG, Huang MW, et al. Feasibility of permanent interstitial brachytherapy for skull base region through individual template assistance[J]. Chin J Radiol Med Prot, 2013, 33 (1): 42-45. DOI:10.3760/cma.j.issn.0254-5098.2013.01.011. |
| [6] |
赵一姣, 王勇, 黄明伟, 等. 近距离放射治疗用个性化导板的数字化设计方法[J].
中华口腔医学杂志, 2014, 49 (2): 115-118. Zhao YJ, Wang Y, Huang MW, et al. Digital design method of individual guide plate for brachytherapy[J]. Chin J Stomatol, 2014, 49 (2): 115-118. DOI:10.3760/cma.j.issn.1002-0098.2014.02.011. |
| [7] | Huang MW, Liu SM, Zheng L, et al. A digital model individual template and CT-guided 125I seed implants for malignant tumors of the head and neck[J]. J Radiat Res, 2012, 53 (6): 973-977. DOI:10.1093/jrr/rrs046. |
| [8] |
姜玉良, 李宾, 吉喆, 等. 3D打印个体化非共面模板辅助粒子植入时定位与复位误差研究[J].
中华放射医学与防护杂志, 2016, 36 (12): 913-916. Jiang YL, Li B, Ji Z, et al. Analysis of position errors of 3D printing individualnon-coplanar template for radioactive seed implantation for malignant tumor[J]. Chin J Radiol Med Prot, 2016, 36 (12): 913-916. DOI:10.3760/cma.j.issn.0254-5098.2016.12.007. |
| [9] |
吉喆, 姜玉良, 郭福新, 等. 3D打印个体化非共面模板辅助放射性粒子植入治疗恶性肿瘤的剂量学验证[J].
中华放射医学与防护杂志, 2016, 36 (9): 662-666. Ji Z, Jiang YL, Guo FX, et al. Dosimetry verification of radioactive seed implantation for malignant tumor assisted by 3D printing individual guide template[J]. Chin J Radiol Med Prot, 2016, 36 (9): 662-666. DOI:10.3760/cma.j.issn.0254-5098.2016.09.005. |
| [10] |
姜玉良, 王皓, 吉喆, 等. CT引导辅助3D打印个体化非共面模板指导125I粒子治疗盆腔复发肿瘤剂量学研究[J].
中华放射肿瘤学杂志, 2016, 25 (9): 959-964. Jiang YL, Wang H, Ji Z, et al. Computed tomographyimage-guided and personalized 3D-printed template-assisted 125-iodine seed implantation for recurrent pelvic tumor:a dosimetric study[J]. Chin J Radiat Oncol, 2016, 25 (9): 959-964. DOI:10.3760/cma.j.issn.1004-4221.2016.09.012. |
| [11] |
王俊杰, 黄毅, 冉维强, 等. 放射性125I粒子植入联合内分泌治疗早期前列腺癌[J].
现代肿瘤医学, 2009, 17 (11): 2176-2178. Wang JJ, Huang Y, Ran WQ, et al. Transperineal ultrasound guided 125I seed implantation combined with endocrinotherapy for stage T1-T2 prostate cancer[J]. J Mod Oncol, 2009, 17 (11): 2176-2178. DOI:10.3969/j.issn.1672-4992.2009.11.055. |
| [12] | Wang ZM, Lu J, Liu T, et al. CT-guided interstitial brachytherapy of inoperable non-small cell lung cancer[J]. Lung Cancer, 2011, 74 (2): 253-257. DOI:10.1016/j.lungcan.2011.03.006. |
| [13] | Wang JJ, Yuan HS, Li JN, et al. Interstitial permanent implantation of 125I seeds as salvage therapy for re-recurrent rectal carcinoma[J]. Int J Colorectal Dis, 2009, 24 (4): 391-399. DOI:10.1007/s00384-008-0628-4. |
| [14] | Zhu L, Jiang Y, Wang J, et al. An investigation of 125I seed permanent implantation for recurrent carcinoma in the head and neck after surgery and external beam radiotherapy[J]. World J Surg Oncol, 2013, 11 : 60 DOI:10.1186/1477-7819-11-60. |
| [15] | Cao Q, Wang H, Meng N, et al. CT-guidance interstitial 125Iodine seed brachytherapy as a salvage therapy for recurrent spinal primary tumors[J]. Radiat Oncol, 2014, 9 (1): 301 DOI:10.1186/s13014-014-0301-8. |
| [16] | Meng N, Zhang X, Liao A, et al. Management of recurrent alveolar soft-part sarcoma of the tongue after external beam radiotherapy with iodine-125 seed brachytherapy[J]. Head Neck, 2014, 36 (12): E125-128. DOI:10.1002/hed.23648. |
| [17] | Qu A, Wang H, Li J, et al. Biological effects of 125I seeds radiation on A549 lung cancer cells: G2/M arrest and enhanced cell death[J]. Cancer Invest, 2014, 32 (6): 209-217. DOI:10.3109/07357907.2014.905585. |
| [18] | Jiang P, Liu C, Wang J, et al. Computed tomography (CT)-guided interstitial permanent implantation of 125I seeds for refractory chest wall metastasis or recurrence[J]. Technol Cancer Res Treat, 2015, 14 (1): 11-18. DOI:10.7785/tcrt.2012.500402. |
| [19] | Lin L, Wang J, Jiang Y, et al. Interstitial 125I seed implantation for cervical lymph node recurrence after multimodal treatment of thoracic esophageal squamous cell carcinoma[J]. Technol Cancer Res Treat, 2015, 14 (2): 201-207. DOI:10.7785/tcrt.2012.500409. |
| [20] | Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31 (5): 1341-1346. DOI:10.1016/0360-3016(95)00060-C. |
| [21] | National Institutes of Health, National Cancer Institute. Common terminology criteria for adverse events (CTCAE) version 4.0. 2010[S/OL]. [2015-12-14]. https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf. |
| [22] |
刘建国, 钟龙, 杨永杰, 等. CT引导下125I粒子治疗头颈部复发恶性肿瘤近期疗效观察[J].
医学临床研究, 2015 (10): 1977-1980. Liu JG, Zhong L, Yang YJ, et al. Observation on the efficacy of CT guided 125I seed implantation brachytherapy in recurring head and neck carcinoma[J]. J Clin Res, 2015 (10): 1977-1980. DOI:10.3969/j.issn.1671-7171.2015.10.035. |
| [23] |
张建国, 张杰, 宋铁砾, 等. 放射性粒子组织间植入治疗口腔颌面部恶性肿瘤初探[J].
中华口腔医学杂志, 2006, 41 (8): 464-466. Zhang JG, Zhang J, Song TL, et al. Radioactive seed implantation in treatment of oral and maxillofacial malignancy[J]. Chin J Stomatol, 2006, 41 (8): 464-466. DOI:10.3760/j.issn:1002-0098.2006.08.005. |
 2017, Vol. 37
2017, Vol. 37