腮腺癌约占腮腺肿瘤的20%,病理类型多样,治疗后仍有约为26%~60%的局部复发率[1-4]。放射性125I粒子组织间植入治疗属近距离放疗,应用于原发唾液腺癌术后辅助治疗已取得良好疗效[5],而对于放射性125I粒子植入治疗应用于唾液腺癌复发患者,包括手术治疗后和放疗后的复发患者,相关研究报道较少。本研究对24例应用放射性125I粒子组织间植入治疗腮腺复发腺源性恶性肿瘤患者进行临床分析,初步总结评价该治疗在腮腺复发恶性肿瘤治疗中的价值。
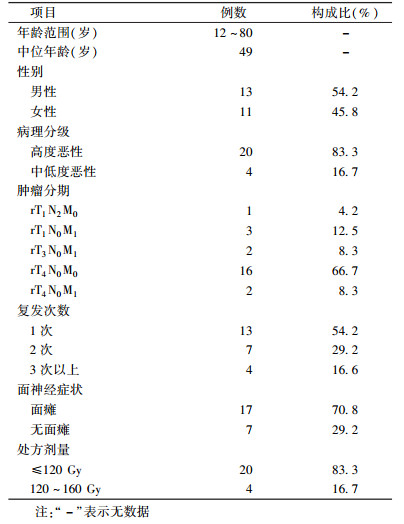
资料与方法1.临床资料:收集2006年至2013年间,在北京大学口腔医院颌面外科接受125I粒子组织间植入治疗的24例腮腺复发腺源性恶性肿瘤患者。患者基本情况见表 1。24例腮腺复发恶性肿瘤患者中,腺样囊性癌7例,肌上皮癌4例,黏液表皮样癌3例,嗜酸性腺癌2例,多形性腺瘤中、低分化腺癌、恶性多形性腺瘤、基底细胞腺癌、淋巴上皮癌、上皮肌上皮癌、小细胞癌、涎腺导管癌各1例。11例肿瘤2~3次以上治疗后复发。根据2010年国际抗癌联盟(UICC)恶性肿瘤临床分期标准,按照TNM分期,24例患者均为临床Ⅳ期。
|
|
表 1 24例腮腺复发腺源性恶性肿瘤患者一般情况 Table 1 Patient′s characteristics of 24 recurrent parotid gland carcinoma |
纳入标准:腮腺复发恶性肿瘤患者, 均有病理学检查证实; 肿瘤已处于晚期,范围广泛,侵犯面神经等周围临近组织,或由于既往手术或放疗史,肿瘤边界难以确定,手术难以彻底切除; 影像学资料齐全,有完善的病历资料。排除标准:手术治疗后进行放射性粒子辅助治疗患者,外放疗后应用粒子治疗增量患者。
2.放射性125I粒子及治疗方法:125I放射性粒子(国药准字H20045969,直径0.8 mm,长4.5 mm,原子高科股份有限公司,宁波君安药业有限公司提供),放射性活度为0.6~0.7 mCi/粒(1 Ci=3.7×1010 Bq),半衰期59.4 d;PTC-B18 G插植针(100~150 mm,日本八光医疗集团)穿刺;枪式植入器(宁波君安药业有限公司)。基于患者临床检查与CT影像学等资料,根据肿瘤病理类型,肿瘤的位置,设计放射性粒子植入治疗计划处方剂量100~140 Gy。计划靶区(PTV)需包括肿瘤外周1~1.5 cm范围。经放射性粒子植入治疗计划系统(TPS,北京天航科霖科技发展有限公司)处理,计算并显示靶区等剂量曲线,检查剂量分布情况,靶区处方剂量所包括的区域是否涵盖全部靶区,靶区内剂量分布是否均匀,排除低于处方剂量的“冷点”,同时检测周围重要器官所接受的剂量是否在其耐受剂量之下。制作个性化3D打印穿刺引导模板,全身麻醉下进行粒子植入。植入后1周内行CT检查,进行靶区剂量学分析与验证,如有剂量冷区,进行补充粒子植入。
3.术后随访:放射性粒子植入术后按照125I粒子半衰期进行复诊,即分别在术后2、4和6个月复查,之后按照恶性肿瘤术后常规复查时间进行复查。肿瘤局部及区域复发情况:检查局部肿物消退情况,有无新生肿块,颈部有无肿大淋巴结。肿瘤的局部疗效评价参考实体肿瘤疗效评价标准(RECIST):完全缓解(CR)为所有目标病灶消失,无新病灶出现,并维持4周;部分缓解(PR)为所有极限目标病灶最长径总和减少≥30%, 并维持4周;疾病进展(PD)为较已记录到的最小目标病灶总长径总和增加≥20%, 或出现一个或多个新病灶;疾病稳定(SD)为所有极限目标病灶最长径总和缩小但未达PR,或增大未达PD。CR、PR和SD为肿瘤局部控制有效,PD为肿瘤局部控制无效。影像学CT检查在术后2个月、半年、1年,超过1年后,每年进行定期CT检查。肿瘤远处转移情况:定期胸部正位平片检查,怀疑有其他远隔器官转移者进行B超、CT、核磁共振或PET-CT检查。放射性损伤情况:皮肤反应、耳部症状、开口度开口型等。
4.统计学处理:所有数据采用Excel软件管理,采用SPSS 20.0软件进行分析,Kaplan-Meier进行生存分析和局部控制率分析。
结果1.局部控制率、生存率和无进展生存率:24例患者粒子治疗后半年复查,18例(75%)达完全缓解,3例(12.5%)部分缓解,1例(4.2%)疾病控制,2例(8.3%)疾病进展。有效率(完全缓解+部分缓解)为87.5%。
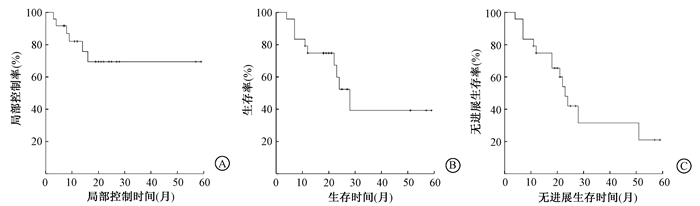
随访时间4至59个月,中位随访时间21个月,4例完全缓解患者发生再次复发,加上2例疾病进展的患者,局部控制失败患者共6例。Kaplan-Meier分析显示,1年、3年局部控制率分别为82.0%、69.4%。
在随访期内10例患者死亡,其中1例死于其他疾病,1例因局部未控制肿瘤扩展至颅底死亡,其他8例均为远处转移死亡,局部肿瘤未发现复发。1年、3年生存率分别为74.8%、39.3%,1年、3年无进展生存率为74.8%、31.5%(图 1)。
|
图 1 24例腮腺复发腺源性恶性肿瘤患者统计分析曲线A.局部控制曲线;B.生存曲线;C.无进展生存曲线 Figure 1 Statistic analysis curve of 24 recurrent parotid gland carcinoma A. Local control rate curve; B. Survival rate curve; C. Progression-free survival rate curve |
2.淋巴结转移及远处转移:24例腮腺复发恶性肿瘤患者7例发现颈部淋巴结转移,6例先进行颈淋巴结清除术后腮腺局部进行放射性粒子治疗,1例在此次局部治疗同期进行颈部淋巴结粒子植入术,随访期内均未及区域淋巴结再次转移。12例患者出现远处转移,8例为肺部转移,死亡5例,存活3例,存活患者的随访时间均在一年以上,最长者2年。其他部位转移患者4例,均在治疗后发现转移,3例死亡,1例存活。
3.24例腮腺复发恶性肿瘤患者并发症:依据放射治疗肿瘤协作组/欧洲癌症治疗研究组织(RTOG/EORTC)放射性损伤分级标准评价粒子植入术后不良反应,24例患者术后随访均未发现3级及以上急性及晚期放射性损伤发生。17例患者出现皮肤反应,主要表现为皮肤充血,色素沉着或色素脱失等。
讨论腮腺恶性肿瘤一般采用手术为主,术后辅助放疗的治疗方式,局部控制率约70%~80%,5年生存率达80%~90%[6-7]。对于无手术指征的腮腺恶性肿瘤常规采用单纯放疗手段进行治疗,疗效较差,5年局部控制率在9%~21%[8-10]。口腔颌面部恶性肿瘤复发的患者,约23%的患者能够接受再次手术治疗[11]。本研究中,24例复发腮腺恶性肿瘤患者,均在初次发现时进行了手术治疗或外放疗,肿瘤出现局部复发,复发肿瘤浸润周围正常组织,有11例肿瘤2~3次以上治疗后复发,局部组织变性及瘢痕挛缩,再次手术切除困难,本研究结果证实单纯125I粒子组织间植入治疗适用于此类患者。
复发腮腺癌较原发的治疗难度和预后也有所不同。本研究24例腮腺复发恶性肿瘤患者均为临床Ⅳ期,其局部控制率优于文献中报道的单纯放射治疗腮腺癌局部控制率[12]。腮腺癌复发的因素非常复杂,尤其是多次复发的肿瘤,在靶区勾画时,根据本课题组的经验建议扩大到肿瘤边界外1~1.5 cm,甚至包括整个腮腺区,本研究4例术后再次复发的患者,其中3例复发在靶区外。
本组病例发现远处转移的患者共12例,占50%,发生远处转移的患者生存率显著下降,是腮腺复发恶性肿瘤患者的整体治疗难点。125I粒子治疗在局部控制率上虽然效果较好,但对于生存率的控制上主要制约因素在于远处转移的发生。在肿瘤局部控制提高的情况下,如何能够控制远处转移,是提高腮腺复发癌生存率的关键。
综上,单纯放射性125I粒子组织间植入治疗,对于无法手术切除的复发腮腺恶性肿瘤是一种有效的可选方法,有助于提高患者生活质量,并可获得较高的局部控制率及生存率,其长期疗效有待进一步研究。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未接受有关公司的任何赞助,不涉及各相关方的利益冲突作者贡献声明 周晨负责采集分析数据和论文撰写;刘树铭、石妍、黄明伟负责采集数据;郑磊、吕晓鸣负责构思、指导论文的撰写和修改;张杰、张建国指导论文的撰写和修改
| [1] | Nam SJ, Roh JL, Cho KJ, et al. Risk factors and survival associated with distant metastasis in patients with carcinoma of the salivary gland[J]. Ann Surg Oncol, 2016, 23 (13): 4376-4383. DOI:10.1245/s10434-016-5356-3. |
| [2] | Rodriguez CP, Parvathaneni U, Méndez E, et al. Salivary gland malignancies[J]. Hematol Oncol Clin North Am, 2015, 29 (6): 1145-1157. DOI:10.1016/j.hoc.2015.08.002. |
| [3] | Cederblad L, Johansson S, Enblad G, et al. Cancer of the parotid gland; long-term follow-up. A single centre experience on recurrence and survival[J]. Acta Oncol, 2009, 48 (4): 549-555. DOI:10.1080/02841860802680419. |
| [4] | Carrillo JF, Vázquez R, Ramírez-Ortega MC, et al. Multivariate prediction of the probability of recurrence in patients with carcinoma of the parotid gland[J]. Cancer, 2007, 109 (10): 2043-2051. DOI:10.1002/cncr.22647. |
| [5] |
张杰, 郑磊, 黄明伟, 等. 放射性粒子组织间植入治疗口腔颌面-头颈部腺源性恶性肿瘤近期疗效分析[J].
北京大学学报(医学版), 2011, 43 (2): 272-275. Zhang J, Zheng L, Huang MW, et al. Radioactivity seeds interstitial brachytherapy treating malignant salivary gland tumors[J]. J Peking Uuiv (Health Sci), 2011, 43 (2): 272-275. DOI:10.3969/j.issn.1671-167X.2011.02.021. |
| [6] | Nam SJ, Roh JL, Cho KJ, et al. Risk factors and survival associated with distant metastasis in patients with carcinoma of the salivary gland[J]. Ann Surg Oncol, 2016, 23 (13): 4376-4383. DOI:10.1245/s10434-016-5356-3. |
| [7] | Bell RB, Dierks EJ, Homer L, et al. Management and outcome of patients with malignant salivary gland tumors[J]. J Oral Maxillofac Surg, 2005, 63 (7): 917-928. DOI:10.1016/j.joms.2005.03.006. |
| [8] | KoulR, Dubey A, Butler J, et al. Prognostic factors depicting disease-specific survival in parotid-gland tumors[J]. Int J Radiat Oncol Biol Phys, 2007, 68 (3): 714-718. DOI:10.1016/j.ijrobp.2007.01.009. |
| [9] | Maza-Solano JM, Sánchez-Gómez S, Herrero-Salado T, et al. Prognostic classification for malignant tumors of the parotid gland[J]. Revista Española De Cirugía Oral Y Maxilofacial, 2016, 38 (1): 17-22. DOI:10.1016/j.maxile.2015.01.001. |
| [10] | Lequerica-Fernández P, Peña I, Villalaín L, et al. Carcinoma of the parotid gland:developing prognostic indices[J]. Int J Oral Maxillofac Surg, 2011, 40 (8): 821-828. DOI:10.1016/j.ijom.2011.04.008. |
| [11] | Taussky D, Dulguerov P, Allal AS. Salvage surgery after radical accelerated radiotherapy with concomitant boost technique for head and neck carcinomas[J]. Head Neck, 2005, 27 (3): 182-186. DOI:10.1002/hed.20139. |
| [12] | Chen AM, Bucci MK, Quivey JM, et al. Long-term outcome of patients treated by radiation therapy alone for salivary gland carcinomas[J]. Int J Radiat Oncol Biol Phys, 2006, 66 (4): 1044-1050. DOI:10.1016/j.ijrobp.2006.06.050. |
 2017, Vol. 37
2017, Vol. 37