在胰腺癌射波刀治疗的临床实践中,目前基本都以CT模拟定位获得的图像为基础制定放疗计划,而获取高质量胰腺增强扫描的关键之一是要选择合适的扫描时间。射波刀治疗较常规分割放疗分次显著减少,能给予肿瘤靶区单次高剂量照射以杀死肿瘤细胞,因此在靶区勾画时对CT模拟定位获得的影像质量要求更细、更高,不仅要对病灶进行识别,而且要求能清晰地显示肿瘤及其与周围正常组织、器官的边界,尤其是胃和十二指肠等放射敏感器官,在制定计划时能很好地对肿瘤靶区及周围危及器官进行勾画,从而在提高肿瘤控制率的同时降低放疗所带来的不良反应。国内外在影像诊断领域对于胰腺CT增强扫描一直在进行探索,但是截至目前,放疗相关领域对于CT定位增强扫描时相选择的研究较少[1-6]。在放疗实际临床工作中多参考放射科的研究结果,但是考虑在实际工作中扫描目的不同,有必要在胰腺癌CT定位增强扫描延迟时间优化方面进行进一步研究。本研究通过对拟行射波刀治疗的胰腺癌患者进行不同延迟时间后的CT定位增强扫描,探讨最有利于靶区勾画的CT影像增强延迟扫描时相。
资料与方法1.临床资料:2015年1月至2016年1月在长海医院放疗科拟行射波刀治疗的胰腺癌患者共120例,其中男性73例,女性47例,年龄33~85岁,平均年龄约62.9岁,功能状态评分标准(KPS)评分≥80。所有入组患者均经穿刺活检病理证实(72例)或临床诊断(48例,结合CT、MR等两种以上的影像学检查和肿瘤标志物CA19-9等)为胰腺癌。采用随机数字表法分为3组进行增强扫描,分别为25、45和65 s组(25 s组),30、50和70 s组(30 s组)以及35、55和75 s组(35 s组),每组40例。患者进行CT模拟定位扫描前禁食、水4 h以上,扫描时取仰卧位,保持平静呼吸。所有接受CT定位增强检查的胰腺癌患者或其家属均在检查前自愿签署知情同意书。
2. CT检查方法
(1) 设备:荷兰飞利浦大孔径16排螺旋CT扫描机(机架孔径为85 cm)。扫描床为平面平板,激光定位为移动式的等离子光源(LEP),固定装置为负压真空气垫。
(2) 扫描参数:管电压、管电流分别设定为120 kV和250 mA,层厚为1.5 mm,扫描视野(FOV)包括肿瘤相应水平患者整个四周区域及固定装置。头足侧扫描范围为整个胰腺及病灶上下各10 cm。
(3) 增强扫描方法:采用高压注射器经肘静脉以2.5 ml/s的速率注入浓度为370 mg I/ml的碘对比剂碘海醇(按1.5 ml/kg计算,用量约80~120 ml)。增强扫描的延迟时间分为3组:25、45、65 s组(25 s组);30、50、70 s组(30 s组);35、55、75 s组(35 s组)。
3.图像评估:用光盘拷录复制患者的CT影像资料,并由3位副高以上的放疗科医生在双盲情况下根据评分表分别进行评分,评分指标包括:肿瘤边界、腹膜后淋巴结、十二指肠、胰周动静脉(腹腔动脉、腹腔干、肠系膜上动脉、脾动脉、肠系膜上静脉及脾静脉等)显示情况、靶区勾画的把握度及参考影像学检查的必要性等共11项指标。
图像质量评估主要依据边缘清晰程度和靶区勾画把握度等,采用5分法:5分,很好,显示很清晰,靶区勾画帮助很大;4分,较好,显示较清晰,靶区勾画帮助大;3分,尚可,显示欠清晰,靶区勾画帮助一般;2分,差,显示不清,不能指导靶区勾画;1分,很差,未显示,无法指导靶区勾画。
因此,靶区勾画把握度分值越小,则越不能指导靶区勾画,必须要结合治疗前的其他影像学检查。评分完成后,取3者评分的平均值进行分析。
4.统计学处理:各项评分值以x± s表示。使用SAS 9.4软件对数据进行分析。采用随机截距发展模型进行组内各评分项目不同时间点的比较;方差齐性检验后采用单因素方差分析进行组间比较;采用Sidak法进行各评分项目不同时间点的两两比较;采用Pearson法分析最优时间点时靶区勾画与各评分项目的相关性。P < 0.05为差异有统计学意义。
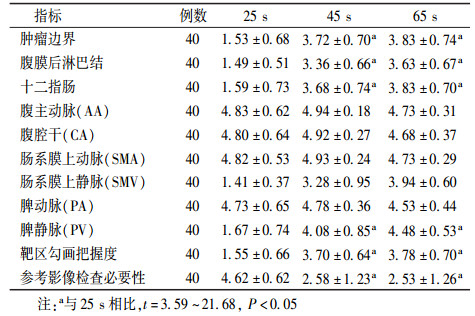
结果1. 25 s组各评价指标分值情况:结果列于表 1。由表 1可知,在25 s组中,对于肿瘤边界、十二指肠、腹膜后淋巴结、脾静脉、靶区勾画的把握度及参考影像学检查的必要性等参数评分值25 s与45、65 s时的差异均有统计学意义(t=3.59~21.68, P < 0.05),65 s时的均值高于45 s,但差异均无统计学意义(P>0.05),且在放疗科实际临床工作中,CT定位增强时靶区勾画的把握度大小决定了能否进行精确计划和精确治疗。因此,认为本组3个时间点中CT定位增强延迟65 s进行扫描获得的CT图像最有利于指导靶区勾画。
|
|
表 1 25 s组各评分指标比较(x± s) Table 1 Comparison of scoring index in 25 s group (x± s) |
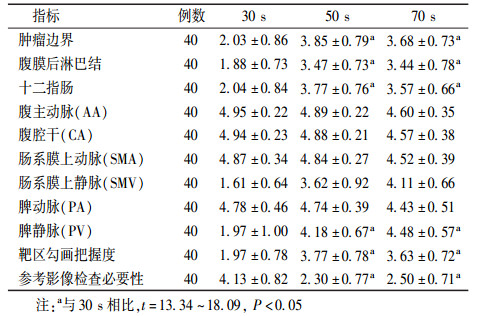
2.30 s组各评价指标分值情况:结果列于表 2。由表 2可知,肿瘤边界、腹膜后淋巴结、十二指肠、脾静脉(PV)、靶区勾画把握度大小及参考影像学检查的必要性30 s分别与50、70 s比较,差异均有统计学意义(t=13.34~18.09, P < 0.05)。肿瘤边界、腹膜后淋巴结、十二指肠及靶区勾画把握度在50 s时高于70 s,而PV及是否有必要参考影像学检查在70 s时高于50 s,但差异均无统计学意义(P>0.05),同样根据实际临床工作中的需求,认为在30 s组中CT定位增强延迟50 s时最有助于进行靶区勾画。
|
|
表 2 30 s组各评分指标均值比较(x± s) Table 2 Comparison of scoring index in 30 s group (x± s) |
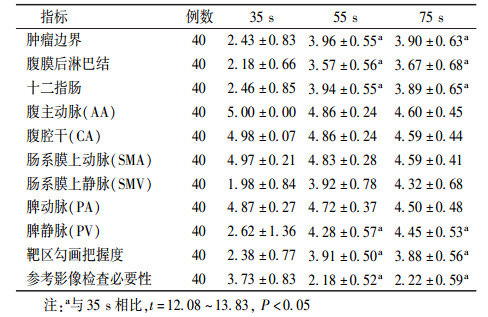
3. 35 s组各评价指标分值情况:结果列于表 3。由表 3可知,肿瘤边界、腹膜后淋巴结、十二指肠、脾静脉(PV)、靶区勾画把握度大小及参考影像学检查的必要性35 s与55、75 s时的差异均有统计学意义(t=12.08~13.83, P < 0.05),肿瘤边界、十二指肠及靶区勾画把握度在55 s时高于75 s,腹膜后淋巴结、PV及是否参考影像学检查75 s时高于55 s,但差异均无统计学意义(P>0.05)。同上所述,认为在35 s组中CT模拟定位增强延迟时间为55 s时获得的CT图像对靶区勾画帮助最大。
|
|
表 3 35 s组各评分指标均值比较(x± s) Table 3 Comparison of scoring index in 35 s group (x± s) |
4.最优时间点比较:以上各组最优时间点分别为65、50和55 s。采用单因素方差分析进行组间比较,不同时间点仅腹主动脉(AA)、腹腔干(CA)及脾动脉(PA)的差异有统计学意义(F=4.66、6.04、3.23,P < 0.05)。采用Sidak法进行两两比较,以上评分指标50 s的高于65 s,差异有统计学意义(P < 0.05)。肿瘤边界、腹膜后淋巴结、十二指肠及靶区勾画等各评分指标则在不同时间点差异无统计学意义(P> 0.05)。临床实践工作中,进行精确放疗关键的第1步在于进行精确的靶区勾画,因此CT定位增强扫描时决定的靶区勾画的把握度大小至关重要,根据靶区勾画把握度大小的均值,CT定位增强扫描延迟建议的最优时间为55 s。
5.靶区勾画与最优时间点55 s时各评分指标的相关性分析:靶区勾画与胰周动静脉的显示情况差异无统计学意义(P>0.05),而靶区勾画把握度与肿瘤边界、十二指肠、腹膜后淋巴结的显示情况及参考影像学检查的必要性则均有一定的相关性(r=0.914 4、0.902 7、0.734 2、-0.926 3,P < 0.05),其中参考影像学检查的必要性呈明显的负相关性(r=-0.926 3,P < 0.05),与其余各项间均呈正相关(r=0.914 4、0.902 7、0.734 2,P < 0.05),且以肿瘤边界最为明显(r=0.914 4,P < 0.05)。
讨论在放射诊断领域,国内外的学者对于多层螺旋CT(MDCT)胰腺扫描方案的优化问题进行了不断探索。Tang等[1]和Fukukura等[2]采用高浓度的碘对比剂即370 mg I/ml,剂量按体重计算,注射流速为4 ml/s条件下进行扫描,研究结果显示在主动脉CT值达150 HU后延迟30 s扫描胰腺实质的强化程度及肿瘤-正常胰腺组织对比差异显示最佳。但是在此研究中未记录主动脉的通过时间,而Knodo等[3]的研究结果显示,在最佳延迟扫描时间主动脉通过时间约为15 s。因此,综合以上所述,在前述扫描条件下,增强扫描延迟45 s时胰腺实质强化程度及肿瘤-正常胰腺组织强化差异显示最佳。Tang等[1]的研究中胰腺实质的平均强化CT值达119.8~121.8 HU,而Schueller等[4]研究在流速同为4 ml/s时,胰腺实质强化程度略有不同,强化峰值仅为106.2 HU。经对比分析后,考虑可能因对比剂浓度不同所致。同时,Marin等[5]研究显示,在注射速率为8 ml/s时,胰腺实质强化峰值更高,并可增加肿瘤-胰腺的对比,但是8 ml/s的高流速因血管破裂外漏的风险较高,且仍然不确定在此条件下的扫描延迟时间优化能否提高肿瘤可切除性和血管分期的评估。李卉等[6]研究使用对比剂浓度为300 mg I/ml的欧乃派克总量90 ml、注射速率3 ml/s时,建议的三期延迟扫描时间分别为25 s(动脉期)、50 s(胰腺期)、65 s(肝脏期)。以上试验研究目的均为更好地进行胰腺癌的诊断、分期以及对术前评估的判断,与放疗时勾画靶区的要求不甚相同。
放疗科行CT模拟定位主要为了更精确地勾画靶区,并利用获得的CT图像进行三维重建,但是平扫时不能区分胰腺癌病灶及周围正常组织、结构边界,多需要在其他优势图像(如增强CT、MR、PET/CT等)上进行勾画,同时在CT平扫图像上的相应部位显示所勾画的轮廓以进行基于组织电子密度的物理计划制定。进行增强扫描有助于病灶及周围正常组织、器官边界的清晰显示,目前大多数放疗中心CT定位时考虑到靶区勾画的需求及患者受射线量等问题多进行单期增强扫描,而延迟时间多为参考放射诊断科的资料,放疗领域对于CT定位增强扫描的最佳延迟时间目前尚未见文献报道。本研究基于有利于放疗靶区及危及器官勾画的原则,探讨对拟行射波刀治疗的胰腺癌患者行CT定位增强扫描的最佳延迟时间。
本院放射科行胰腺检查时,99%的中老年患者在对比剂总剂量为90 ml、注射速率为3 ml/s时,多能经手背静脉一次注射成功并完成3期增强扫描(在CT值达160 HU自动触发扫描后分别延迟5、19和45 s)。本试验在参考以上研究结果和放疗科实际工作中要求的基础上,进一步探讨不同延迟对CT定位增强扫描所获得的图像质量对靶区及危及器官勾画的影响。
在整个放疗实施过程中确定靶区范围成为精确放疗的关键环节之一,而CT模拟定位获得的CT图像则是精确靶区勾画的基础。如前所述,在临床实际靶区勾画工作中不仅需要识别病变,更需要综合考虑肿瘤边界、十二指肠、腹膜后淋巴结及胰周血管的显示情况。根据国内外文献资料总结,影响CT增强图像的因素大致可分为3类:CT扫描条件[1, 7-8](包括CT机型及扫描参数、延迟时间等)、对比剂注射条件[4, 9-10](浓度、速率、总剂量等)、患者的自身条件差异[11-12](包括体重、个体循环差异等)。本研究结果显示,采用大孔径16排螺旋CT扫描机行增强扫描,在延迟时间为50、55、65 s时对肿瘤边界及周围正常组织、器官边界显示较清晰,最有利于靶区勾画,且基本趋于稳定,可以推断,50~65 s为最利于靶区勾画的延迟CT增强时间平台期。若进行单期增强扫描则延迟55 s即可,且与肿瘤边界、十二指肠及腹膜后淋巴结显示情况呈正相关,与有必要进一步参考影像学检查呈明显负相关。该研究结果可用于指导放疗领域行胰腺癌立体定向放疗前CT增强扫描增强延迟时间的选择。这与文献上影像诊断领域胰腺检查所用3期增强的胰腺期时间大致相同。本研究结果存在的不足之处主要是:① 由于病例选择所限,患者年龄差较大(33~85岁),扫描时相会因个体差异影响结果;② 参与研究的3位放疗专家对评分标准的理解会有一定主观性差异。后期拟通过扩大样本量进行更深入的研究以弥补不足。
利益冲突 无作者贡献声明 孟鸿宇负责收集资料、整理数据和统计分析、撰写论文;江林宫、陈迪负责协助整理数据;伏少华参与病例收集;居小萍、张晓青负责数据分析;张火俊指导论文修改及对学术问题进行解答
| [1] | Tang A, Billiard JS, Chagnon DO, et al. Optimal pancreatic phase delay with 64-detector CT scanner and bolus-tracking technique[J]. Acad Radiol, 2014, 21 (8): 977-985. DOI:10.1016/j.acra.2014.04.004. |
| [2] | Fukukura Y, Takumi K, Kamiyama T, et al. Pancreatic adenocarcinoma:a comparison of automatic bolus tracking and empirical scan delay[J]. Abdom Imaging, 2010, 35 (5): 548-555. DOI:10.1007/s00261-009-9560-5. |
| [3] | Kondo H, Kanematsu M, Goshima S, et al. MDCT of the pancreas:optimizing scanning delay with a bolus-tracking technique for pancreatic, peripancreatic vascular, and hepatic contrast enhancement[J]. AJR Am J Roentgenol, 2007, 188 (3): 751-756. DOI:10.2214/AJR.06.0372. |
| [4] | Schueller G, Schima W, Schueller-Weidekamm C, et al. Multidetector CT of pancreas:effects of contrast material flow rate and individualized scan delay on enhancement of pancreas and tumor contrast[J]. Radiology, 2006, 241 (2): 441-448. DOI:10.1148/radiol.2412051107. |
| [5] | Marin D, Nelson RC, Guerrisi A, et al. 64-section multidetector CT of the upper abdomen:optimization of a saline chaser injection protocol for improved vascular and parenchymal contrast enhancement[J]. Eur Radiol, 2011, 21 (9): 1938-1947. DOI:10.1007/s00330-011-2139-x. |
| [6] |
李卉, 曾蒙苏, 周康荣, 等. 多层螺旋CT胰腺检查:不同注射条件下时间窗的选择[J].
临床放射学杂志, 2005, 24 (6): 511-514. Li H, Zeng MS, Zhou KR, et al. Multislice spiral CT in pancreas examination:optimal temporal window at different injection rates and doses[J]. J Clin Radiol, 2005, 24 (6): 511-514. DOI:10.3969/j.issn.1001-9324.2005.06.011. |
| [7] | Zamboni GA, Kruskal JB, Vollmer CM, et al. Pancreatic adenocarcinoma:value of multidetector CT angiography in preoperative evaluation[J]. Radiology, 2007, 245 (3): 770-778. DOI:10.1148/radiol.2453061795. |
| [8] | Marin D, Nelson RC, Barnhart H, et al. Detection of pancreatic tumors, image quality, and radiation dose during the pancreatic parenchymal phase:effect of a low-tube-voltage, high-tube-current CT technique-preliminary results[J]. Radiology, 2010, 256 (2): 450-459. DOI:10.1148/radiol.10091819. |
| [9] | Holalkere NS, Matthes K, Kalva SP, et al. 64-Slice multidetector row CT angiography of the abdomen:comparison of low versus high concentration iodinated contrast media in a porcine model[J]. Br J Radiol, 2011, 84 (999): 221-228. DOI:10.1259/bjr/14535110. |
| [10] | Fleischmann D, Kamaya A. Optimal vascular and parenchymal contrast enhancement:the current state of the art[J]. Radiol Clin North Am, 2009, 47 (1): 13-26. DOI:10.1016/j.rcl.2008.10.009. |
| [11] | Yanaga Y, Awai K, Nakayama Y, et al. Pancreas:patient body weight tailored contrast material injection protocol versus fixed dose protocol at dynamic CT[J]. Radiology, 2007, 245 (2): 475-482. DOI:10.1148/radiol.2452061749. |
| [12] | Kondo H, Kanematsu M, Goshima S, et al. Abdominal multidetector CT in patient with varying body fat percentages:estimation of optimal contrast material dose[J]. Radiology, 2008, 249 (3): 872-877. DOI:10.1148/radiol.2492080033. |
 2017, Vol. 37
2017, Vol. 37