2. 430079 武汉, 湖北省肿瘤医院放疗科;
3. 430079 武汉, 湖北省肿瘤医院放射科
2. Department of Radiotherapy, Hubei Cancer Hospital, Wuhan 430079, China;
3. Department of Radiology, Hubei Cancer Hospital, Wuhan 430079, China
近年来,随着放射医疗技术的不断发展,3D打印技术由于具有快速设计和成型的特点,而逐渐被引入放射治疗领域,用于个性化放疗方案的制定和分析[1]。3D打印是使用三维数据制造实体器件的一种方法,属于快速成型技术。目前,3D打印技术已成功地应用在放射性粒子植入术中[2]。本研究利用3D打印,首先做出颅脑体模,验证等效骨骼和脑组织的等效材料;其次制作全头颅体模,仿真颅脑、皮肤和肌肉等组织,对患者进行个性化放疗剂量验证,为三维适形放射治疗提供一种安全可靠的剂量确定手段。
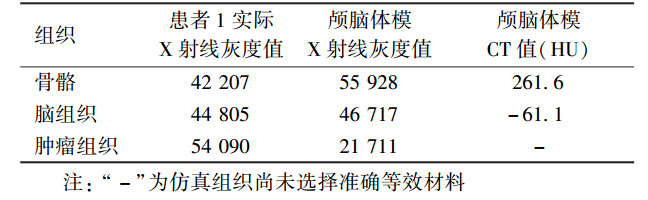
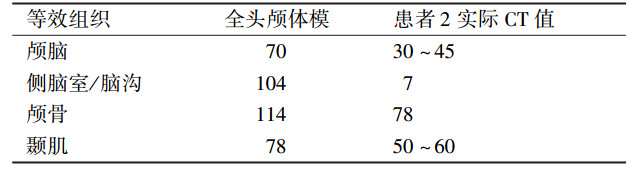
材料与方法1.三维体模设计:使用Brilliance-ICT扫描设备(荷兰Philips公司),分别扫描患者1和患者2,得到两例CT数据样本。扫描范围为头部和颈部。扫描条件:管电压120 kV,电流267 mA,螺距0.5,层厚1.5 mm,扫描层数153层,轴向扫描,距阵512×512。将在此条件下获得的DICOM序列图像数据,导入Mimics Research 17.0分析软件(比利时Materialize NV公司),然后对两例患者的图像数据进行三维重建,使用阈值方法分割目标组织,使用表面绘制方法重建目标组织,获得标定皮肤、颅骨、肿瘤和脑组织以及其他器官组织的三维重建体模[3],见图 1。使用Magic 10.0软件(比利时Materialize NV公司)对体模进行细节修复和噪声消除,以及实体生成,见图 2。
|
图 1 将患者CT扫描的DICOM图像导入Mimics软件重建的初始图像及三维体模(基于患者1的重建) A.基于图像数据多平面重建的冠状位切面;B.原始横断位切面;C.基于图像数据多平面重建的矢状位;D.由患者图像数据重建的骨骼3D模型 注:以mm为单位,一个像素点为1,像素间距0.313,DICOM图像格式 Figure 1 The patients′ CT DICOM images imported into the ′Mimics′ reconstructed by the initial images and 3D phantom (Based on the data of the first patient) A.Coronal section imaging: multi-planer reconstruction of the transverse section using the raw data; B. Reconstruction of the transverse section using the patient′s image data; C. Multi-planer reconstruction of the median sagittal section using the patient′s image data; D. The model of 3D reconstruction of the bone′s using the patient′s image data |
|
图 2 Mimics软件的三维重建模型A.基于患者1的三维重建颅脑体模;B.基于患者2的三维重建全头颅体模 Figure 2 3D reconstruction model using Mimics A.The 3D reconstruction of skull-brain phantom of the first patient; B. The 3D reconstruction of head phantom of the second patient |
2.辐射等效组织材料选取:各组织的等效材料,通过前期辐射等效试验,加以改进,确定适用于本研究的对应骨骼、脑组织、皮肤和肌肉的组织辐射等效材料。使用高聚物为基材,加以改性环氧树脂乳液的高分子树脂活性材料作为骨骼辐射等效材料[4];使用带有树脂涂层的聚氨酯胶(polyurethane reactive,PUR)作为脑组织辐射等效材料(两种密度代表正常软组织和肿瘤组织)[5];使用石蜡混合物作为皮肤等效材料[6];使用聚苯乙烯混合物作为口腔、鼻咽等肌肉组织辐射等效材料(用于全头颅体模)[7]。
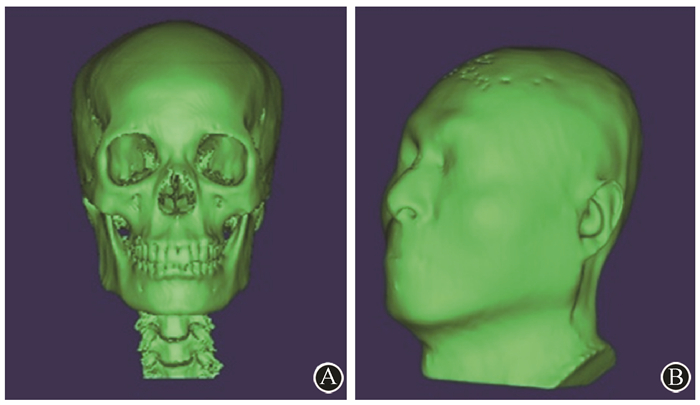
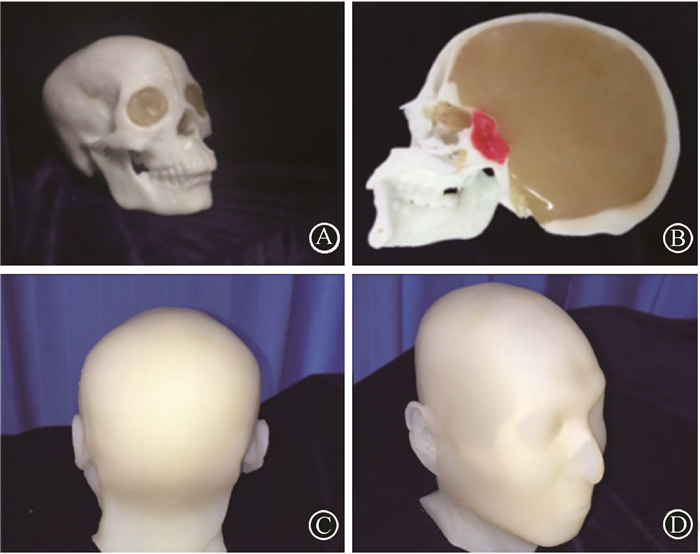
3. 3D打印体模:将Mimics软件生成的STL三维实体文件导入3D打印机OBJET500(美国Stratasys公司),验证和校准,打印输出;通过熔融堆积技术形成颅骨,光敏成形和倒模技术获得脑组织和其他软组织体模,最终得到的颅脑体模与全头颅体模,见图 3。
|
图 3 3D打印的个性化颅脑体模和全头颅体模A.仿真患者1的颅脑体模;B.颅脑体模正中矢状位切面(红色标记处为肿瘤组织);C.仿真患者2的3D打印全头颅体模后视图;D.仿真患者2的3D打印全头颅体模侧视图 Figure 3 The 3D personalized skull-brain phantom and head phantom A. The simulated skull-brain phantom of the first patient; B. The median sagittal plane of the skull-brain phantom (The red mark refers to tumor′s tissue.); C. The rear view of 3D printing head′s phantom of the second patient; D. The lateral view of 3D head′s phantom of the second patient |
结果
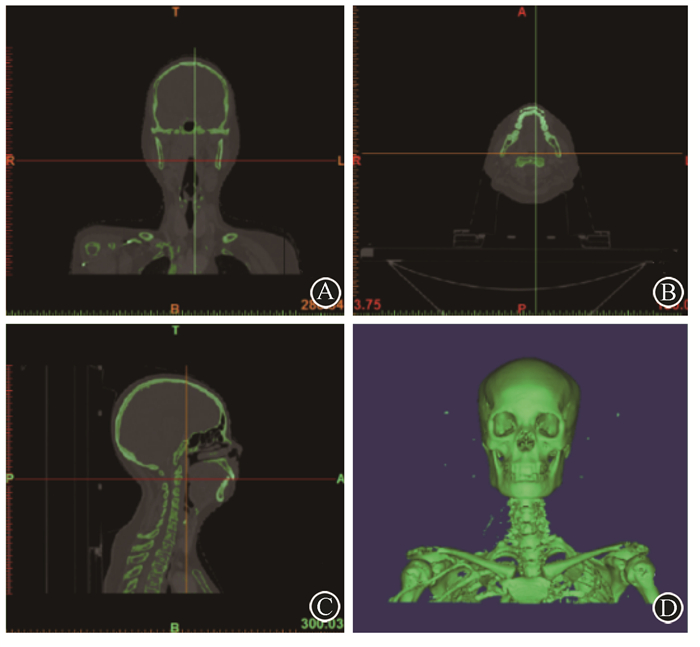
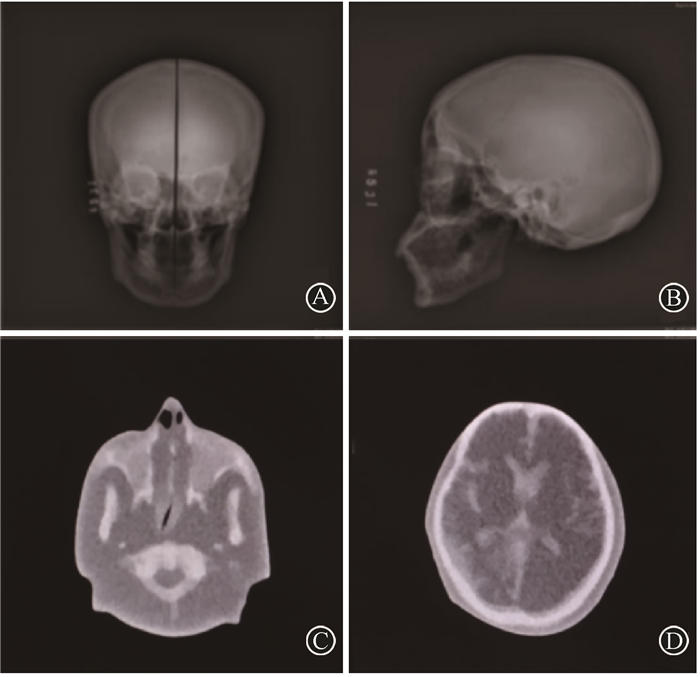
1.利用仿真体模进行治疗剂量学验证及计划对比:对两体模分别进行DR CXDI-55G(日本Canon公司)和Brilliance-ICT(荷兰Philips公司)成像,所得影像见图 4。获得各组织等效材料的X射线灰度值和CT值,见表 1。将颅脑体模的数据转入放射治疗系统,电离室PTW31033(德国PTW公司)插入体模中,在放射治疗设备下输入样本原定放射计划并实施,对感兴趣区域进行绝对剂量测量,选取测量点,进行测量并取剂量数据的均值,比较和验证初始放疗计划,见图 5。
|
图 4 两体模在影像设备下的成像A.颅脑体模在DR下的正位影像; B.颅脑体模在DR下的侧位影像; C.全头颅体模的第一颈椎层面CT成像; D.全头颅体模的侧脑室层面CT成像 Figure 4 The images of two phantoms using imaging equipment A. The anteroposterior views of skull-brain phantom using DR; B.The lateral views of skull-brain phantom using DR; C. The first cervical spine level layer of the head phantom using CT; D. The lateral ventricle layer of the head phantom using CT |

|
图 5 颅脑体模的成像A.颅脑体模的横断位;B颅脑体模的表面绘制3D重建图;C.颅脑体模的正中矢状位;D.颅脑体模的冠状位 Figure 5 The skull-brain phantom′s imaging A. The skull-brain phantom′s transverse section; B. 3D reconstruction of surface rendering of the skull-brain phantom; C. The skull-brain phantom′s medial sagittal section; D. The skull-brain phantom′s medial coronal section |
|
|
表 1 患者1及颅骨体模各组织对X射线剂量吸收情况的比较 Table 1 Comparison of the tissues of skull-brain phantom absorbed dose for X-rays |
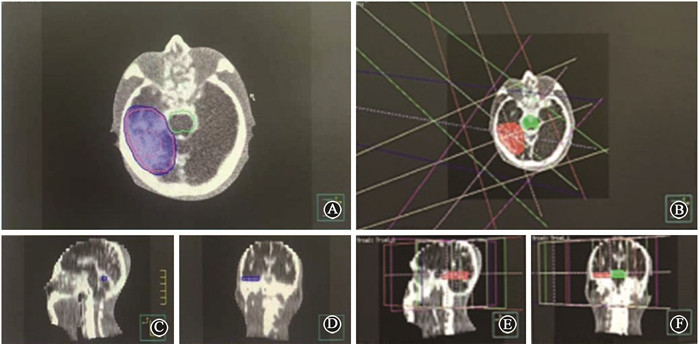
将所获得的全头颅体模,在原定放疗条件下扫描,得到的图像数据传入放疗计划系统(TPS)Monaco 3.00.50(瑞典Elekta公司)后,所显示的图像(图 6)可以清楚观察到骨骼、软组织和仿真病灶,可进行基于断层图像的放射治疗计划制定,用笔束电离室对绝对剂量进行测量,然后和治疗计划进行比较和验证原定放疗计划。由体模实物和扫描图像可知,各仿真部分的形态和辐射衰减数值均与相应真实组织接近,具有较好的仿真效果。全头颅体模的CT值见表 2。
|
图 6 基于放疗计划系统的全头颅体模放疗计划A、C、D.依次为全头颅体模横断位、正中矢状位以及冠状位图像;B、E、F.依次为全头颅体模横断位、正中矢状位以及冠状位图像 注:蓝色区域为临床靶区,红色区域为肿瘤区,绿色区域为脑干,病灶剂量5 000 mGy,脑干剂量4 950 mGy(限于5 000 mGy) Figure 6 Head phantom's radiotherapy planning based on TPS A, C, D. There are head phantom's transverse section, the middle of the median sagittal section and coronal section in turn; B, E, F. There are head phantom's transverse section, the middle of the median sagittal section and coronal section in turn |
|
|
表 2 全头颅体模的不同等效组织的CT值与患者2的实际CT值对比(HU) Table 2 Comparison of CT value of different disfigurement tissues with real sample (HU) |
讨论
在现有放射治疗方案的验证方法中,蒙特卡罗仿真实施起来简单快速,但其数学建模的方法本身存在一定的误差[8]。同时,患者身体各方面的差异巨大,蒙特卡罗仿真也无法灵活地体现出个性化和器官组织的剂量验证。
在本研究中,体模来源于患者真实数据,其形态结构同真人接近一致。属于高度个性化定制,因此体模的精确度和个性化都符合临床需求[9]。体模制作使用的各种辐射等效材料,能够有效的仿真患者头部辐射衰减。这种体模实物的剂量验证,不同于软件仿真验证,可以进行真实的辐射剂量实施,并在感兴趣区域插入电离室等进行实际定量测量,是一种所见即所得的验证方法。
随着快速成型技术的发展,越来越多的3D打印应用于临床工作。如用3D打印骨质类填充材料[10],用于手术分析。
本研究目前还有较多不足,其一是软组织的密度同实际脑组织存在一定差异,且无白质和灰质的变化。这种由于材料问题造成的剂量误差也是目前3D打印材料尚无法解决的问题。其二是打印全脑体模所需时间>8 h,时间成本也相对较高,距临床应用还存在一定距离。其三是针对于口腔、鼻咽等肌肉组织,由于其构造、密度复杂,无法做到精确地等效模拟。本研究使用等效材料进行形态模拟,存在等效组织结构之间的空腔,导致剂量分布产生误差。最后,本研究中为适应体模测量情况,采用电离室进行测量点的剂量测量。剂量检测设备为笔束电离室,此种设备只能先获取测量点,然后进行取样测量,尚不能得到详细的病灶剂量分布(EDR2胶片和EBT2胶片可以获取详尽的病灶剂量分布,由于情况限制,本研究中没有使用此种测量方式[11])。有待于未来3D打印等快速成型技术的进一步成熟,以及剂量测量仪器的进一步改善。
综上所述,本研究所采用的3D打印个性化组织等效仿真体模技术,可根据患者实际情况定制个性化体模,通过在体模肿瘤处和正常组织处加电离室等剂量测量设备,有助于验证患者放疗计划的剂量实施。
利益冲突 无作者贡献声明 张琛负责论文的撰写;王志鹏负责3D建模;张昊兆参与3D建模;何中正、袁子龙和杨如飞负责体模的扫描与剂量验证;路伟钊负责数据的整理和分析;石丽婷负责模型的3D打印与加工;侯坤参与模型的3D打印与加工;邱建峰负责论文的设计和实验进程的整体安排
| [1] | Rengier F, Mehndiratta A, von Tengg-Kobligk H, et al. 3D printing based on imaging data:review of medical applications[J]. Int J Comput Assist Radiol Surg, 2010, 5 (4): 335-341. DOI:10.1109/MAES.2004.1374061. |
| [2] | Hongtao Z, Xuemin D, Huimin Y, et al. Dosimetry study of three-dimensional print template-guided precision (125) I seed implantation[J]. J Cancer Res Ther, 2016, 12 (7): 159-165. DOI:10.4103/0973-1482.200607. |
| [3] | Atalay HA, Canat HL, Vlker V, et al. Impact of personalized three-dimensional (3D) printed pelvicalyceal system models on patient information in percutaneous nephrolithotripsy surgery:a pilot study[J]. Int Braz J Urol, 2017, 24 (3): 43 DOI:10.1590/S1677-5538.IBJU.2016.0441. |
| [4] | Liang W, Yao Y, Huang Z, et al. Application of computer-assisted design and manufacturing-fabricated artificial bone in the reconstruction of craniofacial bone defects[J]. J Oral Maxillofac Surg, 2016, 74 (7): 1499(e1-e8) DOI:10.1016/j.joms.2016.03.017. |
| [5] | Baiu C. Brain tissue equivalent material and phantom device comprising the same:US, 2016/0015356 A1[P]. 2016-01-21. |
| [6] | Lualdi M, Colombo A, Mari A, et al. Development of simulated pigmented lesions in an optical skin-tissue phantom:experimental measurements in the visible and near infrared[J]. J Laser Appl, 2002, 14 (14): 122-127. |
| [7] | Persliden J, Schuwert P, Mortensson W. Comparison of different materials for test phantoms in diagnostic radiology[J]. Radiat Prot Dosim, 1993, 49 (1-3): 345-347. DOI:10.1017/CBO9781107415324.004. |
| [8] |
金浩宇, 周凌宏, 陈超敏. 在放射治疗计划中应用蒙特卡罗剂量计算方法研究[J].
临床医学工程, 2010, 17 (1): 9-10. Jin HY, Zhou LH, Chen CM. Application of Monte Carlo dose calculation method in the radiotherapy planning[J]. Clin Med Eng, 2010, 17 (1): 9-10. DOI:10.3969/j.issn.1674-4659.2010.01.004. |
| [9] |
邱建峰, 王鹏程, 王国柱, 等. 磁共振综合测试体模的设计[J].
中国医学影像技术, 2012, 28 (5): 997-1000. Qiu JF, Wang PC, Wang GZ, et al. Design of multi-function MR test phantom[J]. Chin J Med Imag Technol, 2012, 28 (5): 997-1000. DOI:10.13929/j.1003-3289.2012.05.002. |
| [10] |
胡立伟, 钟玉敏. 3D打印技术在儿童先天性心脏病诊断治疗中的应用进展[J].
中国医学物理学杂志, 2015, 32 (4): 514-519. Hu LW, Zhong YM. Three dimensional printing technology for the diagnosis and treatment of congenital heart disease in childhood[J]. Chin J Med Phys, 2015, 32 (4): 514-519. DOI:10.3969/j.issn.1005-202X.2015.04.014. |
| [11] | Uehara R, Tachibana H, Ito Y, et al. A practical procedure to improve the accuracy of radiochromic film dosimetry:a integration with a correction method of uniformity correction and a red/blue correction method[J]. Nihon Hoshasen Gijutsu Gakkai Zasshi, 2013, 69 (6): 617-631. DOI:10.6009/jjrt.2013_JSRT_69.6.617. |
 2017, Vol. 37
2017, Vol. 37