2. 250117 济南, 山东大学附属山东省肿瘤医院放疗科
2. Department of Radiation Oncology, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, China
图像引导的三维适形放疗和调强放疗已成为食管癌放疗的主流模式,靶区确定是影响食管癌放疗疗效的关键环节。基于三维CT(3D-CT)模拟定位扫描是目前我国常用的食管癌定位技术,而呼吸引起的食管靶区运动是影响靶区确定的主要因素[1],四维CT(4D-CT)可准确反映肿瘤运动范围和空间位置变化规律[2],锥形束CT(CBCT)是一种在线校正成像工具,也可反映治疗体位肿瘤运动情况,提供患者治疗位置的容积信息[3]。基于4D-CT和CBCT可构建个体化内大体肿瘤体积(internal gross tumor volume,IGTV)[4-5],本研究比较了基于3D-CT、4D-CT和CBCT确定的不同靶区的体积、位置和包含关系差异,探讨不同模态CT包含的运动信息特征。
资料与方法1.临床资料:选择2014年8月至2015年12月在本院行三维适形或调强放疗的食管癌患者34例,其中男19例,女15例;年龄41~83岁(中位年龄71岁)。其中鳞癌33例,未分化癌1例。按美国癌症联合会/国际抗癌联盟(AJCC/UICC)2009年食管癌分段标准分为胸上段10例,胸中段14例,胸下段10例。入组患者心肺功能正常且均无胸部放疗史。
2. CT模拟定位扫描:患者仰卧位,负压袋固定,在自由呼吸状态下序贯完成3D-CT和4D-CT模拟定位扫描。首先行增强3D-CT轴位扫描,扫描参数为:120 kV,200 mA,45 ml对比剂,注射速率为1.5 ml/s。每个扫描周期为2.8 s,其中扫描时间1 s,准直器宽度2.4 cm,间隔时间1.8 s,层厚3 mm;3D-CT扫描完后继续行增强4D-CT扫描,扫描参数为:120 kV,400 mA,3D-CT扫描后继续注射55 ml对比剂,注射速率为1 ml/s,扫描时间>60 s,重建层厚3 mm。4D-CT扫描时辅以美国瓦里安公司实时位置管理(real time position management,RPM)系统,利用红外摄像装置记录放置在剑突附近模块上的2个荧光标记点运动轨迹同步记录呼吸信号,4D-CT工作站将运动轨迹信号转换成呼吸运动信息整合到4D-CT图像资料中,再依据RPM记录的呼吸信号,将每个呼吸周期的CT图像平均分为10个呼吸时相,并指定0时相为吸气末、50时相为呼气末,同时依据像素最大CT值重建获得最大密度投影(MIP)图像。
3. CBCT图像采集:首次治疗前,依据CT模拟定位数据摆位,按照治疗计划参数摆位至肿瘤中心。利用kV CBCT扫描获得治疗体位CBCT增强扫描图像,扫描参数为:120 kV,1 000 mA,90 ml对比剂,注射速率为1.8 ml/s。整个扫描过程约1 min左右,图像重建层厚3 mm。将CBCT图像与计划CT图像自动配准,并依据骨性标志进行手动微调。配准后的CBCT图像传到Eclipse 8.6治疗计划系统。
4.靶区勾画:分别在3D-CT、4D-CT的10个时相及MIP图像、CBCT图像上勾画可见肿瘤,定义为GTV3D、GTV4D50、IGTVMIP、IGTVCBCT,4D-CT 10个呼吸时相上勾画的GTV融合得到IGTV10。为尽量减小勾画误差,由同一位放疗医师勾画(窗宽400 HU,窗位40 HU)。
5.三维运动矢量:通过瓦里安计划系统可得到GTV或IGTV中心点左右方向(LR)、前后方向(AP)、上下方向(CC)位于坐标系中的具体坐标,也通过瓦里安计划系统可得到各靶区相应体积。分别测定同一患者10个呼吸时相GTV中心点坐标,同一坐标轴上最大值与最小值相减,得出靶区中心在某一坐标轴上的最大运动幅度,根据公式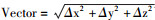
6.靶区匹配指数、未被包含比例计算:匹配指数(MI)定义为靶区A和B的交集与并集的比值,公式为MI=A∩B/A∪B[6]。MI反映两靶区体积在大小、形状、位置空间的匹配情况。靶区B未被靶区A包含比例[Per(B not in A)]定义为B未被A覆盖的体积占B总体积的比例,如果A是标准靶区,利用B制定放疗计划,将有Per(B not in A)的正常组织接受不必要的照射,同时有Per(A not in B)的标准靶区得不到照射。公式为Per(B not in A)=1-(A∩B)/B[7]。
7.统计学处理:数据用x± s表示。应用SPSS 19.0软件进行分析。正态性检验采用Shapiro-Wilk检验,靶区体积、位置、匹配指数及未被包含比例均符合正态分布,对靶区体积、位置、匹配指数及未被包含比例比较行配对t检验,体积比、未被包含比例与三维运动矢量相关性检验行Pearson法分析。P<0.05为差异有统计学意义。
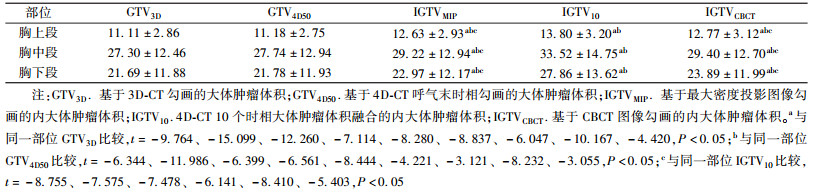
结果1.靶体积比较:靶区体积差异见表 1,胸上、中、下段GTV3D与GTV4D50明显小于其他内大体肿瘤体积(t=-15.099~-3.055,P<0.05)。胸上、中、下段IGTV10均大于IGTVMIP与IGTVCBCT(t=-8.755~-5.403,P<0.05)。而GTV3D与GTV4D50及IGTVMIP与IGTVCBCT体积比较,差异均无统计学意义(P>0.05)。各段食管肿瘤GTV3D、GTV4D50、IGTVMIP及IGTV10对IGTVCBCT的体积比见表 2,胸上段GTV4D50/IGTVCBCT与三维运动矢量成负相关性(r=-0.756, P<0.05)。胸中段IGTV10/IGTVCBCT与运动矢量成正相关性(r=0.695, P<0.05)。
|
|
表 1 34例食管癌患者不同CT图像勾画的大体肿瘤体积(cm3, x± s) Table 1 The gross tumor volume delineating on different CT images for 34 patients with esophageal cancer (cm3, x± s) |
|
|
表 2 34例食管癌患者不同CT图像勾画的大体肿瘤的体积比(x± s) Table 2 The ratios of the gross tumor volume delineating on different CT images for 34 patients with esophageal cancer(x± s) |
2.靶区位置差异:靶区位置比较时IGTVCBCT某一个方向的坐标分别与GTV3D、GTV4D50、IGTVMIP、IGTV10相应方向的坐标行配对t检验,胸上段GTV3D、GTV4D50、IGTVMIP、IGTV10与IGTVCBCT靶区中心点在AP方向上差异有统计学意义(t=-3.559~-2.435,P<0.05),但在LR、CC方向上差异无统计学意义(P>0.05)。胸中段GTV3D及IGTV10与IGTVCBCT靶区中心在AP方向的差异有统计学意义(t=3.154、2.201,P<0.05),而GTV4D50与IGTVCBCT靶区中心在CC方向不同(t=2.484,P<0.05),其余靶区中心与IGTVCBCT靶区中心在LR、AP和CC方向的差异无统计学意义(P>0.05)。胸下段GTV3D、GTV4D50、IGTVMIP与IGTVCBCT在LR方向的差异有统计学意义(t=-2.920~-2.365,P<0.05)。其余靶区中心与IGTVCBCT靶区中心在LR、AP和CC方向的差异无统计学意义(P>0.05)。
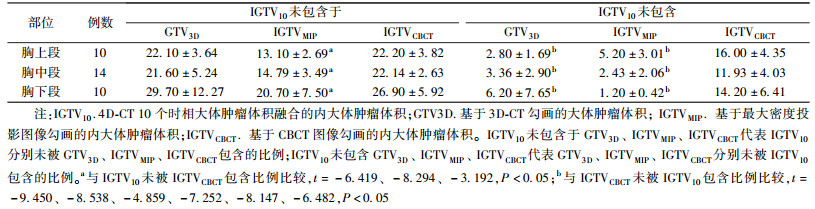
3.靶区未包含比例差异:表 3为以IGTV10作为标准靶区,各段食管癌患者GTV3D、GTV4D50、IGTVMIP及IGTVCBCT与IGTV10间靶区漏照及误照的差异比较。不论肿瘤位于胸上段还是胸中下段,IGTV10未被GTV3D包含比例与IGTV10未被IGTVCBCT包含比例间差异无统计学意义(P>0.05),但IGTV10未被IGTVCBCT包含比例都明显大于IGTV10未被IGTVMIP包含比例(t=-8.294~-3.192,P<0.05);IGTVCBCT未被IGTV10包含比例与GTV3D未被IGTV10包含比例、IGTVMIP未被IGTV10包含的比例比较,IGTVCBCT未被IGTV10包含比例大于GTV3D未被IGTV10包含比例及IGTVMIP未被IGTV10包含的比例(t=-9.450~-4.859,P<0.05),对胸中、下段食管癌IGTV10未被IGTVCBCT包含比例和三维运动矢量成正相关性(r=0.540、0.678, P<0.05)。
|
|
表 3 34例食管癌患者不同大体肿瘤体积相互未包含比例的比较(%, x± s) Table 3 The comparison of excluded percentage of the gross tumor volume delineating on different CT images for 34 patients with esophageal cancer(%, x± s) |
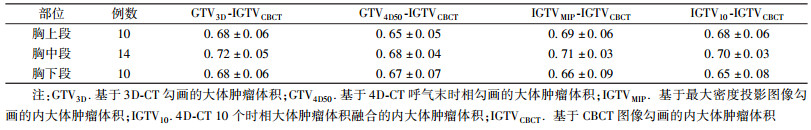
4.靶区匹配指数差异:结果见表 4。由表 4可看出,GTV3D、GTV4D50、IGTVMIP、IGTV10与IGTVCBCT的MI为0.65~0.72。胸上、中、下段食管癌IGTVMIP对IGTVCBCT的MI差异无统计学意义(P>0.05)。
|
|
表 4 34例食管癌患者不同CT图像勾画的大体肿瘤体积的相互匹配指数(x± s) Table 4 The MIs of the gross tumor volume delineating on different CT images for 34 patients with esophageal cancer(x± s) |
讨论
靶区确定是食管癌放射治疗的关键环节,食管自身蠕动、呼吸运动和心脏搏动等因素是食管癌放疗分次内靶区位移及放疗分次间的摆位引起的摆位误差的主要影响因素,尤以呼吸运动的影响最为明显[1]。因此为防止肿瘤脱靶,常规3D-CT定位时往往采用群体化外扩边界,这无疑增大了靶区范围。呼吸相关的4D-CT可准确反映肿瘤运动范围和空间位置变化规律[2],包含整个呼吸周期的运动信息,可构建理想的个体化IGTV或内靶区(ITV)[2, 5],但受呼吸模式影响较大,呼吸模式可能发生的改变使4D-CT构建的个体化内靶区受到质疑[8]。定位体位的靶区信息能否反映治疗体位的靶区信息亟待解决。CBCT作为在线校正成像工具,可反映治疗体位肿瘤运动情况。CBCT扫描时间约1 min,包含数个呼吸周期,得到的肿瘤靶区理应视为IGTV[4],但CBCT包含的呼吸运动信息究竟有多少,据其构建的靶区能否验证基于3D-CT及4D-CT构建的靶区在食管癌的放射治疗中鲜有报道,本研究通过比较基于不同CT图像勾画的靶区间呼吸运动信息的多少,探究基于CBCT图像勾画的靶区即IGTVCBCT能否包含全部的运动信息,如IGTVCBCT包含全部的运动信息,可否认为在CBCT图像上勾画的靶区为包含全部运动信息的ITV。因此,上述问题的解决使CBCT用于食管癌放疗靶区的验证起到明确的认识作用,并对能否将基于CBCT勾画的包含一定靶区运动信息的个体化IGTVCBCT映射到定位CT上制定放疗计划产生指导意义。靶区的精确勾画是增加靶区剂量,减少周围正常组织受量的关键环节,食管与周围组织的边界,如心血管系统因密度的相近在平扫CT上可能变得模糊,同时运动引起的伪影也会降低CT的分辨率,影响GVT的精确勾画,但本研究中增强CBCT图像扫描可以有效地解决上述不利因素的影响。研究显示,肺癌大体肿瘤体积在不同模态CT勾画时所包含的运动信息特征是不同的[9],但对于食管原发肿瘤尚未有类似的研究。本研究通过比较基于3D-CT、4D-CT和CBCT确定的靶区的体积、位置和包含关系差异,探讨不同模态CT包含的运动的信息的特征。
呼气末时相是呼吸运动中最稳定的时相,GTV4D50被认为最接近实际肿瘤大小[10-11],本研究结果显示,GTV4D50/IGTVCBCT与肿瘤三维矢量成负相关性,这表明IGTVCBCT体积变化随呼吸运动幅度的增加更明显。通过比较IGTVCBCT与GTV4D50大小更能真实反映CBCT包含的运动信息量,因此CBCT包含的呼吸运动信息明显多于呼吸末时相。临床实践中,GTV3D依据个体化或群体化外扩边界创建ITV时,其前提是GTV3D包含极少的呼吸运动信息。本研究显示,胸上、中、下段GTV3D/ GTV4D50分别为0.99±0.05、0.99±0.04和0.98±0.07,已有文献报道GTV3D/ GTV4D50也接近1[11-12],这与本研究所得结果基本一致,从而说明GTV3D与GTV4D50含有相似的运动信息。因此,可以认为CBCT包含的运动信息量也明显大于3D-CT。
基于3D-CT模拟定位扫描是目前我国常用的食管癌定位技术,放疗疗程中CBCT在线靶区校正已成为常态,随着图像引导放疗技术的进步,CBCT的图像分辨率也逐渐提高,在放疗过程中CBCT的进一步应用也逐渐被探讨,同时放疗疗程中需要对患者进行3D-CT的中间复位以明确患者的体位重复性及靶区修正的必要性。因此,本研究分析了3D-CT与CBCT所包含的运动信息的匹配关系,探讨能否利用CBCT代替3D-CT进行靶区计划的修正。理想的IGTV是由4D-CT 10个时相的GTV融合而成[13],包含整个呼吸周期中靶区的呼吸运动信息。本研究以IGTV10为标准靶区,结果显示虽然IGTV10未被IGTVCBCT包含比例与IGTV10未被GTV3D包含比例差异无统计学意义,但IGTVCBCT的误照明显大于GTV3D的误照,表明在放疗疗程中,3D-CT的中间复位是有必要的,不能用CBCT在线校正代替放疗过程中的中间复位。
利用放疗前拍摄的CBCT可以进行放疗靶区验证及摆位误差校正,还可以实时监测肿瘤的退缩情况,为疗程中患者的复位时机提供一个参考。放疗后的CBCT可传至计划系统,可进行内大体肿瘤体积的勾画,通过比较基于MIP和CBCT确定的靶区间体积、位置和包含关系分析各种CT包含的呼吸运动信息的特征,分析CBCT图像包含的靶区信息是否和MIP图像包含的靶区信息相似以及能否相互替代,从而为放疗疗程中患者的复位提供相关的参考。在4D-CT 10个时相勾画靶区工作量大,临床上有时用在MIP图像上勾画的靶区代替10个时相融合的靶区,在CBCT与MIP图像上勾画的靶区之间可以相互替代假设成立的前提下,在放疗复位时就可以直接用CBCT勾画靶区进行放疗过程中的计划的修正。从目前研究结果分析,IGTVCBCT与IGTVMIP的体积无差异,进一步分析胸上、中、下段间IGTVMIP/IGTVCBCT的差异也无统计学意义,且各胸段食管肿瘤IGTVMIP/IGTVCBCT与三维运动矢量无线性关系。可见肿瘤运动幅度变化并未影响IGTVMIP与IGTVCBCT的体积变化,换而言之,随着肿瘤运动幅度的变化,IGTVMIP与IGTVCBCT的变化趋势相同。结合以上结果,认为MIP与CBCT包含相似的运动信息量。针对两种图像能否相互代替的问题,分析了IGTV10和IGTVCBCT与IGTV10和IGTVMIP间未包含比例及匹配指数,本研究显示,IGTVMIP与IGTVCBCT的体积无明显差异,较低的MI值反映两靶区间存在明显空间错位。相关文献报道胸中、下段食管癌受除呼吸运动的影响[1],作为一含气管状肌性器官,心脏体积及位置变化及心脏对食管靶区的挤压和牵拉的影响不能忽视[14],两者均可引起靶区中心点位置的差异。本研究结果显示,无论在前后方向还是左右方向IGTVCBCT与IGTVMIP的靶区中心点位置都有一定的差异,可见IGTVCBCT与IGTVMIP的空间错位可能与靶区中心点位置差异相关。因此,IGTVCBCT与IGTVMIP各自所包含的靶区信息不能相互代替。这一结果也提示,利用4D-CT的MIP图像确定放疗靶区可能会导致严重的脱靶现象和部分正常组织受到不必要的照射。
多影像结合勾画食管癌原发肿瘤现已成为不能切除的食管癌患者精确放疗靶区确定的主导途径,在临床工作中4D-CT与CBCT已得到广泛应用,本研究表明,无论肿瘤位于哪段食管,IGTV10都明显大于IGTVCBCT的体积,且胸中段IGTV10/IGTVCBCT与三维运动矢量成正相关性,换而言之,随着肿瘤运动幅度的增加,IGTV10体积变化更明显。分析整合不同靶区位置和体积特征的包含关系具有更为重要的临床应用价值,如果以IGTV10作为标准靶区,以IGTVCBCT为治疗靶区,将平均有22.20%、22.14%和26.90%的IGTV10未包含在治疗靶区内。本研究同时显示,胸中、下段IGTVCBCT遗漏的运动信息随肿瘤运动幅度的增加而增多,这表明IGTV10包含的呼吸运动信息量明显大于IGTVCBCT。随着肿瘤的形状、体积大小及靶区中心位置的差异的增加均可引起匹配指数降低以及未被包含比例的升高,从而导致两靶区间的空间位置错位。对于胸上段食管虽与周围组织紧密相连,较少受呼吸与心脏搏动的影响,但食管蠕动造成的食管癌放疗分次间靶区位移值得注意[15],不同时间的CT扫描获得的影像可能会出现靶体积的变形及食管癌边界的判断的不统一性,可引起靶区间的空间错位。
造成不同模态CT上靶体积大小的差异及较低的匹配指数还有以下几点原因,首先,CBCT是一种容积成像,图像重建时涉及CT值的平均效应,代表靶区的平均位置[16],而4D-CT是在3D-CT基础上, 加入时间信息, 依据运动或形变器官投影数据重建后得到的影像[17],由于不同模态CT的成像特点不同,不除外引起食管靶区大小的差异及食管癌长度的差异。其次,定位与治疗体位时呼吸运动模式的不同对食管癌大体肿瘤形状及靶区位置也有一定影响,Clements等[16]发现正弦曲线的呼吸模式最能反映实际ITV,而在本研究中,所有CT图像的获得都是基于自由呼吸模式。另外,基于骨性标志的配准误差也会造成靶区间的位置差异[18],采用更加准确的软组织配准方式,可能是减小配准误差的有效方式[19]。
总之,基于本研究可以看出,CBCT影像包含运动信息量明显大于3D-CT和4D-CT呼气末时相影像,小于4D-CT 10个时相融合的呼吸运动信息量。CBCT与MIP影像包含相似的呼吸运动信息量,但两者所包含的靶区信息不能相互代替,在放疗疗程中不能够用CBCT代替3D-CT的中间复位。
利益冲突 本研究还接受山东省医学科学院科技计划项目青年基金(2015-51) 资助,本人与其他作者以及基金无任何利益冲突作者贡献声明 胡超月负责收集资料、整理数据、统计分析和论文的撰写;李建彬和王金之负责论文选题、设计和论文修改;王玮负责实验的具体操作、协助统计分析;李奉祥和郭延娈负责协助修改论文
| [1] | Hashimoto T, Shirato H, Kato M, et al. Real-time monitoring of a digestive tract marker to reduce adverse effects of moving organs at risk (OAR) in radiotherapy for thoracic and abdominal tumors[J]. Int J Radiat Oncol Biol Phys, 2005, 61 (5): 1559-1564. DOI:10.1016/j.ijrobp.2005.01.006. |
| [2] | Speight R, Sykes J, Lindsay R, et al. The evaluation of a deformable image registration segmentation technique for semi-automating internal target volume (ITV) production from 4D-CT images of lung stereotactic body radiotherapy (SBRT) patients[J]. Radiother Oncol, 2011, 98 (2): 277-283. DOI:10.1016/j.radonc.2010.12.007. |
| [3] |
李奉祥, 李建彬, 张英杰, 等. 四维影像在肿瘤放射治疗中的应用[J].
中华肿瘤杂志, 2011, 33 (10): 721-725. Li FX, Li JB, Zhang YJ, et al. The application of four-dimensional imaging in tumor radiotherapy[J]. Chin J Oncol, 2011, 33 (10): 721-725. DOI:10.3760/cma.j.issn.0253-3766.2011.10.001. |
| [4] | Wang Z, Wu QJ, Marks LB, et al. Cone-beam CT localization of internal target volumes for stereotactic body radiotherapy of lung lesions[J]. Int J Radiat Oncol Biol Phys, 2007, 69 (5): 1618-1624. DOI:10.1016/j.ijrobp.2007.08.030. |
| [5] | Wang W, Li J, Zhang Y, et al. Comparison of patient-specific internal gross tumor volume for radiation treatment of primary esophageal cancer based separately on three-dimensional and four-dimensional computed tomography images[J]. Dis Esophagus, 2014, 27 (4): 348-354. DOI:10.1111/dote.12089. |
| [6] | Vali FS, Nagda S, Hall W, et al. Comparison of standardized uptake value-based positron emission tomography and computed tomography target volumes in esophageal cancer patients undergoing radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2010, 78 (4): 1057-1063. DOI:10.1016/j.ijrobp.2009.09.022. |
| [7] | Muirhead R, McNee SG, Featherstone C, et al. Use of maximum intensity projections (MIPs) for target outlining in 4D-CT radiotherapy planning[J]. J Thorac Oncol, 2008, 3 (12): 1433-1438. DOI:10.1097/JTO.0b013e31818e5db7. |
| [8] | James SS, Mishra P, Hacker F, et al. Quantifying ITV instabilities arising from 4D-CT:a simulation study using patient data[J]. Phys Med Biol, 2012, 57 (5): L1-7. DOI:10.1088/0031-9155/57/5/L1. |
| [9] |
李奉祥, 李建彬, 邵倩, 等. 基于三种CT图像勾画的非小细胞肺癌靶体积比较研究[J].
中华放射肿瘤学杂志, 2013, 22 (4): 286-290. Li FX, Li JB, Shao Q, et al. A comparative study of target volumes based on three CT images in non-small cell lung cancer[J]. Chin J Radiat Oncol, 2013, 22 (4): 286-290. DOI:10.3760/cma.j.issn.1004-4221.2013.04.007. |
| [10] | George R, Chung TD, Vedam SS, et al. Audio-visual biofeedback for respiratory-gated radiotherapy:impact of audio instruction and audio-visual biofeedback on respiratory-gated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 65 (3): 924-933. DOI:10.1016/j.ijrobp.2006.02.035. |
| [11] | Persson GF, Nygaard DE, Munck ARP, et al. Artifacts in conventional computed tomography (CT) and free breathing four-dimensional CT induce uncertainty in gross tumor volume determination[J]. Int J Radiat Oncol Biol Phys, 2011, 80 (5): 1573-1580. DOI:10.1016/j.ijrobp.2010.10.036. |
| [12] | Li F, Li J, Zhang Y, et al. Geometrical differences in gross target volumes between 3D-CT and 4D-CT imaging in radiotherapy for non-small-cell lung cancer[J]. J Radiat Res, 2013, 54 (5): 950-956. DOI:10.1093/jrr/rrt017. |
| [13] | Ezhil M, Vedam S, Balter P, et al. Determination of patient-specific internal gross tumor volumes for lung cancer using four-dimensional computed tomography[J]. Radiat Oncol, 2009, 4 (1): 1-14. DOI:10.1186/1748-717X-4-4. |
| [14] | Wang W, Li J, Zhang Y, et al. Correlation of primary middle and distal esophageal cancers motion with surrounding tissues using four-dimensional computed tomography[J]. Oncol Targets Ther, 2016, 9 : 3705-3710. DOI:10.2147/OTT.S100460. |
| [15] | Yamashita H, Haga A, Hayakawa Y, et al. Patient setup error and day-to-day esophageal motion error analyzed by cone-beam computed tomography in radiation therapy[J]. Acta Oncol, 2010, 49 (4): 485-490. DOI:10.3109/02841861003652574. |
| [16] | Clements N, Kron T, Franich R, et al. The effect of irregular breathing patterns on internal target volumes in four-dimensional CT and cone-beam CT images in the context of stereotactic lung radiotherapy[J]. Med Phys, 2013, 40 (2): 021904 DOI:10.1118/1.4773310. |
| [17] | Li G, Citrin D, Camphausen K, et al. Advances in 4D medical imaging and 4D radiation therapy[J]. Technol Cancer Res Treat, 2008, 7 (1): 67-81. DOI:10.1177/153303460800700109. |
| [18] | Yeung AR, Li JG, Shi W, et al. Tumor localization using cone-beam CT reduces setup margins in conventionally fractionated radiotherapy for lung tumors[J]. Int J Radiat Oncol Biol Phys, 2009, 74 (4): 1100-1107. DOI:10.1016/j.ijrobp.2008.09.048. |
| [19] | Boswell S, Tomé W, Jeraj R, et al. Automatic registration of megavoltage to kilovoltage CT images in helical tomotherapy:an evaluation of the setup verification process for the special case of a rigid head phantom[J]. Med Phys, 2006, 33 (11): 4395-4404. DOI:10.1118/1.2349698. |
 2017, Vol. 37
2017, Vol. 37