乳腺癌是女性常见恶性肿瘤,该肿瘤的转移是患者死亡的主要原因之一[1]。早期乳腺癌采取保守治疗,15年间发生远处转移率为16.5%[2],而发生远处转移的主要途径是淋巴结转移,并且有研究表明,淋巴结转移是肿瘤患者预后危险的独立因素[3]。研究肿瘤生长和转移的传统方法是分不同时间段处死荷瘤动物,观察病理切片。近年来,表达于萤火虫体内的荧光素酶基因,因为其具有成像时间短、无毒、信噪比高等优点被广泛应用于荧光成像来检测活体动物体内的肿瘤生长、转移。荧光成像原理是采用荧光素酶(luciferase)基因标记DNA或者细胞,然后利用高灵敏的光学检测仪器,直接检测活体生物体内基因行为以及细胞活动[4]。本研究利用荧光素酶标记的小鼠乳腺癌细胞4T1-Luc建立爪垫皮下淋巴结转移模型,利用活体荧光成像系统无创实时监测荷瘤小鼠的乳腺癌肿瘤生长转移情况,并在可视化条件下评估X射线立体定向放射治疗肿瘤的效果。
材料与方法1.细胞、试剂和仪器:荧光素酶标记的小鼠乳腺癌细胞系4T1-Luc购自上海奥陆生物科技有限公司。RPMI 1640(美国GIBCO公司)、0.25%胰蛋白酶-0.02%EDTA(美国Hyclone公司)、青霉素-链霉素双抗(美国Hyclone公司)、胎牛血清(美国GIBCO公司)、D-Luciferin Potassium Salt(美国Goldbio公司)、配有Living Image 4.0图像分析软件的活体荧光成像系统(美国Caliper公司)、小动物立体定向放射治疗仪(美国Precision X-ray公司,技术参数:准直器5 mm,源皮距30.6 cm,剂量率2.6 Gy/min, 能量0.225 MeV)。
2.实验动物:BALB/c裸鼠购自南京斯科瑞生物科技有限公司,动物许可证号:SCXK(苏)2011-0003,鼠龄5~6周,体重约18 g,15只,在本实验室无特定病原体(SPF)的小鼠间饲养。
3.细胞培养:荧光素酶标记的小鼠乳腺癌细胞系4T1-Luc采用含10%胎牛血清的RPMI 1640培养基,37℃、5%CO2饱和湿度培养。
4.体外生物发光成像:处于生长对数期的4T1-Luc细胞用胰酶消化,计数并调整细胞数为1×105/ml。取96孔板,分为12组,每组设3个复孔, 吸取混合均匀的细胞400 μl,倍比稀释到第10组,每个孔的细胞数减半,最后两组中一个仅加入底物luciferin作为阴性对照组,另一个仅加入细胞(400 μl)作为空白对照组,然后在前10组中分别加入底物luciferin,终浓度为150 μg/ml,静置3 min后,在活体荧光成像系统上检测荧光光子数,分析荧光光子数与细胞数之间的相关性。
5.构建小鼠乳腺癌淋巴转移模型:收集处于对数生长期的4T1-Luc细胞,用磷酸盐缓冲液(PBS)洗1次,PBS稀释至1×106/ml,取0.04 ml(4×104)细胞悬液注射于BALB/c裸鼠单侧后肢爪垫皮下,左右后肢皆可,制作小鼠乳腺癌爪垫皮下淋巴转移模型,共接种15只。
6.动物观察及活体生物发光成像:裸鼠爪垫接种肿瘤细胞后,每天定期观察裸鼠的活动、进食、全身状况、爪垫肿瘤的生长以及腘窝等淋巴结的肿大转移情况。按随机数字表法选择3只荷瘤裸鼠,从接种肿瘤的第6天开始,每间隔6 d测量移植瘤长短直径,直至第24天,按公式V=1/2长径×短径2,计算肿瘤体积,绘制爪垫肿瘤的生长曲线;同时使用小动物活体荧光成像系统,检测裸鼠的爪垫移植瘤和腘窝淋巴结中荧光素酶的生物发光信号,检测前15 min裸鼠腹腔注射底物luciferin(30 mg/ml)100 μl,并定量分析各时间点爪垫移植瘤的荧光光子数,绘制原发灶肿瘤的荧光光子数随时间变化曲线。
7. X射线立体定向放射治疗:选取在接种肿瘤细胞的第6天能触摸到荷瘤裸鼠腘窝淋巴结肿大并能监测到此处有生物发光信号的裸鼠10只,按随机数字表法将荷瘤裸鼠分为2组,每组5只,分别为对照组和治疗组。对照组不做处理;治疗组用小动物立体定向放射治疗仪进行X射线立体定向治疗时,先进行3个截面图的定位,精确确定治疗部位,为减少正常组织损伤,每次照射时从上下两面进行照射,对爪垫移植瘤和腘窝淋巴结每次分别给予X射线5、3 Gy照射,每隔1天照射1次,共4次,总剂量分别为20、12 Gy。
8.疗效评价:从治疗开始,每间隔6 d,使用小动物活体荧光成像系统检测裸鼠体内荧光素酶的生物发光信号,检测前15 min裸鼠腹腔注射底物luciferin(30 mg/ml)100 μl。用第24天的足垫处肿瘤及腘窝处肿瘤部位的荧光光子数计算肿瘤抑制率,肿瘤抑瘤率(%)=(1-治疗组平均荧光光子数/对照组平均荧光光子数)×100%。接种第24天,光学检测后,对照组和治疗组裸鼠脱颈椎处死,无菌条件下解剖取原发灶肿瘤及腘窝淋巴结和发生侵袭及转移的脏器组织,标本用10%中性甲醛溶液固定,HE染色,光镜观察评价对照组和治疗组肿瘤细胞情况。
9.统计学处理:计量资料采用x± s表示。采用SPSS 19.0软件进行分析。两组间比较确定样本符合正态分布,采用独立样本t检验。P < 0.05为差异有统计学意义。
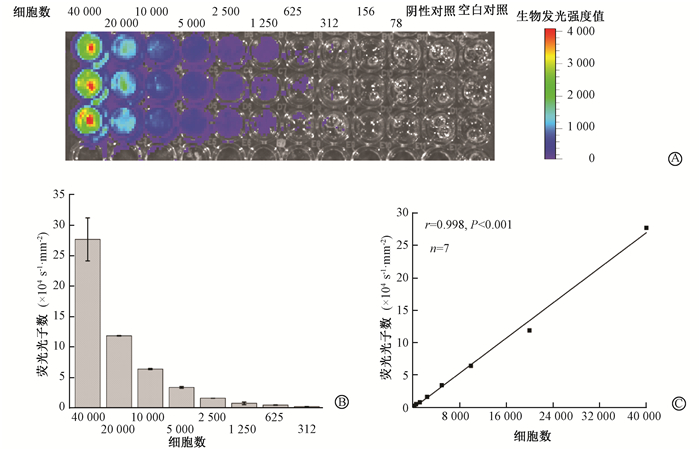
结果1.体外生物发光强度检测:结果显示,体外活体细胞检测最少细胞数为312(图 1A,1B),而且随着细胞的增加,荧光光子数和细胞数量呈正相关(r=0.998,P < 0.001),线性方程为y =6.792x-2 164,见图 1C。
|
图 1 体外培养4T1-luc活细胞的生物发光成像A.体外生物发光成像;B.荧光光子数分析;C.荧光光子数与细胞数的相关性分析 Figure 1 Bioluminescence imaging of 4T1-luc cells in vitro A. Bioluminescence imaging in vitro; B. The relationship of fluorescence photon number and cell number; C. Correlation analysis of fluorescence photon number and cell number |
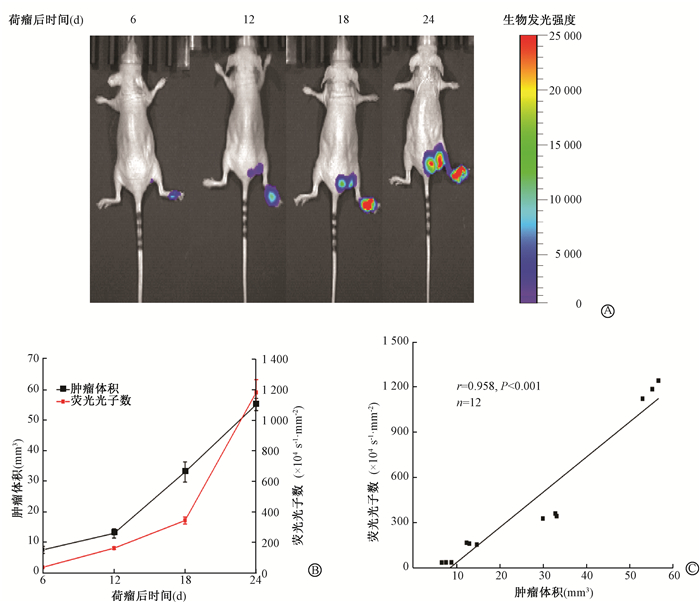
2.肿瘤的生长与转移:裸鼠爪垫接种瘤细胞后,活动如常,无死亡及并发症,所有接种的肿瘤细胞在裸鼠爪垫注射部位全部成瘤。在爪垫接种瘤细胞后分别于第6、12、18、24天测量肿瘤体积大小和裸鼠体内生物发光信号。移植瘤体积随接种时间延长而逐渐增大,爪垫肿瘤的荧光光子数随接种时间延长也逐渐增大,移植瘤体积与荧光光子数成正相关(r=0.958, P < 0.001), 线性方程为y=(2.28x-20)×105,见图 2。
|
图 2 小鼠乳腺癌肿瘤淋巴结转移的动态生物发光成像A.爪垫肿瘤生长和肿瘤淋巴结转移的生物发光成像;B.爪垫移植瘤肿瘤体积生长与荧光光子数的动态变化;C.肿瘤体积与荧光光子数的相关性分析 Figure 2 Dynamic bioluminescence imaging of lymph node metastasis of mouse breast cancer cells A. Bioluminescence imaging of tumor growth and lymph node metastasis in paw pads; B. Dynamic changes of tumor volume and fluorescence photon number of tumor in paw pads; C. Correlation analysis between tumor volume and fluorescence photon number |
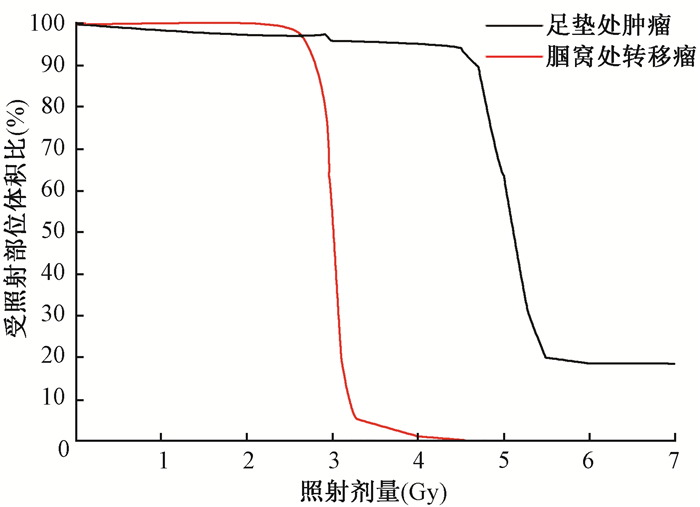
3.立体定向放射治疗剂量分析:经计算机模拟计算,每次5 Gy照射爪垫移植瘤部位95%以上受到了4.5~4.7 Gy照射;每次3 Gy照射腘窝淋巴结处转移肿瘤部位时,98%受到了2.6~2.8 Gy剂量照射,见图 3。
|
图 3 X射线照射小鼠乳腺癌肿瘤的剂量-体积直方图 Figure 3 Histogram of X-ray irradiation dose and the irradiated volume of breast cancer tumor in paw pad and popliteal fossa of mice, respectively |
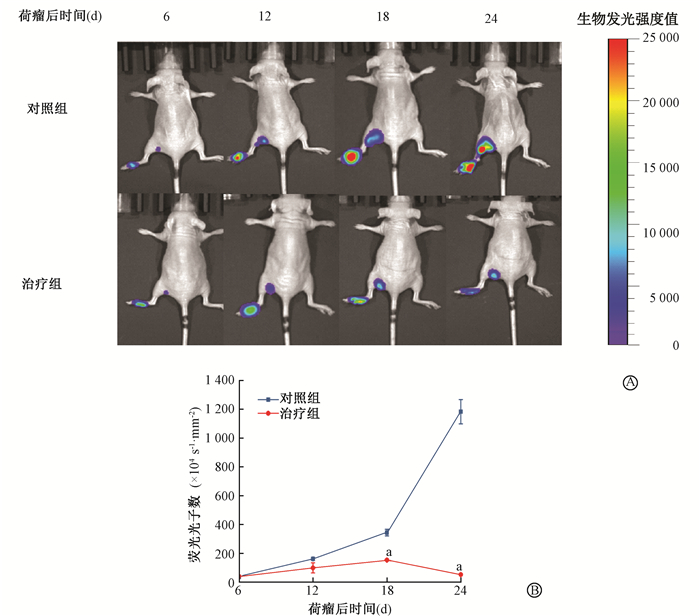
4.荧光成像系统对X射线放射治疗前后肿瘤生长转移情况的检测:通过活体成像系统观察肿瘤生长转移情况发现,裸鼠接种肿瘤细胞第6天在腘窝处有生物发光信号,两组移植瘤发光强度均较大。治疗组用小动物立体定向放射治疗仪局部立体定向精准治疗。在肿瘤接种的第12天成像监测结果表明,对照组和治疗组肿瘤细胞荧光光子数的差异无统计学意义(P>0.05), 但对照组和治疗组肿瘤荧光光子数都较第6天时明显变大。在肿瘤接种的第18天成像监测结果表明,治疗组爪垫肿瘤和腘窝处肿瘤的荧光光子数都较对照组明显降低(t=19.43,P < 0.05)。在肿瘤接种的第24天,治疗组爪垫肿瘤和腘窝处肿瘤的荧光光子数较对照组呈显著性降低(t=32.58,P < 0.05),移植瘤及腘窝处的肿瘤抑制率分别为93%和86%,见图 4。
|
图 4 荧光成像系统对X射线照射前后小鼠乳腺癌肿瘤生长转移情况动态的检测A.对照组和治疗组爪垫肿瘤生长和肿瘤淋巴结转移的生物发光成像;B.对照组和治疗组爪垫移植瘤肿瘤荧光光子数的动态变化 注:a与对照组比较,t=19.43、32.58,P < 0.05 Figure 4 Fluorescence images of breast cancer tumor and metastasis in mice before and after radiotherapy by system A. Bioluminescence imaging of tumor growth and lymph node metastasis in the control group and the radiation group; B. Dynamic changes of fluorescence photon number in the tumor of the control group and the radiation group |
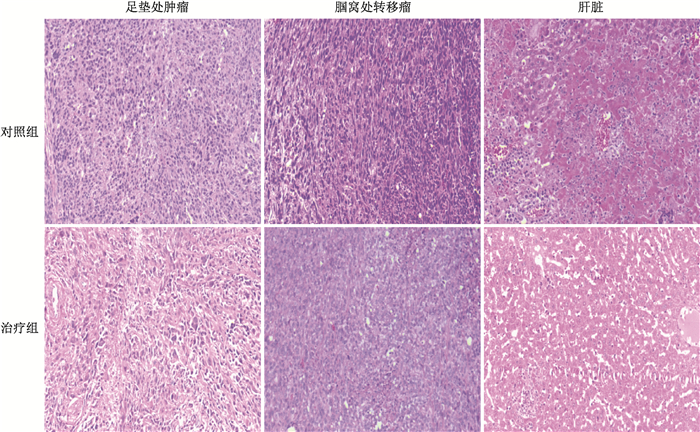
5.足垫处肿瘤腘窝处转移瘤病理学检测:对照组癌细胞呈片状分布,细胞生长旺盛,细胞核浓染,癌细胞几乎不见坏死,肝脏部位有肿瘤细胞转移灶,转移瘤细胞排列紧密、核大深染、核膜清晰、核仁明显,分裂相多见,病理组织学诊断为浸润性癌巢;治疗组爪垫移植瘤和腘窝淋巴结处肿瘤组织内存在一些异常的肿瘤细胞,这些细胞呈小的巢状分布于正常的肿瘤细胞之间,细胞核深染、固缩、坏死,坏死的肿瘤细胞较对照组明显增多,肝脏部位未见肿瘤细胞转移灶,见图 5。
|
图 5 对照组与治疗组裸鼠的足垫处肿瘤、腘窝处转移瘤、肝脏的病理组织学观察HE染色×400 Figure 5 The histopathological tissue images of breast cancer tumor in paw pad, popliteal fossa metastases and normal liver in control group and radiation group HE staining ×400 |
讨论
相比较于其他活体动物体内的成像技术,如磁共振(MRI)、CT、超声、单光子发射计算体层摄影(SPECT)、正电子发射断层摄影(PET)等技术,光学成像有很多独特优点:灵敏度高、费用低廉、结果直观、测量快速、操作简便等[5]。自Chalfie等[6]首次报道了绿色荧光蛋白基因在大肠杆菌中成功表达,荧光报告基因被迅速地应用在肿瘤研究中。闫明霞等[7]用GFP/Luc双标记的人源肝癌细胞成功建立了肝癌原位移植瘤模型,利用小动物活体成像技术可以实时动态地观察原位肝癌生长、肺转移和腹水形成等生物学特性。Jenkins等[8]将荧光素酶标记的人乳腺癌细胞MDA-MB-231/Luc接种到裸鼠乳腺脂肪垫或者注射到左心室,建立了自发性或实验性转移的模型,利用生物发光成像可以灵敏地观测到裸鼠体内原发部位和继发转移部位的肿瘤生长转移情况,对骨转移灶的形成以及增殖进行了研究。Hsieh等[9]用转基因小鼠体内特异性表达荧光素酶的前列腺癌细胞,实时无创动态监测前列腺癌转移特性,尤其是骨转移的特性。来源于萤火虫的荧光素酶基因经人工分离并被克隆到载体上,转染到细胞后表达的荧光素酶,在ATP、氧和底物luciferin存在的情况下,可催化底物luciferin的氧化反应,产生生物发光的现象。生物发光成像具有安全、准确、实时的特点,为研究肿瘤的发生、发展过程以及抗肿瘤药效研究提供了科学准确的依据。
治疗乳腺癌失败的原因就在于肿瘤的复发、转移,而转移是乳腺癌患者主要的致死原因。其中,淋巴结转移又是早期十分常见的转移方式[3]。因此,用新的技术手段确定前哨淋巴结的位置节点,并消除淋巴结转移癌细胞节点,以防止进一步的癌症转移,这是早期癌转移的首要目标。本研究利用裸鼠爪垫具有丰富的淋巴管以及单向淋巴转移途径的特点,采用荧光素酶标记的小鼠乳腺癌细胞4T1-Luc接种在裸鼠爪垫皮下,建立乳腺癌淋巴结转移模型,用活体荧光成像技术检测肿瘤早期淋巴结转移。临床上对肿瘤的治疗除手术外,广泛应用放疗,而立体定向放疗(SBRT)是一种在现代精确影像引导技术下给予局部肿瘤以高剂量、低分割的放射治疗,能够获得90%左右的肿瘤局部控制率[10]。它通过准确定位对病灶进行的非共面多弧立体定向照射,使病灶得到高剂量照射[11],因此,病灶周围的正常组织所受到的剂量甚微, 进而达到摧毁病变组织而正常组织不受损伤的目的。在X射线治疗的过程中,肿瘤越小疗效越好; 而肿瘤越大, 为避免正常组织受到损伤,X射线治疗剂量受到限制, 疗效会比较差[12]。以往有文献报道BALB/c小鼠的放射治疗剂量为7.5或8.0 Gy[13]。因此,在本研究中利用小动物立体定向放射治疗仪,对足垫移植瘤和早期肿瘤淋巴结转移节点腘窝淋巴结每次分别给予X射线5、3 Gy照射,每隔1天照射1次,共4次,总剂量分别为20、12 Gy,以达到高剂量低分割的X射线立体定向放射治疗来阻止肿瘤的进一步转移,并使肿瘤周围正常组织免受损伤。
本研究中,体外试验结果证明荧光素酶标记的细胞内荧光光子数与其细胞数成正比,具有很好的相关性。早期用荧光素酶体内研究发现了肿瘤体积和移植瘤细胞数成正比[14]。Diehn等[15]建立皮下肿瘤模型,详细地研究了表达绿色荧光蛋白的肿瘤荧光强度与肿瘤体积的关系,发现肿瘤的GFP荧光强度与肿瘤体积成很好的线性关系。本研究中,将荧光素酶标记的小鼠乳腺癌细胞系4T1-Luc接种在裸鼠爪垫皮下建立淋巴转移模型,利用活体荧光成像系统观察,发现接种部位能够成瘤,并能够通过淋巴结进行转移,肿瘤体积与荧光光子数呈显著地正相关性,结果与Diehn等[15]一致。由于肿瘤坏死部分不能分泌荧光蛋白,所以荧光光子数是有功能活细胞的荧光值,并且荧光光子数测量非常方便。因此,可以利用荧光光子数代替肿瘤体积绘制肿瘤的生长曲线,分析评价肿瘤生长及转移情况。裸鼠在肿瘤细胞接种后的第6天, 采用活体荧光成像技术就能观察到转移到腘窝淋巴结处的肿瘤,而此时肉眼并不能观察到,说明荧光成像技术具有灵敏度高的特点, 能够及早发现肿瘤。小动物活体荧光成像系统可直接观察荧光素酶标记的小鼠乳腺癌细胞系形成的肿瘤生长及转移,并能定量判断立体定向放射治疗效果。放射治疗第18天,爪垫移植瘤和腘窝处肿瘤的肿瘤抑制率达85%以上,与病理切片结果一致。
综上所述,本研究通过建立化学发光肿瘤模型和运用小动物活体荧光成像技术,客观、动态、灵敏、可视化地评估了X射线对裸鼠爪垫皮下肿瘤及其淋巴结转移灶的治疗效果,初步探索出一种新的评价肿瘤细胞淋巴结转移和治疗效果的影像学评估方法,并为抗肿瘤转移药物的研究提供了良好的实验平台。
利益冲突 本人与其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的科学性和独立性予以保证作者贡献声明 郭萍设计研究方案、进行实验并起草论文;文玲、朱然、曾剑峰协助设计研究方案;李林林、邱珊珊协助进行实验;张友九指导实验并修改论文
| [1] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12): 2893-2917. DOI:10.1002/ijc.25516. |
| [2] | Bavelloni A, Piazzi M, Raffini M, et al. Prohibitin 2:At a communications crossroads[J]. IUBMB Life, 2015, 67 (4): 239-254. DOI:10.1002/iub.1366. |
| [3] | Gomes CM, Welling M, Que I, et al. Functional imaging of multidrug resistance in an orthotopic model of osteosarcoma using 99mTc-sestamibi[J]. Eur J Nucl Med Mol Imaging, 2007, 34 (11): 1793-1803. DOI:10.1007/s00259-007-0480-8. |
| [4] | Contag PR, Olomu IN, Stevenson DK, et al. Bioluminescent indicators in living mammals[J]. Nat Med, 1998, 4 (2): 245-247. DOI:10.1038/nm0298-245. |
| [5] | Ntziachristos V, Ripoll J, Wang LV, et al. Looking and listening to light:the evolution of whole-body photonic imaging[J]. Nat Biotechnol, 2005, 23 (3): 313-320. DOI:10.1038/nbt1074. |
| [6] | Chalfie M, Tu Y, Euskirchen G, et al. Green fluorescent protein as a marker for gene expression[J]. Science, 1994, 263 (5148): 802-805. DOI:10.1126/science.8303295. |
| [7] |
闫明霞, 刘蕾, 朱淼鑫, 等. 人肝癌原位移植瘤的活体动态观察[J].
实验动物与比较医学, 2010, 30 (6): 401-405. Yan MX, Liu L, Zhu MX, et al. Dynamic observation of in vivo bioluminescence imaging of orthotopic implantation of human hepatocellular carcinoma in nude mice[J]. Lab Anim Comp Med, 2010, 30 (6): 401-405. DOI:10.3969/j.issn.1674-5817.2010.06.002. |
| [8] | Jenkins DE, Hornig YS, Oei Y, et al. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice[J]. Breast Cancer Res, 2005, 7 (4): R444-454. DOI:10.1186/bcr1026. |
| [9] | Hsieh CL, Xie Z, Yu J, et al. Non-invasive bioluminescent detection of prostate cancer growth and metastasis in a bigenic transgenic mouse model[J]. Prostate, 2007, 67 (7): 685-691. DOI:10.1002/pros.20510. |
| [10] |
孙冰, 张玉蛟. 放射外科在MD安德森肿瘤中心的实践及进展[J].
中华放射医学与防护杂志, 2016, 36 (10): 721-727. Sun B, Zhang YJ. Practice and progress of stereotactic ablative radiotherapy in MD Anderson Cancer Center[J]. Chin J Radiol Med Prot, 2016, 36 (10): 721-727. DOI:10.3760/cma.j.issn.0254-5098.2016.10.001. |
| [11] | Anderson RE, Tokuda S, Williams WL, et al. Low dose irradiation permits immunization of A/J mice with subimmunogenic numbers of SaI cells[J]. Br J Cancer, 1986, 54 (3): 505-509. DOI:10.1038/bjc.1986.204. |
| [12] |
王宗烨, 戴卓捷, 马慧珍, 等. 立体定向放射治疗在结直肠癌肝转移中的临床应用[J].
中华放射医学与防护杂志, 2013, 33 (6): 626-629. Wang ZY, Dai ZJ, Ma HZ, et al. Clinical application of stereotactic body radiation therapy for colorectal cancer with liver metastases[J]. Chin J Radiol Med Prot, 2013, 33 (6): 626-629. DOI:10.3760/cma.j.issn.0254-5098.2013.06.014. |
| [13] |
朱柏贵, 杨岚, 田琼, 等. 血小板第4因子对急性照射小鼠造血保护作用的实验研究[J].
中华血液学杂志, 2000, 21 (6): 327 Zhu BG, Yang L, Tian Q, et al. Experimental study on the protective effect of platelet factor fourth on hematopoiesis in mice[J]. Chin J Hematol, 2000, 21 (6): 327 DOI:10.3760/j.issn.0253-2727.2000.06.018. |
| [14] | Sweeney TJ, Mailänder V, Tucker AA, et al. Visualizing the kinetics of tumor-cell clearance in living animals[J]. Proc Natl Acad Sci USA, 1999, 96 (21): 12044-12049. DOI:10.1073/pnas.96.21.12044. |
| [15] | Diehn FE, Costouros NG, Miller MS, et al. Noninvasive fluorescent imaging reliably estimates biomass in vivo[J]. Biotechniques, 2002, 33 (6) 1250-1252, 1254-1255 |
 2017, Vol. 37
2017, Vol. 37


