随着放射治疗技术的不断发展,放射治疗在宫颈癌治疗中的地位越来越重要[1-2]。有关如何提高靶区剂量,同时降低直肠、膀胱以及小肠受照剂量的研究多有发表[3-4],但常常忽略了宫颈癌术后放射治疗中骨髓的受照剂量。Mell等[5]研究表明,骨髓在放疗中的受照剂量与血液不良反应有关,骨髓受照剂量的增加会导致急性骨髓抑制发生率增高。因此,如何在不影响靶区与其他危及器官的前提下有效地减少骨髓的受照剂量,成为急需解决的重要课题。本研究在传统调强计划的基础上结合非共面技术,从剂量学上探讨非共面调强计划应用于宫颈癌术后放射治疗时剂量学上的优势。
一、 资料与方法1.病例选择:选择2016年4月至2016年7月在四川省肿瘤医院实施放射治疗的宫颈癌术后患者17例。病理类型全部为鳞癌,根据国际妇产科联盟 (FIGO) 分期标准[6],其中ⅡA期5例,ⅡB期12例,年龄40~70岁,中位年龄47岁。所有患者均无放疗禁忌证。
2.方法:患者采用仰卧位,双手抱肘置于额头,体部热塑膜固定体位。采用荷兰飞利浦公司的16排V Brilliance TM CT BigBore4型CT机,获得宫颈癌术后患者的CT图像数据。扫描层厚为3 mm,扫描范围自胸10至坐骨结节下5 cm,并将患者CT数据传送至美国Varian公司的Eclipse 11.0放射治疗计划系统进行靶区勾画以及计划设计。直线加速器采用Varian 23EX (8 MV X射线)。
3.靶区及危及器官的勾画:宫颈癌术后临床靶区体积 (CTV) 包括盆腔淋巴引流区 (CTVln)、阴道上段1/2(CTV1) 和阴道残端 (CTV2)。危及器官 (OAR) 包括直肠、膀胱、小肠、骨髓以及双侧股骨头。膀胱为充盈状态下的全部膀胱,直肠上界为直肠乙状结肠交界处,下界为肛缘,骨髓包括骶骨和髂骨。
4.计划设计及评估:调强计划 (IMRT) 和非共面调强计划 (NC-IMRT) 具体设计如下:两种照射方式中靶区 (CTVln、CTV1以及CVT2) 的临床处方剂量均为45 Gy,25次,要求95%的靶区接受100%的处方剂量。调强计划按照常规宫颈癌术后放疗的布野方式,共设7野,照射野的入射角度分别为179°、129°、65°、27°、333°、290°和231°。非共面调强计划的射野角度同样为179°、129°、65°、27°、333°、290°和231°。考虑到非共面技术的实际实施情况,非共面射野选取65°、27°、333°和290°,并且65°和290°转床角度范围为0°~20°,27°和333°转床角度范围为0°~50°,把上述中可能的射野角度与转床角度组合设计计划,比较各个组合得到的剂量学参数优劣,最后确定射野在65°、27°、333°和290°时分别将治疗床旋转20°、50°、20°和350°形成4个非共面野,见表 1。为了直接比较两种照射方式计划结果的优劣,两种照射方式在放疗计划系统上优化时采用同样的优化参数,并且将优化结果中剂量最低的靶区的D95归一到45 Gy。对于临床靶区,将比较平均剂量Dmean、95%临床靶区所对应的剂量D95、均匀性指数 (HI)[7-8]、适形指数 (CI)[8-9];其中HI为1%靶区体积所对应的剂量与处方剂量的比值;CI为处方剂量包裹的体积与靶区的体积的比值。危及器官比较:直肠,V35、V40和Dmean;膀胱,V35、V40和Dmean;小肠,V20、V25、V30和Dmean;髂骨和骶骨组成的骨髓,V35和Dmean;两侧股骨头,V10、V15、V20、V25、V30、V35和Dmean。除此之外, 还比较了两种照射方式的机器跳数。以上参数中,Dn为n%靶区或者危及器官体积受到的剂量值,Vm为mGy剂量所包裹的靶区或者危及器官的体积 (%)。
|
|
表 1 两种计划射野和床板的设置 (°) Table 1 Gantry and table positions between two plans (°) |
5.统计学处理:数据以x±s表示,采用SPSS 23.0软件对调强计划和非共面调强计划的剂量学参数进行配对t检验分析。P < 0.05为差异有统计学意义。
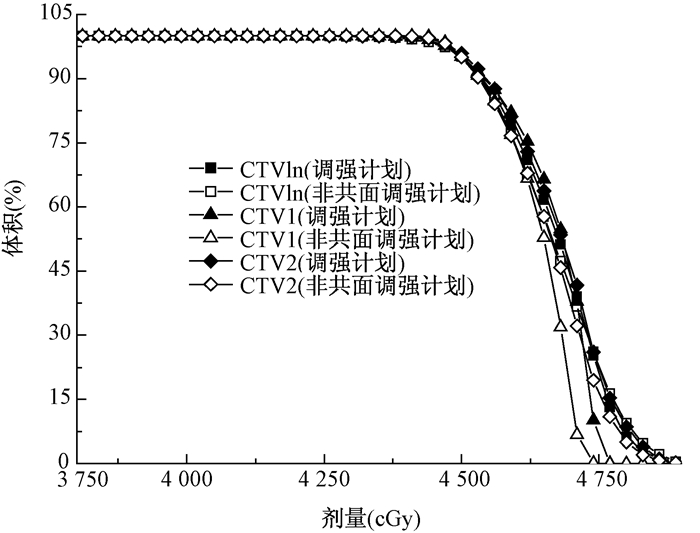
二、 结果1.靶区的剂量学比较:17例宫颈癌术后患者CTVln平均体积676 cm3、CTV1的平均体积29 cm3,CTV2的平均体积为155 cm3。在IMRT和NC-IMRT两种治疗方式下,比较了CTVln、CTV1和CTV2 3个靶区的平均剂量Dmean、95%靶区体积所对应的剂量D95以及两个用于描述靶区剂量均匀度和适形度的HI和CI,具体靶区参数见表 2。通过以上靶区的剂量学参数可以得到,NC-IMRT的CTV2的平均剂量低于IMRT中的值,而其他剂量学参数均没有明显差异。图 1为CTVln、CTV1以及CTV2在IMRT和NC-IMRT中的剂量-体积直方图 (DVH),从图 1同样可以看出两种照射方式不会对靶区的剂量参数产生太大影响。
|
|
表 2 调强计划与非共面调强计划靶区参数的比较 Table 2 The comparison for the parameters of the targets between IMRT and NC-IMRT |
|
图 1 调强计划与非共面调强计划靶区比较 Figure 1 The comparison for targets between IMRT and NC-IMRT |
2.危及器官的受照剂量比较:比较了IMRT和NC-IMRT两种照射方式中膀胱、小肠以及直肠等危及器官的受照剂量,见表 3。通过表 3可以得到,NC-IMRT照射方式减少了膀胱的受照剂量,例如膀胱的V35比IMRT获得的V35减少了2.7%,V40减少了1.3%,平均剂量减少了1.0%;对于小肠,NC-IMRT提高了小肠的受照剂量,但受照剂量的变化差异没有统计学意义 (P > 0.05);NC-IMRT对于直肠V35、V40以及Dmean等值有所降低。
|
|
表 3 调强计划与非共面调强计划重要危及器官的受照剂量比较 Table 3 The comparison for organ at risk irradiation dose between IMRT and NC-IMRT |
NC-IMRT照射方式在保护左右侧股骨头具有优势,特别是左侧股骨头的V10、V15、V20、V25、V30、V35和Dmean远小于IMRT中的值,见表 4。
|
|
表 4 调强计划与非共面调强计划骨髓和两侧股骨头的受照剂量比较 (%) Table 4 The comparison for bone, left femoral head and right femoral head irradiation dose between IMRT and NC-IMRT (%) |
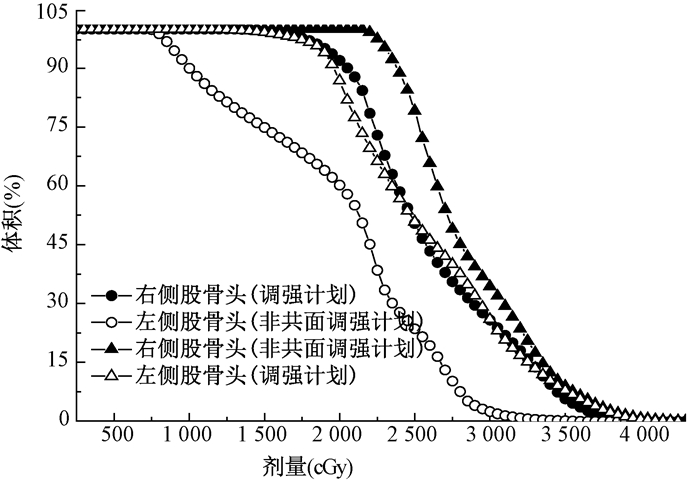
选取了1例病例在NC-IMRT和IMRT中两侧股骨头DVH图的比较,NC-IMRT可以很好地降低两侧股骨头的剂量,见图 2。
|
图 2 调强计划与非共面调强计划两侧股骨头的比较 Figure 2 The comparison of left femoral head and right femoral head between IMRT and NC-IMRT |
17例病例在IMRT和NC-IMRT中两侧股骨头的平均剂量进行比较。NC-IMRT得到的两侧股骨头的平均剂量均小于IMRT的平均剂量。NC-IMRT得到的左侧股骨头的平均剂量值远低于IMRT中的值,其中平均剂量的最大差异为26.8%,最大差异值为6.8 Gy。NC-IMRT中右侧股骨头的平均剂量同样均小于IMRT中的值,其减少量没有左侧股骨头值明显,最大减少量为3.1 Gy,最大减少比例为15.5%。
3.机器跳数比较:IMRT和NC-IMRT的平均机器跳数分别为1 348±83和1 368±67(P > 0.05),非共面调强技术没有明显增加机器跳数。
三、 讨论同步放化疗已成为宫颈癌术后患者的标准治疗方案,随着疗效的提高,与其相对应的骨髓并发症的发生率也在提高,特别是3级及以上的急性血液不良反应,常导致治疗中止,影响放疗疗效,甚至危及患者生命。因此,在宫颈癌术后患者的同步放疗中急需解决的问题就是如何减少骨髓的受照剂量,减少血液的不良反应,保证放疗的顺利进行。
骨髓跟直肠、膀胱一样是并联器官,在放疗过程中,可以通过降低其照射的剂量体积减轻该器官的放疗并发症,保证放疗能够正常进行[9-13]。Klopp等[10]对宫颈癌术后患者进行同步放化疗,并且在调强计划设计时着重保护了骨髓的受照剂量,骨髓V10的平均值为88%,V20平均值74.3%。本研究中患者的4级血液不良反应与RTOG 9708相比,由原来的13%降到了0。Rose等[11]研究表明,白细胞的减少与骨髓的V10和V20有关,当骨髓的V10 > 95%、V20 > 76%时,患者发生3级以上的血液不良反应的概率会增加。Albuquerque等[12]和Ahamad等[13]同样给出了骨髓的V20与血液不良反应显著相关,减少骨髓剂量体积有助于减少骨髓的不良反应,当骨髓V20 > 80%时,中重度造血系统不良反应的危险度为4.5,当V20 > 75%时,发生2级以上血液不良反应显著增加。
非共面技术在肿瘤的放射治疗中已有广泛的应用[14-18]。Bedford等[14]指出,在前列腺癌的放射治疗中,使用非共面技术可以很大程度上减少直肠的受照剂量,共面技术中直肠的V60为 (41.5±10.4)%,而非共面技术得到的直肠V60为 (35.2±9.3)%。Chapet等[15]在肺癌的调强放射治疗中应用非共面技术可以有效地减少心脏和肺的受照剂量,对于心脏的V30非共面技术可以减少17.6%,V40减少9.1%,V50减少5.7%。除此之外,非共面技术同样在头颈部肿瘤的放疗中表现出了剂量学上的优势。Krayenbuehl等[16]使用非共面技术成功地减少了腮腺平均剂量2.9 Gy,喉平均剂量减少6.9 Gy,宫腔黏膜平均剂量减少了2.4 Gy。本研究选择宫颈癌术后患者作为研究对象,使用非共面技术优化剂量分布,通过减少两侧股骨头的受照剂量来实现降低骨髓剂量的目的。
本研究中,通过剂量学参数可以明显看出非共面技术可以减少两侧股骨头、骶骨和髂骨的受照剂量从而减少骨髓的整体受照射量。在NC-IMRT中,左侧股骨头的V10、V15、V20、V25、V30、V35以及Dmean的值均小于IMRT中的值,两者的差异具有统计学意义 (P < 0.05)。IMRT中骶骨和髂骨的平均剂量值为 (30.1±2.0) Gy,而NC-IMRT中的值为 (29.6±2.0) Gy (P < 0.05)。对于直肠和小肠等危及器官,NC-IMRT相比于IMRT差异没有统计学意义 (P > 0.05)。
综上所述,在宫颈癌术后的放射治疗中,非共面技术可以避开射线从两侧股骨头经过,有效地减少该器官的受照剂量,同时对于靶区的HI、CI等剂量学参数以及其他重要危及器官的DVH差异无统计学意义。因此,使用非共面照射技术在减少骨髓的受照剂量上具有一定的剂量学优势,通过降低两侧股骨头、骶骨和髂骨的受照剂量有助于降低急性血液不良反应的发生率,保证放疗的正常进行。非共面技术在实施时会相应增加临床实践的难度和质量控制的潜在风险,治疗床角度必须有安全联锁并在治疗前通过验证,避免非共面照射技术按照共面技术实施。
利益冲突 无作者贡献声明 吴骏翔负责论文的设计及撰写;康盛伟、黎杰、王培负责提出选题,指导修改论文;唐斌、吴凡、许敬辉协助数据收集和统计分析
| [1] | Barillot I, Horiot JC, Maingon P, et al. Impact on treatment outcome and late effects of customized treatment planning in cervix carcinomas: baseline results to compare new strategies[J]. Int J Radiat Oncol Biol Phys, 2000, 48 (1): 189-200. DOI:10.1016/S0360-3016(00)00556-3. |
| [2] | Taylor A, Powell ME. Conformal and intensity-modulated radiotherapy for cervical cancer[J]. Clin Oncol (R Coll Radiol), 2008, 20 (6): 417-425. DOI:10.1016/j.clon.2008.04.004. |
| [3] | Roeske JC, Lujian A, Rotmensch J, et al. Intensity-modulated whole pelvic radiation therapy in patients with gynecologic malignancies[J]. Int J Radiat Oncol Biol Phys, 2000, 48 (5): 1613-1621. DOI:10.1016/S0360-3016(00)00771-9. |
| [4] | Portelance L, Chao KS, Grigsby PW, et al. Intensity-modulated radiation therapy (IMRT) reduces small bowel, rectum, and bladder doses in patients with cervical cancer receiving pelvic and para-aortic irradiation[J]. Int J Radiat Oncol Biol Phys, 2001, 51 (1): 261-266. DOI:10.1016/S0360-3016(01)01664-9. |
| [5] | Mell LK, Kochanski JD, Roeske JC, et al. Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensity-modulated pelvic radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 66 (5): 1356-1365. DOI:10.1016/j.ijrobp.2006.03.018. |
| [6] | Belhadj H, Berek J, Bermudez A, et al. FIGO staging for carcinoma of the vulva, cervix, and corpus uteri[J]. Int J Gynaecol Obstet, 2014, 125 (2): 97-98. DOI:10.1016/j.ijgo.2014.02.003. |
| [7] | Feuvret L, Nol G, Mazeron JJ, et al. Conformity index: a review[J]. Int J Radiat Oncol Biol Phys, 2006, 64 (2): 333-342. DOI:10.1016/j.ijrobp.2005.09.028. |
| [8] | Murshed H, Liu HH, Liao Z, et al. Dose and volume reduction for normal lung using intensity-modulated radiotherapy for advanced-stage non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2004, 58 (4): 1258-1267. DOI:10.1016/j.ijrobp.2003.09.086. |
| [9] | Taylor A, Rockall AG, Reznek RH, et al. Mapping pelvic lymph nodes: guidelines for delineation in intensity-modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2005, 63 (5): 1604-1612. DOI:10.1016/j.ijrobp.2005.05.062. |
| [10] | Klopp AH, Moughan J, Portelance L, et al. Hematologic toxicity in RTOG 0418: a phase 2 study of postoperative IMRT for gynecologic cancer[J]. Int J Radiat Oncol Biol Phys, 2013, 86 (1): 83-90. DOI:10.1016/j.ijrobp.2013.01.017. |
| [11] | Rose BS, Aydogan B, Liang Y, et al. Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 79 (3): 800-807. DOI:10.1016/j.ijrobp.2009.11.010. |
| [12] | Albuquerque K, Giangreco D, Morrison C, et al. Radiation-related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys, 2011, 79 (4): 1043-1047. DOI:10.1016/j.ijrobp.2009.12.025. |
| [13] | Ahamad A, D'Souza W, Salehpour M, et al. Intensity-modulated radiation therapy after hysterectomy: comparison with conventional treatment and sensitivity of the normal-tissue-sparing effect to margin size[J]. Int J Radiat Oncol Biol Phys, 2005, 62 (4): 1117-1124. DOI:10.1016/j.ijrobp.2004.12.029. |
| [14] | Bedford JL, Henrys AJ, Dearnaley DP, et al. Treatment planning evaluation of non-coplanar techniques for conformal radiotherapy of the prostate[J]. Radiother Oncol, 2005, 75 (3): 287-292. DOI:10.1016/j.radonc.2005.03.023. |
| [15] | Chapet O, Khodri M, Jalade P, et al. Potential benefits of using non coplanar field and intensity modulated radiation therapy to preserve the heart in irradiation of lung tumors in the middle and lower lobes[J]. Radiother Oncol, 2006, 80 (3): 333-340. DOI:10.1016/j.radonc.2006.07.009. |
| [16] | Krayenbuehl J, Davis JB, Ciernik IF. Dynamic intensity-modulated non-coplanar arc radiotherapy (INCA) for head and neck cancer[J]. Radiother Oncol, 2006, 81 (2): 151-157. DOI:10.1016/j.radonc.2006.09.004. |
| [17] | Fogliata A, Clivio A, Nicolini G, et al. A treatment planning study using non-coplanar static fields and coplanar arcs for whole breast radiotherapy of patients with concave geometry[J]. Radiother Oncol, 2007, 85 (3): 346-354. DOI:10.1016/j.radonc.2007.10.006. |
| [18] | Derycke S, Gersem WRTD, Duyse BBRV, et al. Conformal radiotherapy of stage Ш non-small cell lung cancer: a class solution involving non-coplanar intensity-modulated beams[J]. Int J Radiat Oncol Biol Phys, 1998, 41 (4): 771-777. DOI:10.1016/S0360-3016(98)00114-X. |
 2017, Vol. 37
2017, Vol. 37


