保乳手术及术后放疗已被作为Ⅰ、Ⅱ期乳腺癌的标准治疗,在针对早期乳腺癌患者的临床研究中,其与乳腺癌根治手术有着同样的生存率[1-5]。来自早期乳腺癌试验合作组 (Early Breast Cancer Trialists′ Collaborative Group, EBCTCG) 的研究结果显示,保乳术后的全乳放疗可以使10年的局部复发概率显著降低,并由此获得在15年时3.8%的生存获益[6],多个随机Ⅲ期研究已证实,在全乳照射的基础上加瘤床照射,可进一步提高局部控制率,不良反应轻微且美容效果尚好。局部补量可以通过多种放疗技术实现,常用的有电子线、X射线、质子线、组织间插植和术中补量[7-8]。美国国家综合癌症网络 (NCCN) 指南目前仍推荐以电子线、X射线及近距离放疗来实现局部补量[9],而以何种标准来选择最适合的补量照射方式现在仍不确定。有研究初步显示了不同补量方式在局部控制率、剂量学及纤维化不良反应方面的差异[10-12],但不同补量方式对患者生存的影响仍无明确研究结果。本研究回顾性比较了电子线二维补量和X射线三维调强补量照射方式对患者局部复发率及生存率的影响。
资料与方法1.临床资料:2004年6月至2007年4月北京大学肿瘤医院乳腺中心接受乳腺癌保乳术后放疗、临床分期为Ⅰ~Ⅱ的患者,共485例,其中Ⅰ期患者383例,Ⅱ期102例。入组标准:患者年龄大于18岁;初诊时可触及的乳腺肿瘤最大径 < 5 cm (cT0-2);经空心针穿刺活检确诊为乳腺浸润性癌,腋窝淋巴结经外科分期;初治时无远处转移 (M0);东部肿瘤协作组织 (ECOG) 评分为0~2分。排除标准:炎性乳癌、既往其他肿瘤病史或其他基础性疾病不能耐受手术及术后放疗患者。本研究经过医院伦理委员会论证,所有患者签署了知情同意书。患者详细临床资料列于表 1。
|
|
表 1 患者基本资料分析 Table 1 The basic characteristics of patients |
所有患者均行乳腺癌保乳术,且肿瘤完整切除 (切缘阴性),患侧腋窝淋巴结行前哨淋巴结活检术或腋窝清扫术。部分患者在术前接受新辅助化疗或内分泌治疗,在术后接受辅助化疗或内分泌治疗。Her-2高表达患者均未接受曲妥珠单抗靶向治疗。全部患者在术后1~2个月或辅助化疗结束后1个月内开始术后放疗。
2.三维调强全乳放疗:临床靶区1(clinical target volume 1, CTV1) 包括患侧全部乳腺组织,不包括胸大肌、肋骨和皮肤,其前界为皮下5 mm,计划靶区1(planning target volume 1, PTV1) 为CTV1向皮侧外扩3 mm,其他方向外扩5 mm。处方剂量:6 MV X射线46~50 Gy/23~25次。
3.瘤床补量:电子线二维补量组患者362例。靶区为可见手术切口范围外扩20 mm,并使90%的等剂量线限制于胸壁以上,以减少肺组织受照剂量。采用固定源皮距照射,选用9~12 MeV的电子线垂直患者皮肤表面照射。处方剂量瘤床10~16 Gy/5~8次。
X射线三维调强补量组患者123例。靶区为CT图像下依手术瘢痕、术中标记及CT影像所示的术后改变区勾画瘤床区域 (CTV2),PTV2为CTV2范围皮侧外放3 mm,其他各方向外扩5 mm,后界不超过胸肌前缘。处方剂量瘤床10~16 Gy/5~8次。
4.锁骨上下野照射:部分腋窝淋巴结转移患者接受了同侧锁骨上下淋巴引流区单前野照射,给予处方剂量50 Gy/25次。
5.统计学处理:采用SPSS 19.0软件进行分析。患者临床病理特点在电子线及X射线瘤床补量组间分布的差异采用Pearson′s χ2检验。采用Kaplan-Meier生存分析方法评估患者生存,两组患者间生存差异采用Log-rank检验。影响生存的多因素分析采用Cox回归模型,应用进入法对各因素进行检验。P < 0.05为差异有统计学意义。
结果1.无局部复发生存率 (local recurrence free survival, LRFS) 结果:全部患者中共25例患者出现局部复发 (5.2%),其中患侧乳腺局部复发23例,患侧胸壁复发2例。X射线三维调强组有2例患者局部复发 (2/123,1.62%),而电子线二维组有23例患者局部复发 (23/362,6.35%),全部患者的5年LRFS为95.3%。5年LRFS在电子线组为94.2%,10年为93.2%;X射线组5年和10年LRFS均为98.4%,差异有统计学意义 (χ2=4.190,P < 0.05,图 1)。单因素分析中,有4个因素与局部复发正相关,分别为年龄≤40岁 (χ2=4.254,P < 0.05)、前哨或腋清腋窝淋巴结阳性 (χ2=10.101,P < 0.05)、Her-2过表达 (χ2=7.826,P < 0.05) 及之前提到的瘤床补量方式。而患者的激素受体表达情况和原发肿瘤大小与LRFS无明显相关性 (P > 0.05,表 2)。
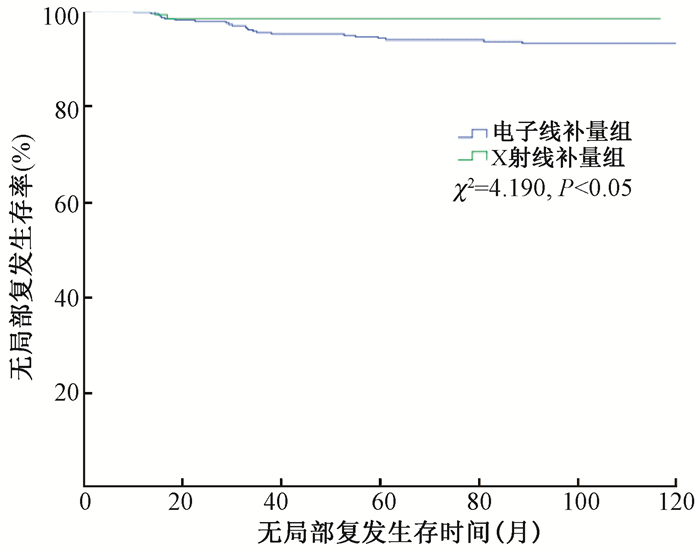
|
图 1 两组患者无局部复发生存率的比较 Figure 1 Comparison of local recurrence free survival between two groups |
|
|
表 2 485例患者5年及10年无局部复发生存率比较 Table 2 The comparison between 5-and 10-year local recurrence free survival of 485 patients |
2.总生存率 (overall survival, OS) 结果:截至2016年10月,共40例患者死亡。全组患者5年的总生存率为95.4%(95%CI 0.944~0.964), 10年的总生存率为90.8%(95%CI 0.894~0.922)。电子线二维补量组5年和10年OS分别为94.9%和89.4%;X射线调强组5年和10年OS分别为96.7%和95.8 %,两组间总生存率差异无统计学意义 (P > 0.05,图 2,表 3)。
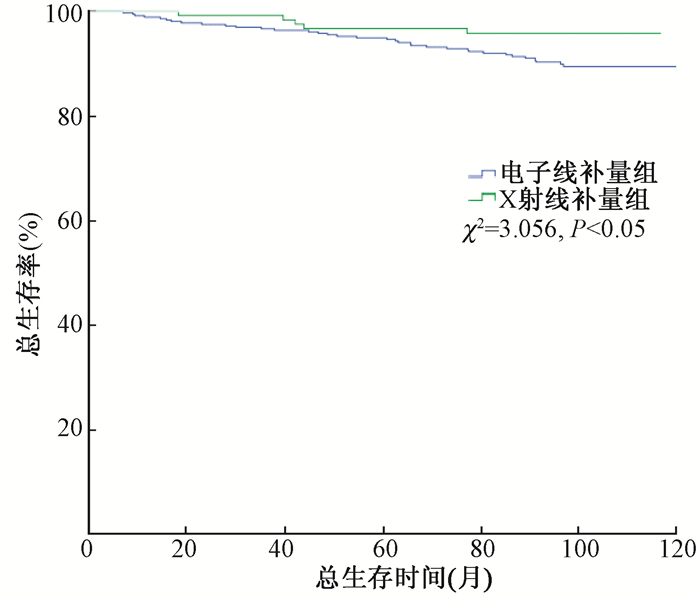
|
图 2 两组患者总生存率的比较 Figure 2 Comparison of overall survival between two groups |
|
|
表 3 485例患者5年及10年总生存率比较 Table 3 The comparison between 5-and 10-year overall survival of 485 patients |
3.多因素分析:在多因素分析中,有3个因素与肿瘤局部复发正相关,分别是前哨或腋清腋窝淋巴结阳性 (P=0.004,HR 3.663),年龄≤40岁 (P=0.026,HR=2.515) 及Her-2高表达 (P=0.006,HR=1.848),而瘤床补量方式不是LRFS的独立预后因素 (P=0.079,HR=3.660)。在OS相关的多因素分析中,激素受体表达阴性 (P=0.005,HR=2.493) 和腋窝淋巴结转移是OS的预后因素 (P=0.016,HR=2.216),瘤床补量方式不是OS的独立预后因素 (P=0.148,HR=2.005, 表 4)。
|
|
表 4 无局部复发生存率的多因素分析 Table 4 Multivariate analysis of local recurrence free survival |
讨论
早期乳腺癌试验合作组 (EBCTCG) 涵盖17个随机研究共10 801例保乳术后放疗患者的Meta分析显示,对于所有患者 (pN0及pN+),术后放疗可以使10年的复发风险 (局部复发及远处复发) 由35.0%降至19.3%(95%CI 13.7~17.7, P < 0.05),同时使15年的乳腺癌相关死亡风险由25.2%降至21.4%(P < 0.05)[6]。由此证实了乳腺癌保乳术后放疗的重要作用。而保乳术后同侧乳腺癌复发患者中,瘤床及其边缘的复发率可高达50%~60%[13-15],这种复发模式提示原发肿瘤瘤床及其所在象限是局部复发的高危区域。因此,为了减少乳腺瘤床处的局部复发事件,研究者们又将注意力集中在了全乳放疗后瘤床局部补量照射的问题上。有多个关于保乳术后瘤床局部补量照射的研究显示,局部加量10~16 Gy的放疗,可以使同侧乳腺局部复发率显著降低[16-18]。欧洲癌症研究与治疗协作组 (European Organization for Research and Treatment of Cancer, EORTC) 关于瘤床补量或不补量放疗的随机对照研究显示,在5 318例保乳术后完成全乳50 Gy/25次放疗的患者中,对瘤床进行16 Gy/8次补量放疗的患者,10年的局部失败率由10.2%降至6.2%(HR=0.59,P < 0.05),尽管患者的总体生存并没有明显获益[19]。因此,现在的术后放疗多采用45~50 Gy全乳照射后局部瘤床补量10~16 Gy的方式进行治疗。
本研究比较了电子线二维及X射线三维调强方式进行瘤床补量的预后生存情况,结果显示在单因素分析中,X射线调强组患者的5年及10年LRFS均好于电子线二维组,分别为98.4% vs. 94.2%和98.4% vs. 93.2%(P < 0.05), 表明采用X射线调强瘤床补量的方式比电子线二维瘤床补量有更好的局部控制率。通常来说电子线二维瘤床补量采用的是9~12 MeV能量电子线,处方剂量指90%~95%的等剂量线包含的剂量范围。而对于乳腺这样一个厚度不均、表面曲线型变化的组织器官来说,最终实现的等剂量线可能并不能像调强计划那样完整的涵盖整个靶区体积或不能达到均一剂量涵盖靶区。这在瘤床位于乳房边缘等深度突然变化的区域处可能更明显。乳腺及皮下软组织的厚度在这些区域变化较大,从而电子线照射可能导致实际瘤床部分剂量不足。目前的X射线调强瘤床补量通常采用4~6 MV的光子线,其有较高的穿透力、较均匀的剂量分布、较精确的瘤床定位和更少的正常组织受量[20]。因此提示当放疗技术受限制时,可能需多方面参考手术标记与瘤床关系、影像学提示的瘤床位置及深度和周围正常组织关系等多因素,严谨地制定二维电子线瘤床补量计划,以达到更好的靶区剂量分布及保护正常组织的目的。当然,本研究结果同时还显示,除了瘤床补量方式外,年龄≤40岁、腋窝淋巴结转移及Her-2高表达也是肿瘤局部复发的高危因素。这一结果与之前的多项研究结果相符,即提示在早期乳腺癌患者中,年龄、腋窝淋巴结受累情况及Her-2受体表达状态是肿瘤复发的重要预测因子[21-22]。
虽然本研究发现两种补量方式两组间LRFS差异存在统计学意义,但却没有在其后关于OS的分析中转化为生存获益。推断其原因可能与以下两方面相关:首先,随着全身系统治疗 (化疗/内分泌治疗) 药物的发展,治疗方案的有效率较以往有所提高,局部复发患者经后续全身治疗仍可获得较好的总生存;此外,正如有些研究提到的,因放疗而导致乳腺癌局部复发率的减少多发生在术后第1个10年内,而因放疗而导致的死亡率减少多体现在第2个10年[6],因此,更长时间的随访可能会观察到放疗给患者带来的生存获益。
由于本研究为回顾性研究,因此存在一定的局限性。例如,瘤床的定义及勾画方法的不同可能是导致局部控制率差异的原因。综合国外此前的几个随机研究发现,瘤床补量照射体积可依据术中置入的金属夹位置、依据放疗科医师直视下或外科手术疤痕范围确定,而这几种不同方式定义的瘤床体积有可能影响肿瘤的局部控制率。
乳腺癌保乳手术后采用X射线三维调强放疗瘤床补量较电子线二维放疗有更好的肿瘤局部控制率,但对患者OS无明显影响。除瘤床补量方式外,年龄≤40岁、腋窝淋巴结转移及Her-2高表达也是肿瘤局部复发的高危因素。
利益冲突 本人与其他作者以及基金无任何利益冲突作者贡献声明 张丝媛负责数据收集、统计分析及论文撰写;铁剑负责整体论文设计、论文撰写指导及修改;于会明、张艺宝指导数据收集及论文撰写
| [1] | Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer[J]. N Engl J Med, 2002, 347 (16): 1233-1241. DOI:10.1056/NEJMoa022152. |
| [2] | Veronesi U, Cascinelli N, Mariani L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J]. N Engl J Med, 2002, 347 (16): 1227-1232. DOI:10.1056/NEJMoa020989. |
| [3] | van Dongen JA, Voogd AC, Fentiman IS, et al. Long-term results of a randomized trial comparing breast-conserving therapy with mastectomy: European Organization for Research and Treatment of Cancer 10801 trial[J]. J Natl Cancer Inst, 2000, 92 (14): 1143-1150. DOI:10.1016/S1278-3218(00)00082-2. |
| [4] | Voogd AC, Nielsen M, Peterse JL, et al. Differences in risk factors for local and distant recurrence after breast-conserving therapy or mastectomy for stage Ⅰ and Ⅱ breast cancer: pooled results of two large European randomized trials[J]. J Clin Oncol, 2001, 19 (6): 1688-1697. DOI:10.1200/JCO.2001.19.6.1688. |
| [5] | Arriagada R, Lê MG, Rochard F, et al. Conservative treatment versus mastectomy in early breast cancer: patterns of failure with 15 years of follow-up data[J]. J Clin Oncol, 1996, 14 (5): 1558-1564. DOI:10.1200/JCO.1996.14.5.1558. |
| [6] | Darby S, McGale P, Correa C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10, 801 women in 17 randomised trials[J]. Lancet, 2011, 378 (9804): 1707-1716. DOI:10.1016/S0140-6736(11)61629-2. |
| [7] | Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival:an overview of the randomised trials[J]. Lancet, 2005, 366 (9503): 2087-2106. DOI:10.1016/S0140-6736(05)67887-7. |
| [8] | Kuerer HM, Julian TB, Strom EA, et al. Accelerated partial breast irradiation after conservative surgery for breast cancer[J]. Ann Surg, 2004, 239 (3): 338-351. DOI:10.1097/01.sla.0000114219.71899.13. |
| [9] | National Comprehensive Cancer Network. NCCN breast cancer clinical practice guidelines in oncology. Version 2. Washington:NCCN. 2016. https://www.nccn.org/professionals. |
| [10] | Poortmans P, Bartelink H, Horiot JC, et al. The influence of the boost technique on local control in breast conserving treatment in the EORTC 'boost versus no boost' randomised trial[J]. Radiother Oncol, 2004, 72 (1): 25-33. DOI:10.1016/j.radonc.2004.03.007. |
| [11] | Hill-Kayser CE, Chacko D, Hwang WT, et al. Long-term clinical and cosmetic outcomes after breast conservation treatment for women with early-stage breast carcinoma according to the type of breast boost[J]. Int J Radiat Oncol Biol Phys, 2011, 79 (4): 1048-1054. DOI:10.1016/j.ijrobp.2009.12.026. |
| [12] | Verhoeven K, Kindts I, Laenen A, et al. A comparison of three different radiotherapy boost techniques after breast conserving therapy for breast cancer[J]. Breast, 2015, 24 (4): 391-396. DOI:10.1016/j.breast.2015.03.003. |
| [13] | Kim KJ, Huh SJ, Yang JH, et al. Treatment results and prognostic factors of early breast cancer treated with a breast conserving operation and radiotherapy[J]. Jpn J Clin Oncol, 2005, 35 (3): 126-133. DOI:10.1093/jjco/hyi039. |
| [14] | Truong PT, Bernstein V, Lesperance M, et al. Radiotherapy omission after breast-conserving surgery is associated with reduced breast cancer-specific survival in elderly women with breast cancer[J]. Am J Surg, 2006, 191 (6): 749-755. DOI:10.1016/j.amjsurg.2005.07.028. |
| [15] | Toscas JI, Linero D, Rubio I, et al. Boosting the tumor bed from deep-seated tumors in early-stage breast cancer: a planning study between electron, photon, and proton beams[J]. Radiother Oncol, 2010, 96 (2): 192-198. DOI:10.1016/j.radonc.2010.05.007. |
| [16] | Smitten VK. Margin status after breast-conserving treatment of breast cancer: how much free margin is enough[J]. J Surg Oncol, 2008, 98 (8): 585-587. DOI:10.1002/jso.21038. |
| [17] | Romestaing P, Lehingue Y, Carrie C, et al. Role of a 10-Gy boost in the conservative treatment of early breast cancer: results of a randomized clinical trial in Lyon, France[J]. J Clin Oncol, 1997, 15 (3): 963-968. DOI:10.1200/JCO.1997.15.3.963. |
| [18] | Bartelink H, Horiot JC, Poortmans P, et al. Recurrence rates after treatment of breast cancer with standard radiotherapy with or without additional radiation[J]. N Engl J Med, 2001, 345 (19): 1378-1387. DOI:10.1056/NEJMoa010874. |
| [19] | Bartelink H, Horiot JC, Poortmans PM, et al. Impact of a higher radiation dose on local control and survival in breast-conserving therapy of early breast cancer: 10-year results of the randomized boost versus no boost EORTC 22881-10882 trial[J]. J Clin Oncol, 2007, 25 (22): 3259-3265. DOI:10.1200/JCO.2007.11.4991. |
| [20] | Benda RK, Yasuda G, Sethi A, et al. Breast boost: are we missing the target?[J]. Cancer, 2003, 97 (4): 905-909. DOI:10.1002/cncr.11142. |
| [21] | Loprinzi CL, Thomé SD. Understanding the utility of adjuvant systemic therapy for primary breast cancer[J]. J Clin Oncol, 2001, 19 (4): 972-979. DOI:10.1200/JCO.2001.19.4.972. |
| [22] | Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al. Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer[J]. N Engl J Med, 2006, 354 (8): 809-820. DOI:10.1056/NEJMoa053028. |
| [23] | Polgár C, Major T, Fodor J, et al. High-dose-rate brachytherapy alone versus whole breast radiotherapy with or without tumor bed boost after breast-conserving surgery: seven-year results of a comparative study[J]. Int J Radiat Oncol Biol Phys, 2004, 60 (4): 1173-1181. DOI:10.1016/j.ijrobp.2004.05.012. |
| [24] | Polgár C, Fodor J, Orosz Z, et al. The effect of tumour bed boost on local control after breast conserving surgery. First results of the randomized boost trial of the National Institute of Oncology[J]. Magy Onkol, 2001, 45 (5): 385-391. |
| [25] | Park SH, Kim JC. Comparison of electron and X-ray beams for tumor bed boost irradiation in breast-conserving treatment[J]. J Breast Cancer, 2013, 16 (3): 300-307. DOI:10.4048/jbc.2013.16.3.300. |
 2017, Vol. 37
2017, Vol. 37
