根据国家癌症中心统计,我国肺癌患者5年生存率仅为16.1%[1-2]。放疗是肺癌的常用治疗手段之一,但放疗并没有明显提高患者的5年生存率,且有90%的放疗患者死于恶性肿瘤的侵袭转移。近年来研究显示,一定剂量电离辐射可能有促进恶性肿瘤细胞侵袭转移之疑[3-5]。
研究发现,miRNA与辐射的敏感性、辐射诱导肿瘤的发生和辐射旁观者效应密切相关[6-7]。为进一步研究miR-424*在射线诱导的A549细胞体内、外侵袭能力中的变化,及其在肺癌诊断中的潜在作用,本研究在前期工作基础上,展开了对2、4 Gy X射线照射后A549细胞体内、外miR-424*的表达变化研究,并建立裸鼠尾静脉注射经X射线照射后的A549细胞转移肺癌模型,通过对注射后不同时间点裸鼠肺组织及血清中mi-424*的表达变化,及临床肺癌患者血清中该miRNA的表达检测,探讨其在辐射增强A549细胞侵袭转移中的可能作用及作为生物标记物的潜在可能性。
材料与方法1.细胞与试剂:人肺腺癌A549细胞购自北京协和医学院细胞库。细胞系用含有10%灭活胎牛血清、100 kU/L青霉素和100 kU/L链霉素的DMEM培养液,37℃、5%CO2、饱和湿度培养箱中培养。特级胎牛血清、DMEM培养基购自美国GIBCO公司;microRNA提取试剂盒 (mirVanaTM miRNA Isolation Kit)、microRNA反转录试剂盒 (TaqMan® MicroRNA Reverse Transcription Kit) 均购自美国ABI公司。
2.细胞照射:取处于对数生长期的A549细胞,常温下以直线加速器 (火箭军总医院放射治疗中心,瑞典Elekta公司Precise型) 进行照射,源靶距为100 cm,X射线能量为6 MV,吸收剂量率为442.89 cGy/min,吸收剂量分别为2和4 Gy,于照射后1、2、12、24及48 h收集细胞进行检测,非照射 (0 Gy) 的A549细胞为对照组。
3.动物样本采集:①血清:取18~22 g体重的BALB/c nu/nu雌性裸鼠,采用简单随机化分组方法分为5组 (0 Gy 3周、0 Gy 6周、0 Gy 10周、2 Gy 10周和4 Gy 10周),每组6只;于小鼠尾静脉注射不同剂量照射的A549细胞5×106细胞,以未注射A549细胞的裸鼠作为空白对照组,分别于照射后3、6、10周眼球放血,分离血清,分装-20℃冰箱保存,用于后续miRNA检测。②肺组织:眼球放血后的小鼠,快速打开胸腔,分离肺组织,迅速放入液氮中冷冻,然后取出-80℃冰箱保存,用于RNA提取。
4. miRNA提取及RT qPCR检测:①A549细胞RNA提取:用磷酸盐缓冲液 (PBS) 洗培养好的A549细胞,每102~107细胞内加入600 μl Lysis/Binding Solution,裂解细胞3 min;收集裂解液于1.5 ml EP管中用于RNA提取。②裸鼠肺组织RNA提取:液氮研磨 < 200 mg裸鼠肺组织,转移粉末至1.5 ml EP管中,加入1 000 μl Lysis/Binding Solution裂解细胞。③裸鼠血清miRNA提取:-80℃冰箱取出冻存血清,充分融化后,室温条件下,于625 μl血清中加入等体积的2×Denaturing Solution,立即混匀,冰上孵育5 min;miRNA的提取参照美国ABI公司miRNA Isolation Kit操作手册进行;反转录体系及反应条件参照TaqMan® MicroRNA Reverse Transcription Kit操作手册;探针和引物参照miRBase,由美国ABI公司合成;qPCR参照美国ABI公司TaqMan Human MicroRNA Assay kit操作手册。以U6表达水平作为miRNA的内参;每个样品3个复孔,细胞实验重复3次,取均值。
5. miRNA相对表达量计算方法:分别以对照组中U6 miRNA的表达量为1,△△Ct法计算各组miRNA-424*表达量的倍数[1-2]。公式为:2-△△Ct=2-(△Ct实验组-△Ct对照组);△Ct=Ct待测样品-Ct内参。
6.肺癌患者入组标准:依据2009年7月国际肺癌研究学会 (IASLC) 制定的第7版肺癌TNM分期标准,纳入本次研究者均经病理细胞学确诊。所有入选人员均签署知情同意书,所有对象的病例资料记录完整,均经临床体检、纤维支气管镜检查,以及胸部、头部、腹部CT或腹部B超、全身骨扫描等检查,且所选病例无妊娠、无糖尿病、无肝肾功能不全、无充血性心力衰竭和高血压等并发症。本研究得到本院伦理委员会批准。排除标准:术后大体病理仍无法确认的;术前有放射治疗或化学治疗史的;肺穿刺标本不作为研究对象。转移组与非转移组患者在年龄、一般情况、卡氏评分等差异无统计学意义。
7.肺癌患者样本采集:①肺癌病理组织:11例甲醛固定-石蜡包埋的肺癌患者肺组织样本来自于原北京军区总医院2014年1月至10月的住院手术患者,病理诊断为5例腺癌,6例鳞癌,其中8例为Ⅰ期,2例为Ⅱ期,1例为Ⅳ期。同时取无肺癌细胞的肺组织作为对照。②血清样本:84例肺癌患者血清样本来自火箭军总医院2014年1月至2016年5月期间的住院患者。84例患者中46例为腺癌,38例为鳞状细胞癌,绝大多数为Ⅳ期患者。选取2014年3月在火箭军总医院体检中心的10例健康体检者作为健康对照组。抽取患者外周血4 ml,待凝固后离心半径7.5 cm,5 000 r/min,离心6 min,用无RNA酶的枪头吸取血清样本于1.5 ml无RNA酶的EP管中,每位患者3~4管,置-80℃冰箱冻存,备用。所有关于人体样本的试验已经本院伦理委员会批准,相应批件号为2015036。
8.统计学处理:数据以x±s表示,采用SPSS 19.0软件进行数据分析。满足正态分布与方差齐性的数据,不同剂量组与对照组之间采用单因素k水平方差分析,实验组与对照组之间采用独立样本t检验;其余采用非参数检验;不同病理类型及放疗与否样本阳性检出率采用χ2检验。P < 0.05为差异有统计学意义。
结果1. X射线对A549细胞miRNA-424*的表达影响:结果见表 1。与对照组相比,2 Gy X射线照射后1、2、12、24及48 h,miR-424*表达均显著升高,为对照组的2.41、1.27、3.13、1.49及2.56倍,(t=-45.886、-8.429、-6.93、-9.139、-6.709,P < 0.05);4 Gy X射线照射后1、2、12及48 h,miR-424*表达亦均显著升高,为2.33、1.98、2.38及2.42倍 (t=-7.979、-29.087、-21.749、-7.833,P < 0.01);尽管与对照组相比,4 Gy X射线照射后24 h,miR-424*表达差异无统计学意义 (P > 0.05),但整个观察期,miR-424*表达的总体水平显著升高,为2.33、1.98、2.38及2.42倍 (t=-7.979、-29.087、-21.749、-7.833, P < 0.01);尽管与对照组相比, 4 Gy X射线照射后24 h, miR-424*表达差异无统计学意义 (P > 0.05), 但整个观察期, miR-424*表达的总体水平显著升高, 平均升高2.004倍。4 Gy X射线照射后2 h,A549细胞miR-424*的表达水平显著高于2 Gy组 (t=-15.208,P < 0.01);而照射后24 h,4 Gy照射组其miR-424*表达水平显著低于2 Gy组 (t=10.446,P < 0.01)。提示miR-424*可能参与了2、4 Gy X射线照射诱发的细胞生物学行为变化的调节。
|
|
表 1 2、4 Gy X射线照射后不同时间A549细胞miR-424*表达变化 (x±s) Table 1 The relative expression of miR-424* in A549 cells at different time-points after 2 and 4 Gy X-ray irradiation (x±s) |
2. 2、4 Gy X射线对肺转移癌裸鼠血清及肺组织中miR-424*表达影响:如图 1A所示,分别将0、2、4 Gy照射后的A549细胞注射裸鼠尾静脉后3、6周,肺中无肉眼可见的肿瘤灶,肺组织中miR-424*的表达与对照组相比,差异无统计学意义 (P > 0.05)。注射后10周,裸鼠肺中可见散在的肿瘤灶,3组裸鼠肺中均可检测到miR-424*表达显著升高,为空白对照组的9.72、8.58及4.7倍 (t=-13.243、-12.409、-9.833,P < 0.05),且0 Gy组与2 Gy组显著高于4 Gy组 (t=7.156、5.617,P < 0.01)。裸鼠血清检测结果如图 1所示,注射后3、6周,与对照组相比,裸鼠血清miR-424*表达显著升高 (t=-4.142、-2.884,P < 0.05);注射后10周,3组裸鼠血清中均可检测到miR-424*表达显著升高,分别为对照组的11.93、9.22及8.99倍 (t=-6.436、-3.052、-3.609,P < 0.05),各剂量组间差异无统计学意义 (P > 0.05)。

|
图 1 X射线对肺转移癌裸鼠血清及肺组织中miR-424*表达影响A. 2、4 Gy A549细胞照射后不同时间点裸鼠肺及血清中miR-424*的表达变化;B.不同剂量射线照射后A549细胞裸鼠尾静脉注射10周肺及血清中miR-424*的表达变化 注:a与肺组织空白对照组比较,A:t=-13.243,P < 0.05;B:t=-13.243、-12.409、-9.833,P < 0.05;b与血清空白对照组比较,A:t=-4.142、-2.884、-6.436,P < 0.01;B:t=-6.436、-3.052、-3.069,P < 0.01;A. 3个不同时间点比较,F肺=1.255,P < 0.05,F血清=3.163,P < 0.01;B. 3个不同剂量组间比较,F肺=45.966,P < 0.01 Figure 1 Influence of X-ray irradiation on the expression of miR-424* in lung tissue and serum of nude mice with injection of A549 cells A. The dynamic expression of miR-424* in lung tissue and serum of nude mice at different time-point after A549 cell injection; B. The expression of miR-424* in lung and serum of nude mice at 10 weeks after 0, 2, 4 Gy X-ray irradiated A549 cells injection |
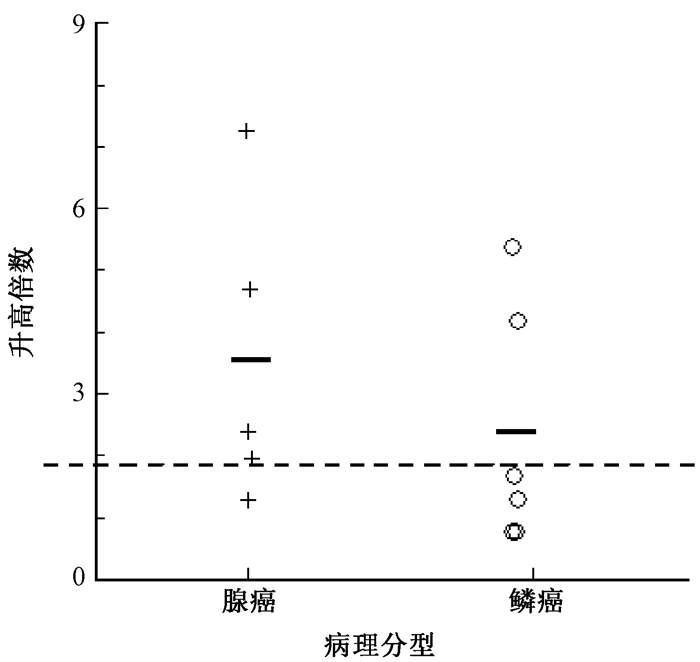
3. miR-424*在临床肺癌标本及血清中的表达:11例肺癌患者病理标本与相邻无肺癌细胞的肺组织相比,有6例miR-424*表达升高 (升高1.95~7.26倍),见图 2。其中5例腺癌中检出4例;6例鳞癌标本中2例,两者之间差异无统计学意义 (P > 0.05)。
|
图 2 miR-424*在不同病理类型肺癌组织中的相对表达 注:虚线代表miR-424*相对表达为健康对照组的1.8倍;+、○表示相应病理类型患者肺癌组织中miR-424*表达水平;“—”表示均值 Figure 2 The expression of miR-424* in the tissue of lung cancer |
84例肺癌患者血清中miR-424*表达升高的占51.20%(43/84),与健康志愿者血清水平相比,升高1.97~17.71倍,见图 3。其中,46例腺癌患者血清的检出率为39.1%(18/46),38例鳞癌患者血清检出率为65.8%(25/38),两种病理类型中的检出率差异有统计学意义 (χ2=5.919,P < 0.05)。此外,84例肺癌患者中,miR-424*在未接受放疗的患者血清的阳性检出率为41.5%(22/53),显著低于接受放疗的患者血清的阳性检出率67.7%(21/31)(χ2=5.387,P < 0.05)。提示miR-424*有可能作为肺癌分型诊断新的潜在标志物,其表达升高与放疗与否相关。

|
图 3 肺癌患者血清中miR-424*的相对表达 A.两种病理类型中表达;B.在放疗与非放疗患者中的表达 注:虚线代表miR-424*相对表达为健康对照组1.8倍;+、○表示患者血清中miR-424*的表达水平;“—”表示均值 Figure 3 The relative expression level of miR-424* in serum sample of lung cancer patients. A. The expression of miR-424* in serum sample of lung cancer patients with two pathological type; B. The expression of miR-424* in serum sample of lung cancer patients with and without radiotherapy |
讨论
放疗是肺癌治疗的重要手段之一,然而,近来研究发现,对小鼠原发肿瘤进行放疗能加速恶性肿瘤的侵袭转移能力[8]。前期研究发现,2、4 Gy X射线可增强人肺腺癌A549细胞的体外侵袭能力,其机制与调节血管内皮生长因子 (VEGF) 及CCR-7 mRNA的表达有关,并进一步采用TaqMAN微流体芯片技术初步筛选了2、4 Gy X射线照射A549细胞后差异表达的miRNAs,发现miR-424*表达显著升高[9]。本研究在前期工作基础上,进一步研究2、4 Gy X射线照射后A549细胞miR-424*的表达变化,并探讨其在辐射增强A549细胞侵袭转移中的作用。
miRNAs是一类长度为22个左右核苷酸的小分子非编码RNA,参与基因转录后水平的调控,具有高度的保守性和组织特异性,其通过与目标mRNA特定结合部位的完全互补来降解mRNA或部分互补来抑制mRNA转录后表达,从而发挥其生物学功能。超过50%的miRNAs位于肿瘤相关区域或脆性区域,与肿瘤的发生、发展及侵袭转移密切相关[10-13]。Yanaihara等[14]鉴定了6种miRNAs在肺腺癌和肺鳞癌中的表达,发现miR-99b和miR-102在肺腺癌患者血清中的表达水平显著高于肺鳞癌患者。Landi等[15]研究报道了肺腺癌与肺鳞癌患者外周血miRNA的表达与预后密切相关,如miR-155及miR-146b在鳞癌患者血清中高表达与预后整体生存率低密切相关。另有研究亦报道,miRNAs表达谱在肺腺癌与肺鳞癌患者中显著不同[16-17]。
目前,有关miR-424*在肺癌,特别是非小细胞肺癌发生发展中的研究鲜有报道。本研究首次观察了人肺腺癌A549细胞在0、2与4 Gy X射线照射后miR-424*的体内、外表达变化,结果发现体外2、4 Gy X射线照射A549细胞后1、2、12、48 h miR-424*表达均有不同程度升高,且4 Gy照射后2、24 h miR-424*表达水平较2 Gy组显著升高。研究显示,辐射能在不同的组织和细胞中诱导miRNA的表达,且其表达与特定的细胞类型、辐射剂量及照射时间均有密切关系,部分miRNA呈现出剂量及时间变化的不同反应[18-19]。本研究中,2、4 Gy X射线照射后,miR-424*的表达变化亦呈现随时间变化的不同趋势,与芯片筛选的结果一致[9]。研究进一步将2、4 Gy X射线照射后的A549细胞经尾静脉注射裸鼠,发现注射后10周,裸鼠肺中可见散在的肿瘤灶形成,裸鼠肺组织中miR-424*表达水平亦显著升高,提示miR-424*可能参与了2、4 Gy X射线照射所诱发的A549细胞侵袭转移过程,且裸鼠血清中miR-424*表达水平升高可能为肺癌诊断提供了新的肿瘤标志物。
为进一步验证上述发现,本研究收集并检测了11例肺癌患者肺癌组织病理标本和84例肺癌患者血清标本。结果发现在11例肺癌组织中有6例高表达miR-424*,其中5例腺癌中有4例检测出miR-424*,6例鳞癌标本中miR-424*检出2例,两者之间差异无统计学意义,其原因可能是由于研究中所收集的肺癌样本数量过少,在今后的研究中要继续收集肺癌组织进行验证。在84例肺癌患者血清中miR-424*表达升高的占51.20%(43/84),与健康志愿者血清水平相比,升高1.97~17.71倍,其中46例腺癌患者血清的检出率为39.1%(18/46),38例鳞癌患者血清检出率为65.8%(25/38),两种病理类型中的检出率差异显著;此外,84例肺癌患者中,miR-424*在未接受放疗的肺癌患者血清中的阳性检出率为41.5%(22/53),显著低于接受放疗的肺癌患者血清的阳性检出率67.7%(21/31)。上述结果说明miR-424*在不同病理类型肺癌患者血清中的表达水平是有差异的,其中肺鳞癌患者血清检出率要高于肺腺癌患者,提示miR-424*有可能作为肺癌分型诊断新的潜在标志物,且其表达升高与放疗与否相关。
文献报道,miR-424在多种癌症中异常表达,如胰腺癌、肾透明细胞癌、舌鳞状细胞癌中表达上调;宫颈癌、卵巢癌、乳腺癌中表达下调[20-23]。部分研究证明,miR-424与肿瘤侵袭转移密切相关,在不同的癌组织中其侵袭转移的作用机制不尽相同。Wu等[24]利用胰腺癌细胞进行体外实验并发现,抑制细胞中miR-424表达,其侵袭转移能力降低。Xu等[25]发现宫颈癌细胞中miR-424过表达,细胞侵袭转移能力减弱;反之,宫颈癌细胞中低表达,则细胞侵袭转移能力增强。miR-424*与miR-424共同位于染色体Xq26.3,Xq26区域,是同一前体的两个不同分子亚型 (miR-424-3p为miR-424*,miR-424-5p为miR-424)。目前,关于miR-424*的功能特别是在肺癌中的研究报道极少。研究显示,尽管两个miRNA分子亚型来源于同一前体miRNA,但miR-424与miR-424*的功能不尽相同,甚至完全相反[26-27]。miR-424可以逆转肝癌上皮细胞的间充质转化,进而抑制肝癌细胞的侵袭过程[26],这一效应与miR-424-3p完全相反。另有研究显示,胰腺癌中miR-424-5p的表达上调可以增强胰腺癌细胞的增殖、侵袭及转移[27]。Zhang等[28]研究发现,miR-424*表达下调与NSCLC的进展及整体预后密切相关,且miR-424*与miR-424均可通过靶向YAP1基因显著抑制NSCLC细胞的增殖、迁移及侵袭;此外,miR-424*通过靶向YAP1基因增强NSCLC细胞的化疗敏感性,证实了miR-424*在肿瘤的化疗抵抗与侵袭中发挥肿瘤抑制因子的作用。本研究发现,84例肺癌患者超过50%的血清样本中miR-424*表达升高,且在放疗组患者中miR-424*检出率显著高于非放疗组患者,该结果与文献报道[28]并不完全一致,一方面在于两个研究的目的及研究对象状态不同:本研究的目的是研究不同剂量射线对细胞miRNA的表达影响,而文献中的研究对象为无处理或经化疗药处理的细胞,化疗对细胞miRNA表达的影响尚未见报道,而辐射诱导细胞miRNA表达改变已有报道[18-19];另一方面,肿瘤细胞生物学特性相关的靶基因不同:本研究主要探讨射线诱导A549细胞表达变化的miRNA及其下游影响的相关靶基因,而文献报道研究的是与化疗敏感的靶基因,因此其作用机制及作用结果不尽相同。此外,本研究发现的miR-424*参与2、4 Gy X射线照射所诱导的A549细胞侵袭转移过程的机制有待进一步研究。
利益冲突 无作者贡献声明 高俊进行数据统计、论文撰写和修改;吕进、江其生负责对论文进行审校;胡斌、宋秀军、段影负责实验设计和实施;李振源、李晓、杨丽娜、王思念负责准备试剂和实验材料
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90. DOI:10.3322/caac.20107. |
| [2] | Lortet-Tieulent J, Soerjomataram I, Ferlay J, et al. International trends in lung cancer incidence by histological subtype: adenocarcinoma stabilizing in men but still increasing in women[J]. Lung Cancer, 2014, 84 (1): 13-22. DOI:10.1016/j.lungcan.2014.01.009. |
| [3] | Brieger J, Kattwinkel J, Berres M, et al. Impact of vascular endothelial growth factor release on radiation resistance[J]. Oncol Rep, 2007, 18 (6): 1597-1601. |
| [4] | Inoue Y, Ojima E, Watanabe H, et al. Does preoperative chemo-radiotherapy enhance the expression of vascular endothelial growth factor in patients with rectal cancer?[J]. Oncol Rep, 2007, 18 (2): 369-375. |
| [5] | Jia JB, Wang WQ, Sun HC, et al. A novel tripeptide, tyroserleutide, inhibits irradiation-induced invasiveness and metastasis of hepatocellular carcinoma in nude mice[J]. Invest New Drugs, 2011, 29 (5): 861-872. DOI:10.1007/s10637-010-9435-1. |
| [6] | Cha HJ, Shin S, Yoo H, et al. Identification of ionizing radiation-responsive microRNAs in the IM9 human B lymphoblastic cell line[J]. Int J Oncol, 2009, 34 (6): 1661-1668. |
| [7] | Simone NL, Soule BP, Ly D, et al. Ionizing radiation-induced oxidative stress alters MiRNA expression[J]. PLoS One, 2009, 4 (7): e6377-10.1371/journal.pone.0006377. DOI:10.1371/journal.pone.0006377. |
| [8] | Hartford AC, Gohongi T, Fukumura D, et al. Irradiation of a primary tumor, unlike surgical removal, enhances angiogenesis suppression at a distal site: potential role of host-tumor interaction[J]. Cancer Res, 2000, 60 (8): 2128-2131. |
| [9] | Lv J, Jiang QS, Song XJ, et al. Role of VEGF-A/C and CCR-7 in the enhanced metastasis of A549 cells induced by 2 and 4 Gy X-rays in vitro and in vivo[J]. Sci China Tech Sci, 2014, 57 (5): 990-997. DOI:10.1007/s11431-014-5517-1. |
| [10] | Manne U, Shanmugam C, Bovell L, et al. MiRNAs as biomarkers for management of patients with colorectal cancer[J]. Biomark Med, 2010, 4 (5): 761-770. DOI:10.2217/bmm.10.87. |
| [11] | Wang H, Tan G, Dong L, et al. Circulating MiR-125b as a marker predicting chemoresistance in breast cancer[J]. PLoS One, 2012, 7 (4): e34210 DOI:10.1371/journal.pone.0034210. |
| [12] | Baffa R, Fassan M, Volinia S, et al. MicroRNA expression profiling of human metastatic cancers identifies cancer gene targets[J]. J Pathol, 2009, 219 (2): 214-221. DOI:10.1002/path.2586. |
| [13] | Farazi TA, Spitzer JI, Morozov P, et al. MiRNAs in human cancer[J]. J Pathol, 2011, 223 (2): 102-115. DOI:10.1002/path.2806. |
| [14] | Yanaihara N, Harris CC. MicroRNA involvement in human cancers[J]. Clin Chem, 2013, 59 (12): 1811-1812. DOI:10.1373/clinchem.2012.198176. |
| [15] | Landi MT, Zhao Y, Rotunno M, et al. MicroRNA expression differentiates histology and predicts survival of lung cancer[J]. Clin Cancer Res, 2010, 16 (2): 430-441. DOI:10.1158/1078-0432.CCR-09-1736. |
| [16] | Keller A, Backes C, Leidinger P, et al. Next-generation sequencing identifies novel microRNAs in peripheral blood of lung cancer patients[J]. Mol Biosyst, 2011, 7 (12): 3187-3199. DOI:10.1039/c1mb05353a. |
| [17] | Jeong HC, Kim EK, Lee JH, et al. Aberrant expression of let-7a miRNA in the blood of non-small cell lung cancer patients[J]. Mol Med Rep, 2011, 4 (2): 383-387. DOI:10.3892/mmr.2011.430. |
| [18] | Shin S, Cha HJ, Lee EM, et al. Alteration of miRNA profiles by ionizing radiation in A549 human non-small cell lung cancer cells[J]. Int J Oncol, 2009, 35 (1): 81-86. |
| [19] | Chaudhry MA. Analysis of gene expression in normal and cancer cells exposed to gamma-radiation[J]. J Biomed Biotechnol, 2008, 2008 : 541678 DOI:10.1155/2008/541678. |
| [20] | Yao H, Liu X, Chen S, et al. Decreased expression of serum miR-424 correlates with poor prognosis of patients with hepatocellular carcinoma[J]. Int J Clin Exp Pathol, 2015, 8 (11): 14830-14835. |
| [21] | Sun YP, Lu F, Han XY, et al. MiR-424 and miR-27a increase TRAIL sensitivity of acute myeloid leukemia by targeting PLAG1[J]. Oncotarget, 2016, 7 (18): 25276-25290. DOI:10.18632/oncotarget.8252. |
| [22] | Peng HY, Jiang SS, Hsiao JR, et al. IL-8 induces miR-424-5p expression and modulates SOCS2/STAT5 signaling pathway in oral squamous cell carcinoma[J]. Mol Oncol, 2016, 10 (6): 895-909. DOI:10.1016/j.molonc.2016.03.001. |
| [23] | Xu J, Fang Y, Wang X, et al. CUL2 overexpression driven by CUL2/E2F1/miR-424 regulatory loop promotes HPV16E7 induced cervical carcinogenesis[J]. Oncotarget, 2016, 7 (21): 31520-31533. DOI:10.18632/oncotarget.9127. |
| [24] | Wu K, Hu G, He X, et al. MicroRNA-424-5p suppresses the expression of SOCS6 in pancreatic cancer[J]. Pathol Oncol Res, 2013, 19 (4): 739-748. DOI:10.1007/s12253-013-9637-x. |
| [25] | Xu J, Li Y, Wang F, et al. Suppressed miR-424 expression via upregulation of target gene Chk1 contributes to the progression of cervical cancer[J]. Oncogene, 2013, 32 (8): 976-987. DOI:10.1038/onc.2012.121. |
| [26] | Zhang Y, Li T, Guo PB, et al. MiR-424-5p reversed epithelial-mesenchymal transition of anchorage-independent HCC cells by directly targeting ICAT and suppressed HCC progression[J]. Sci Rep, 2014, 4 : 6248 DOI:10.1038/srep06248. |
| [27] | Wu K, Hu G, He X, et al. MicroRNA-424-5p suppresses the expression of SOCS6 in pancreatic cancer[J]. Pathol Oncol Res, 2013, 19 (4): 739-748. DOI:10.1007/s12253-013-9637-x. |
| [28] | Zhang M, Zeng J, Zhao Z, et al. Loss of MiR-424-3p, not miR-424-5p, confers chemoresistance through targeting YAP1 in non-small cell lung cancer[J]. Mol Carcinog, 2017, 56 (3): 821-832. DOI:10.1002/mc.22536. |
 2017, Vol. 37
2017, Vol. 37


