骨髓是对电离辐射最敏感的组织,电离辐射引起的骨髓损伤是肿瘤放疗患者最常见的不良反应之一。电离辐射引起的骨髓损伤主要是由于骨髓中造血干祖细胞 (hematopoietic stem and progenitor cells,HSPCs) 数量减少、自我更新及重建能力下降、细胞凋亡增加,从而引起持久的骨髓抑制[1]。研究发现,活性氧 (reactive oxygen species,ROS) 在电离辐射诱导的组织损伤中发挥了重要作用。而H2是一种有效的抗氧化剂,对电离辐射引起心脏、皮肤、睾丸等组织的损伤具有保护作用[2]。本研究以富氢水为原料,探讨其对电离辐射诱导的HSPCs损伤的保护作用。
材料与方法1.实验动物:SPF级别C57BL/6雄性小鼠 (CD45.2)32只,6~8周龄,体重19~21 g,购自北京华阜康生物科技有限公司,许可证号:SCXK (京)2014-0004。SPF级别C57BL/6雄性小鼠 (CD45.1)32只,6~8周龄,体重范围19~21 g,购自中国医学科学院血液学研究所血液病医院,许可证号:SYXK (津)2014-0002。
2.试剂与仪器:FITC-CD34抗体、APC-c-kit抗体、PE-Sca1抗体购自美国eBioscience公司;生物素-Gr1、CD11b、Ter119、CD4、CD8、B220偶联抗体,PerCP-生物素-链霉亲和素偶联抗体购自美国Biolegend公司;抗APC磁珠、MACS分选柱、MACS分选器购自德国Miltenyi Biotec公司。Annexin V-FITC凋亡检测试剂盒 (美国BD Biosciences公司)、活性氧检测试剂盒 (江苏碧云天生物技术有限公司)、甲基纤维素半固体培养基 (美国Stem Cell公司)。氢气发生器 (山东赛克赛斯氢能源有限公司,型号:SHC-300),溶解氢测试仪 (日本TRUSTLEX公司,型号:ENH-1000)、流式细胞仪 (美国BD Biosciences公司,型号:Accuri C6)、137Cs γ射线照射源 (加拿大原子能有限公司,型号:USD Autocell40,吸收剂量率为0.99 Gy/min)。
3.富氢水的制备:取500 ml蒸馏水注入氢气发生器,20 min后得到富氢水,用溶解氢测试仪检测水中溶解氢的浓度。实验中富氢水均为新鲜制备,并保证水中溶解氢的浓度大于0.8×10-6 /L。
4.实验分组及照射:根据小鼠体重分层,随机区组法分为4组,每组8只小鼠 (CD45.2)。健康对照组:照射前5 min至照后7 d,每天灌胃给予0.5 ml蒸馏水;富氢水组:照射前5 min至照后7 d,每天灌胃给予0.5 ml富氢水;照射组:接受2 Gy全身照射,照射前5 min至照后7 d,每天灌胃给予0.5 ml蒸馏水;照射+富氢水组:接受2 Gy全身照射,照射前5min至照后7 d,每天灌胃给予0.5 ml富氢水。
5.小鼠骨髓造血干祖细胞比例的检测:照后15 d,颈椎脱臼处死小鼠,无菌分离双侧股骨和胫骨,用磷酸缓冲盐溶液 (PBS) 冲出骨髓,过滤、混匀得到骨髓细胞悬液。每组取5只小鼠 (CD45.2),每只小鼠取5×106骨髓细胞,加入生物素-Gr1、CD11b、Ter119、CD4、CD8、B220偶联混合抗体 (Lineage)2.5 μl,4℃避光孵育30 min,PBS洗去多余抗体,依次加入PerCP-生物素-链霉亲和素偶联抗体2 ml、PE-sca1抗体0.5 ml、APC-c-kit抗体0.5 ml、FITC-CD34抗体2 ml,4℃避光孵育1 h,PBS洗去多余抗体,流式细胞仪检测。
6.小鼠骨髓细胞克隆形成能力 (CFU-GM) 的检测:未照射组取2×104骨髓细胞,照射组取2×105骨髓细胞,分别加入2 ml甲基纤维素培养基,每组设置6个平行样。置于37℃、5% CO2培养箱中培养,第5天低倍镜下观察集落形成情况,计数细胞数≥30的集落数目。
7.竞争性骨髓移植实验 (competitive bone marrow transplantation, cBMT) 及受体小鼠嵌合率的检测:照后第15天每组取3只小鼠作为供体,3只健康小鼠作为竞争者。移植前4 h受体小鼠 (CD45.1) 接受8 Gy的137Cs γ射线全身照射,吸收剂量率为0.99 Gy/min。分别从供体小鼠 (CD45.2) 和竞争者小鼠 (CD45.1/45.2) 取1×106骨髓细胞,混合后自内眦静脉注入受体小鼠,每组受体小鼠8只。移植后16周取受体小鼠外周血检测供体嵌合率 (CD45.2细胞的比例)。
8.小鼠骨髓LSK细胞内ROS水平和细胞凋亡的检测:1×106骨髓细胞加入Lineage、sca1、c-kit抗体染色 (具体见材料与方法5),再加入500 ml活性氧检测探针 (DCFHDA与PBS缓冲溶液比例为1:3 000),37℃水浴20 min,PBS洗去未结合的DCFHDA,每组设置4个平行样,流式细胞仪检测DCFHDA的平均荧光强度。1×106骨髓细胞经Lineage、sca1、c-kit抗体染色后加入100 ml binding buffer和5 ml Annexin V-FITC,混匀后避光室温孵育15 min,上机前加入100 ml binding buffer,每组设置4个平行样,流式细胞仪检测细胞凋亡。
9.统计学处理:数据用x±s表示。采用SPSS 19.0软件进行分析。数据服从正态分布, 两组间均数的比较采用独立样本t检验。P<0.05为差异有统计学意义。
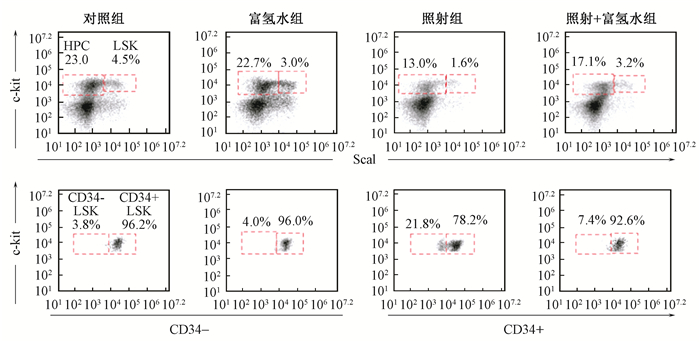
结果1.富氢水对受照小鼠骨髓造血干祖细胞比例的影响:与健康对照组相比,富氢水组小鼠骨髓造血祖细胞 (lineage-sca1-c-kit+ hematopoietic progenitor cells,HPC)、LSK细胞 (lineage-sca1+c-kit+)、CD34-LSK和CD34+LSK细胞的比例无显著变化;与健康对照组相比,照射组小鼠骨髓HPC、LSK、CD34+LSK细胞的比例明显下降,CD34-LSK细胞比例显著增加;而与照射组相比,照射+富氢水组小鼠骨髓HPC、LSK、CD34+LSK细胞的比例显著升高,CD34-LSK细胞比例显著下降 (表 1,图 1)。
|
|
表 1 富氢水对HSPCs辐射损伤的保护作用 (x±s) Table 1 The protection effect of hydrogen-rich water on radiation-induced HSPCs injury (x±s) |
|
图 1 富氢水对受照骨髓造血干祖细胞比例的影响 Figure 1 The effect of hydrogen-rich water on the percentage of irradiated hematopoietic stem and progenitor cells |
2.富氢水对受照小鼠骨髓细胞克隆形成能力的影响:与健康对照组相比,富氢水组小鼠骨髓细胞CFU-GM数目无显著变化;与健康对照组相比,照射组小鼠骨髓细胞CFU-GM数目明显下降;而与照射组相比,照射+富氢水组小鼠骨髓细胞CFU-GM数目显著增加 (表 1)。
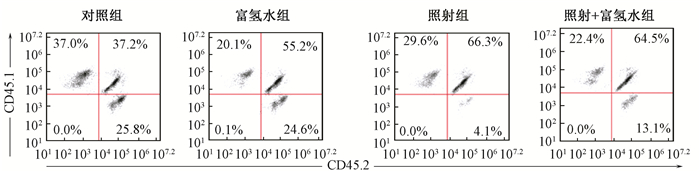
3.富氢水对受照小鼠骨髓细胞移植后重建能力的影响:移植后16周,健康对照组和富氢水组受体小鼠的供体嵌合率分别为25.40%和22.81%,差异无统计学意义 (P > 0.05)。照射组和照射+富氢水组受体小鼠的供体嵌合率分别为4.43%和14.28%,照射组受体小鼠的供体嵌合率明显低于健康对照组,而照射+富氢水组受体小鼠的供体嵌合率显著高于照射组 (表 1,图 2)。
|
图 2 富氢水改善受照骨髓造血干祖细胞的移植后重建能力 Figure 2 The improvement in reconstruction capacity of irradiated hematopoietic stem and progenitor cells after competitive bone marrow transplantation made by hydrogen-rich water |
4.富氢水对受照小鼠骨髓LSK细胞ROS水平的影响:与健康对照组相比,富氢水组小鼠骨髓LSK细胞的ROS水平明显下降,而照射组小鼠骨髓LSK细胞ROS水平明显升高;与照射组相比,照射+富氢水组小鼠骨髓LSK细胞ROS水平显著降低 (表 1)。
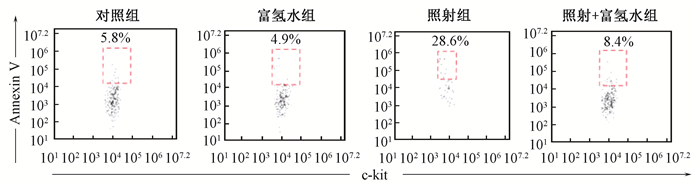
5.富氢水对受照小鼠骨髓LSK细胞凋亡影响:健康对照组和富氢水组小鼠骨髓LSK细胞分别有6.20%和5.94%发生凋亡,但差异无统计学意义 (P > 0.05)。照射组小鼠骨髓LSK细胞的凋亡率为20.68%,显著高于健康对照组 (t=-5.111,P<0.05)。照射+富氢水组小鼠骨髓LSK细胞的凋亡率为9.35%,显著高于照射组 (t=3.954,P<0.05),见图 3。
|
图 3 富氢水抑制辐射诱导的骨髓LSK细胞的凋亡 Figure 3 The anti-apoptosis effect of hydrogen-rich water on irradiated LSK cells |
讨论
H2主要通过清除羟自由基发挥抗氧化活性,可抑制电离辐射引起的ROS水平的升高,对受照细胞、心血管组织、生殖系统、血液系统、肺组织、小肠组织及整体动物均有显著地辐射防护作用[3-8]。Chuai等[4]发现,富H2溶液使受照小鼠外周血白细胞、脾结节及骨髓细胞克隆形成数量增加;而秦秀军等[9]发现富氢水改善了受照小鼠的脾脏指数、胸腺指数和骨髓有核细胞数量,提示富氢水可缓解电离辐射引起的损伤。本研究证实富氢水对电离辐射诱导的HSPCs损伤具有保护作用。
Liu等[10]发现大鼠口服富氢水后5 min,H2在血液、肝脏、肾脏、心脏、脾脏、肠道、肌肉、脑组织中的浓度达到最大并缓慢下降。因此,本研究在照射前5 min为小鼠灌喂富氢水。本研究将所有LSK和HPC均认为是HSPCs,而LSK有CD34-LSK和CD34+LSK两种类型,CD34+LSK主要负责辐射后短期的重建造血[1]。HSPCs具有自我更新和定向分化潜能,作为储备可防止各种应激下造血系统的耗竭。电离辐射可刺激HSPCs进行增殖和分化以维持造血稳态,但是也会引起HSPCs自我更新和分化能力的损伤,导致持久性的骨髓损伤[1]。本研究中,2 Gy的全身照射使小鼠骨髓中HPC和LSK细胞数量明显下降,而富氢水使受照小鼠骨髓中HPC、LSK、CD34+LSK细胞数量显著升高,抑制了HSPCs的耗竭。CFU-GM是评价HSPCs体外增殖能力的一个指标,全身照射使小鼠骨髓细胞CFU-GM数量减少,而富氢水提高了受照小鼠HSPCs的增殖能力,结果与文献报道一致[4]。另外,本研究首次发现富氢水可以明显提高骨髓移植后受体小鼠的嵌合率,增强受照HSPCs的移植重建能力,提示富氢水也可改善电离辐射诱导的长期骨髓损伤。
为探索富氢水保护HSPCs的机制,本研究检测了骨髓LSK细胞的ROS水平和细胞凋亡情况。电离辐射可引起水的解离,产生过量的ROS,如羟自由基、超氧阴离子、过氧化氢。研究已发现电离辐射会导致HSPCs的慢性氧化应激,其原因可能是电离辐射持续抑制细胞内SOD2、GPX1等抗氧化酶的表达[11],而造血微环境的改变可能也是辐射15 d后HSPCs内ROS持续偏高的原因之一[1]。ROS在电离辐射诱导的HSPCs损伤中起着重要的作用,可诱导细胞DNA损伤、细胞凋亡和衰老,有研究报道,ROS还与电离辐射诱导的HSPCs的耗竭和自我更新能力的损伤有关[11-13]。本研究中,全身照射使小鼠骨髓LSK细胞凋亡增加,而富氢水抑制了受照的LSK细胞的凋亡,可能有利于HSPCs数量和功能的恢复。全身照射还使小鼠骨髓LSK细胞ROS水平升高,富氢水有助于清除受照LSK细胞内的ROS,从而减少氧化应激、抑制ROS对HSPCs的损伤。富氢水的ROS清除作用可能与其抑制HSPCs的凋亡、促进HSPCs自我更新和移植重建能力的恢复有关。除了清除HSPCs内的ROS,富氢水可能还通过调节Keap1-Nrf2信号通路及细胞内抗氧化酶的活性等保护受照的HSPCs[14]。目前本实验室正在对其分子机制进行深入研究中。
总之,本研究证实了富氢水对电离辐射诱导的HSPCs损伤具有保护作用,为其成为辐射防护剂提供了新的实验证据。本研究从富氢水对电离辐射诱导HSPCs损伤的角度说明其具有辐射防护作用,但这种保护作用的分子机制及其对骨髓微环境等其他方面的作用,尚需更深入的研究。
利益冲突 无潜在利益冲突作者贡献声明 韩晓丹参与实验设计、研究实施、数据分析和论文撰写;薛晓蕾参与实验设计、研究实施和数据采集;张俊伶参与实验设计、研究实施、数据分析和论文修改;樊赛军参与实验设计、数据分析和论文修改
| [1] | Shao L, Luo Y, Zhou D. Hematopoietic stem cell injury induced by ionizing radiation[J]. Antioxid Redox Signal, 2014, 20 (9): 1447-1462. DOI:10.1089/ars.2013.5635. |
| [2] |
秦秀军, 张伟, 李建国, 等. 氢气对电离辐射损伤防护作用的研究进展[J].
中国辐射卫生, 2012, 21 (2): 242-243. Qin XJ, Zhang W, Li JG, et al. Progress on study of protection effect of hydrogen against ionizing radiation[J]. Chin J Radiol Health, 2012, 21 (2): 242-243. |
| [3] | Terasaki Y, Ohsawa I, Terasaki M, et al. Hydrogen therapy attenuates irradiation-induced lung damage by reducing oxidative stress[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301 (4): L415-426. DOI:10.1152/ajplung.00008.2011. |
| [4] | Chuai Y, Shen J, Qian L, et al. Hydrogen-rich saline protects spermatogenesis and hematopoiesis in irradiated BALB/c mice[J]. Med Sci Monit, 2012, 18 (3): BR89-94. |
| [5] | Jiang Z, Xu B, Yang M, et al. Protection by hydrogen against γ-ray-induced testicular damage in rats[J]. Basic Clin Pharmacol Toxicol, 2013, 112 (3): 186-191. DOI:10.1111/bcpt.12016. |
| [6] | Qian L, Cao F, Cui J, et al. Radioprotective effect of hydrogen in cultured cells and mice[J]. Free Radic Res, 2010, 44 (3): 275-282. DOI:10.3109/10715760903468758. |
| [7] | Qian L, Cao F, Cui J, et al. The potential cardioprotective effects of hydrogen in irradiated mice[J]. J Radiat Res, 2010, 51 (6): 741-747. DOI:10.1269/jrr.10093. |
| [8] | Guo J, Zhao D, Lei X, et al. Protective effects of hydrogen against low-dose long-term radiation-induced damage to the behavioral performances, hematopoietic system, genital system, and splenic lymphocytes in mice[J]. Oxid Med Cell Longev, 2016, 2016 : 1947819 DOI:10.1155/2016/1947819. |
| [9] |
秦秀军, 田宇, 安全, 等. 富氢水对小鼠辐射损伤的保护作用[J].
辐射防护通讯, 2013 (4): 28-33. Qin XJ, Tian Y, An Q, et al. Study on the protective effects of hydrogen-rich water given against radiation injury in mice[J]. Radiat Prot Bull, 2013 (4): 28-33. DOI:10.3969/j.issn.1004-6356.2013.04.006. |
| [10] | Liu C, Kurokawa R, Fujino M, et al. Estimation of the hydrogen concentration in rat tissue using an airtight tube following the administration of hydrogen via various routes[J]. Sci Rep, 2014, 4 : 5485 DOI:10.1038/srep05485. |
| [11] | Zhang H, Zhai Z, Wang Y, et al. Resveratrol ameliorates ionizing irradiation-induced long-term hematopoietic stem cell injury in mice[J]. Free Radic Biol Med, 2013, 54 : 40-50. DOI:10.1016/j.freeradbiomed.2012.10.530. |
| [12] | Hayashi T, Hayashi I, Shinohara T, et al. Radiation-induced apoptosis of stem/progenitor cells in human umbilical cord blood is associated with alterations in reactive oxygen and intracellular pH[J]. Mutat Res, 2004, 556 (1-2): 83-91. DOI:10.1016/j.mrfmmm.2004.07.002. |
| [13] | Shao L, Li H, Pazhanisamy SK, et al. Reactive oxygen species and hematopoietic stem cell senescence[J]. Int J Hematol, 2011, 94 (1): 24-32. DOI:10.1007/s12185-011-0872-1. |
| [14] |
张沛. 分子氢在电离辐射防护作用中的机制研究[D]. 上海: 第二军医大学, 2015.
Zhang P. Study on mechanism of molecular hydrogen in ionizing radiation protection[D]. Shanghai: Second Military Medical College, 2015. |
 2017, Vol. 37
2017, Vol. 37


