肺癌是全球最常见的癌症之一,位列2015年中国常见癌症发病率及死亡率的第1位[1]。其中,非小细胞肺癌 (non-small cell lung cancer, NSCLC) 最常见,约占全部肺癌病例的80%;Ⅰ期患者约占NSCLC的10%~15%。手术是早期NSCLC的标准治疗,Ⅰ期NSCLC患者术后局部控制率可达90%,5年总生存率为45%~65%[2]。对无法耐受或拒绝手术的早期NSCLC患者,使用常规光子线 (高能X射线等) 的立体定向体部放疗 (stereotactic body radiotherapy, SBRT) 逐渐成为标准治疗[3]。
与常规光子线相比,粒子线 (质子和碳离子) 具有物理剂量分布优势 (布拉格峰),碳离子更兼有高线性能量传递的特点,具有更高的相对生物效应和更低的氧增强比,增加治疗安全性的同时,有可能进一步提高对肿瘤的杀伤效应[4]。因此,粒子线近年来获得了越来越广泛的临床应用[5],但在早期肺癌中的应用仍然以被动散射技术为主。本研究将首次在国内报道采用质子碳离子笔形束扫描技术 (pencil beam scanning,PBS) 治疗Ⅰ期NSCLC的不良反应和近期疗效。
资料与方法1.患者一般资料:2014年8月至2015年12月,共收治了10例早期NSCLC患者,其中男性7例,女性3例;年龄63~78岁,中位年龄75.5岁。病理证实腺癌7例,鳞癌1例,未分类非小细胞肺癌2例。中位肿瘤直径3.0 cm (1.1~5.0 cm),其中ⅠA期6例,ⅠB期4例。根据肿瘤和任一关键器官 (脊髓、食管、主支气管树、心脏或大血管) 的距离,将病灶分为3类,距离≥2 cm的周围型4例,距离 < 1 cm的中央型3例,介于两者之间的中间型3例。所有患者均不适合或拒绝手术,包括:严重的冠状动脉狭窄伴心功能差1例,慢性肺间质疾病致肺功能差1例,血氧饱和度低1例,巨大弥漫性肺大疱2例,既往肺部手术史使得二次手术风险较高2例,以及≥75岁5例。患者的临床特征及治疗方案列于表 1。
|
|
表 1 10例早期非小细胞肺癌患者临床特征及治疗方案 Table 1 Characteristics of 10 patients with stage Ⅰ non-small cell lung cancer |
2.放疗方法:定位前对患者进行模拟机透视下呼吸评估,肿瘤随呼吸活动超过5 mm者需采用呼吸控制技术使肿瘤残余运动减少至5 mm以下。最终8例患者使用呼吸门控技术 (gating) 控制呼吸运动,1例使用主动呼吸控制技术 (active breath control,ABC),1例在自由呼吸 (free breathing,FB) 状态下接受放疗。
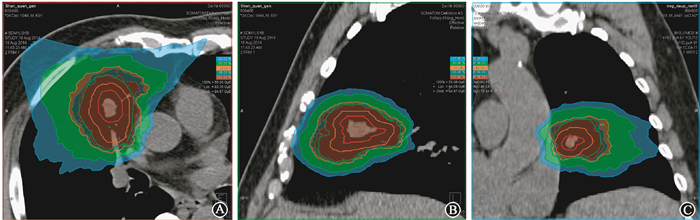
根据肿瘤位置采取仰卧位或俯卧位以适应固定射野出束,使用真空垫、热塑膜等固定患者体位。定位CT采用普通CT (采用FB/ABC患者) 或四维CT (gating患者) 扫描,不使用造影剂。扫描范围覆盖肿瘤、全肺和放射野所经过的全部解剖部位。根据定位CT、诊断CT及PET/CT影像,决定大体肿瘤体积 (gross tumor volume/internal gross tumor volume,GTV/iGTV);临床靶区体积 (clinical target volume,CTV) 为GTV/iGTV外放5~10 mm,包括亚临床病灶及肿瘤残余运动;计划靶区体积 (planning target volume,PTV) 包括CTV和3 mm摆位误差及粒子照射的射程不确定性 (stopping power uncertainty)。处方和正常组织限量均采用光子等效生物剂量 (equivalent dose to Gy of photon, GyE)。计划要求100%处方剂量线包绕99%GTV,95%处方剂量线包绕99%CTV,90%处方剂量线包绕90%PTV,典型靶区剂量分布示于图 1。
|
图 1 1例T1N0M0早期非小细胞肺癌患者的质子调强放疗IMPT计划剂量分布图 A.横断面;B.矢状位;C.冠状位 Figure 1 The dose distribute for typical intensity modulated proton therapy (IMPT) treatment plan of a patient with T1N0M0 non-small cell lung cancer A.Transverse view; B. Sagittal view; C. Coronal view |
同时勾画正常组织及危及器官,如脊髓、肺、食管、近端支气管树、心脏等,正常组织剂量限值参考美国国家综合癌症网络 (NCCN) 指南肺癌光子放疗参数,最终各危及器官受照剂量列于表 2。
|
|
表 2 早期非小细胞肺癌患者质子碳离子放疗危及器官的受照剂量 Table 2 Dose volume histogram parameters of organs at risk in proton and carbon-ion radiotherapy of stage Ⅰ non-small cell lung cancer |
使用IONTRIS®粒子放射治疗系统,质子 (30~250 MeV)、碳离子 (85~430 MeV) PBS技术,2~4个射野照射。本研究使用的PBS技术将治疗靶区划分为一个三维立体网格,通过回旋加速器系统磁铁形成窄的笔形束,在每个网格内放置布拉格峰,给予每一个格点特定的剂量。治疗计划系统可以对高达数千个不同面积大小、能量、强度和位置的笔形束进行优化加权,通过形成单个或者数个治疗照射野进行剂量叠加,对不同三维立体形状的靶区输出目标剂量,相当于通过可以调节能量的点扫描、实现对靶区更加适形的目的。每次放疗实施前拍摄正交X射线片,按骨性标志进行配准,使用六维治疗床在线校正摆位误差,确保摆位误差不超过3 mm。10例患者中,4例周围型接受50~70 GyE/10次质子放疗,3例中间型60~64 GyE/15~16次 (1例质子,2例质子:碳离子= 1:1),3例中央型66~72 GyE/22~24次 (1例质子,2例质子:碳离子=2:1)。
3.随访与评估:放疗中每周对患者进行一次不良反应评估,放疗结束后1个月进行第1次随访,3个月第2次随访,此后每3个月1次;第2年每4个月1次;2年后每6个月1次。随访内容包括肿瘤情况和不良反应评估,使用CT扫描、根据实体瘤疗效评价标准 (RESIST 1.1) 评估患者疗效,采用常见不良反应事件评价标准4.0(CTCAE 4.0) 及急性放射损伤分级4.0(RTOG 4.0) 标准,分别评估患者的急性及远期不良反应。
4.统计学处理:肺功能数据以x±s表示。数据比较采用配对样本非参数检验;生存分析采用Kaplan-Meier法进行;使用SPSS 16.0软件进行分析。P < 0.05为差异有统计学意义。
结果1.近期疗效:10例患者均按计划完成治疗,中位随访时间为18.1(11.9~28.1) 个月。在2016年12月完成末次随访时,患者均存活且局部病灶均受控,分别为6例完全缓解 (CR)、3例部分缓解 (PR) 和1例疾病稳定 (SD)。2例ⅠB期患者 (PR及SD) 在放疗结束后8.7和24.9个月分别出现远处转移 (腹壁、肺内)。1年无进展生存率为88.9%,1年总生存率及局部无进展生存率为100%。
2.放疗不良反应:放疗开始起3个月内未观察到CTCAE 3级及以上放疗相关急性不良反应,2级反应仅为1例放射性皮炎,患者因个人原因,最后1天放疗接受2次3 GyE的放疗,经处理1周后恢复。1例外周血白细胞降低,患者治疗前为1级白细胞降低,治疗后3个月恢复至正常范围。所有不良反应除放射性肺炎外均在治疗后1个月内缓解。放疗开始起3个月后的晚期不良反应,10例患者中仅观察到RTOG 1级放射性纤维化6例,未发现2级及以上的晚期不良反应 (表 3)。
|
|
表 3 早期非小细胞肺癌质子碳离子放疗相关不良反应 Table 3 Toxicity of proton and carbon-ion radiotherapy for patients with stage Ⅰnon-small cell lung cancer |
3.患者治疗前、放疗结束后1和3~5个月的肺功能指标:用力肺活量 (FVC) 分别为 (2.46±1.04)、(2.47±0.84) 和 (2.42±0.92) L,第1秒用力呼气量 (FEV1) 分别为 (1.87±0.83)、(1.92±0.64) 和 (1.93±0.75) L,CO弥散量 (DLCO-sb) 分别为 (14.79±1.04)、(15.99±3.46) 和 (17.40±5.45) ml·mm Hg-1·min-1,略有上升,但差异无统计学意义 (P > 0.05)。
讨论对于Ⅰ期非小细胞肺癌,SBRT是手术风险大或拒绝手术患者的首选治疗手段。尽管不同研究中SBRT的分割方式各不相同,一般认为生物等效剂量 (biological effective dose,BED) 达到100 Gy及以上,3年局部控制率可达87%~97%;3年总生存率达43%~71%,3级或以上的放疗不良反应发生率约10%(1%~16%)[6-8]。
质子重离子放疗由于其布拉格峰的存在,理论上比光子放疗有更大的剂量学优势,并获得了很多剂量学对比研究的证实。Macdonald等[9]研究发现,治疗早期周围型肺癌,使用被动散射技术的质子放疗 (passive scattering proton therapy,PSPT) 较SBRT有更为均匀的靶区 (PTV) 剂量分布及更好的肺、脊髓、心脏、食管等正常组织的保护;而使用PBS技术实现的质子调强放疗 (intensity modulated proton therapy,IMPT) 对靶区的优化及肺等正常组织的保护较PSPT更优。此外,对早期中央型肺癌患者的SBRT、PSPT及IMPT计划对比研究也显示,IMPT较PSPT及SBRT有更高的比例可以实现严格的靶区覆盖及正常组织限量[10]。
目前,国际上发表的早期肺癌粒子放疗的临床结果均为采用被动散射技术,而非PBS技术。2010年一项荟萃分析比较光子常规放疗、SBRT及粒子放疗的临床疗效显示,质子及碳离子放疗2年/5年校正的总生存为61%/40%及74%/42%,与SBRT相似 (70%/42%)(P > 0.05),均远高于常规光子放疗 (53%/20%,P < 0.05)。同时粒子放疗显示了较SBRT更低的严重 (3~5级) 治疗不良反应发生率,与常规放疗相似[11]。此后更多的PSPT和被动散射碳离子放疗 (passive scattering carbon therapy,PSCT) 的临床研究显示出与SBRT相当的疗效和更低的严重不良反应发生率:质子、碳离子放疗使用77~150 GyE (BED10) 的生物等效剂量下,3年局部控制率达78%~96%,总生存率达61%~90%;5年总生存率达45%~66%,3级或以上的放疗不良反应发生率基本 < 10%;其中碳离子治疗的不良反应更低,仅有一项研究中的不良反应达10%(4/41),其余研究显示3级以上放射性损伤 < 2%[12-18]。
目前, 国内外尚未见采用PBS技术质子或碳离子射线治疗早期肺癌的临床报道。作为在国际上较早采用粒子PBS技术治疗早期肺癌的机构,这是国内首次报道采用该技术治疗早期NSCLC的临床治疗结果。PBS技术在肺癌中的应用研究要远远落后于在头颈部或者前列腺恶性肿瘤中的应用,主要是由于业界担心PBS的轨迹和肺部肿瘤随呼吸的运动不匹配,从而导致剂量分布的不准确。本研究采用ABC或者Gating技术控制肿瘤残余运动不超过5 mm,从而极大地限制了肿瘤在治疗中的活动。结果显示,1年无进展生存率89%,1年局部无进展生存率100%,1年总生存率100%。随访终点时观察到较高的局部控制率 (100%) 及较低的治疗不良反应,短期随访显示该技术安全、有效。与Nihei等[19]研究结果相似,他们的研究中,37例Ⅰ期NSCLC患者接受质子放疗70~94 GyE/20次 (BED10=95~138 Gy),1年无进展生存率为73%,1年局部无进展生存率91%,2年总生存率84%。本研究中,完全缓解率及复发转移率也和Hata等[20]的研究相似 (分别为60% vs. 66.7%和20% vs. 23.8%)。后者采用质子线50~60 GyE/10次 (BED10=75~96 Gy) 治疗21例周围型Ⅰ期NSCLC患者,其结果显示2年无进展生存率为79%,2年总生存率74%,没有发现3级及以上的不良反应。从目前的短期随访结果看,PBS粒子放疗的临床疗效和不良反应均和PSPT或PSCT类似,不良反应甚至可能更少:仅观察到2例2级反应,分别为皮肤反应和白细胞降低,且均有特殊情况,最后1天2次照射和放疗前的白细胞1级降低。
然而,相比SBRT,粒子放疗经验相对不足,多采用更保守的分割方案 (更多照射次数),特别是对于中央型早期肺癌[13-14]。本研究中采取的处方也相对保守 (周围型病灶BED10不超过119 GyE、非周围型则在84~93.6 GyE),但近期随访所获极低的放疗不良反应和较好的局部控制率,使粒子PBS技术在治疗早期肺癌上的前景值得期待。
综上,对因各种合并症导致手术风险非常大的Ⅰ期非小细胞肺癌患者,质子碳离子笔形扫描技术治疗短期内安全、有效。远期疗效和不良反应需要进一步长时间的随访观察。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 麻宁一负责治疗方案实施、结果分析、论文撰写与修改;茅静芳负责制定患者治疗方案和指导论文写作;陈剑、蔡昕负责患者临床诊疗、靶区勾画及资料收集;蒋国梁负责制定患者治疗方案;陆嘉德指导论文写作
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66 (2): 115-132. DOI:10.3322/caac.21338. |
| [2] | Medford-Davis L, Decamp M, Recht A, et al. Surgical management of early-stage non-small cell lung arcinoma and the present and future roles of adjuvant therapy: a review for the radiation oncologist[J]. Int J Radiat Oncol Biol Phys, 2012, 84 (5): 1048-1057. DOI:10.1016/j.ijrobp.2012.03.018. |
| [3] | Vansteenkiste J, De Ruysscher D, Eberhardt WE, et al. Early and locally advanced non-small cell lung cancer (NSCLC): ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013, 24 Suppl 6 : vi89-98. DOI:10.1093/annonc/mdt241. |
| [4] | Durante M, Loeffler JS. Charged particles in radiation oncology[J]. Nat Rev Clin Oncol, 2010, 7 (1): 37-43. DOI:10.1038/nrclinonc.2009.183. |
| [5] |
蒋国梁. 质子和重离子放疗在中国[J].
中华放射医学与防护杂志, 2016, 36 (8): 561-563. Jiang GL. Proton and heavy ion radiotherapy in China[J]. Chin J Radiol Med Prot, 2016, 36 (8): 561-563. DOI:10.3760/cma.j.issn.0254-5098.2016.08.001. |
| [6] | Fakiris AJ, McGarry RC, Yiannoutsos CT, et al. Stereotactic body radiation therapy for early-stage non-small-cell lung carcinoma: four-year results of a prospective phase Ⅱ study[J]. Int J Radiat Oncol Biol Phys, 2009, 75 (3): 677-682. DOI:10.1016/j.ijrobp.2008.11.042. |
| [7] | Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303 (11): 1070-1076. DOI:10.1001/jama.2010.261. |
| [8] | Chang JY, Li QQ, Xu QY, et al. Stereotactic ablative radiation therapy for centrally located early stage or isolated parenchymal recurrences of non-small cell lung cancer: how to fly in a "no fly zone"[J]. Int J Radiat Oncol Biol Phys, 2014, 88 (5): 1120-1128. DOI:10.1016/j.ijrobp.2014.01.022. |
| [9] | Macdonald OK, Kruse JJ, Miller JM, et al. Proton beam radiotherapy versus three-dimensional conformal stereotactic body radiotherapy in primary peripheral, early-stage non-small-cell lung carcinoma: a comparative dosimetric analysis[J]. Int J Radiat Oncol Biol Phys, 2009, 75 (3): 950-958. DOI:10.1016/j.ijrobp.2009.04.023. |
| [10] | Register SP, Zhang X, Mohan R, et al. Proton stereotactic body radiation therapy for clinically challenging cases of centrally and superiorly located stage Ⅰ non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 80 (4): 1015-1022. DOI:10.1016/j.ijrobp.2010.03.012. |
| [11] | Grutters JP, Kessels AG, Pijls-Johannesma M, et al. Comparison of the effectiveness of radiotherapy with photons, protons and carbon-ions for non-small cell lung cancer: a meta-analysis[J]. Radiother Oncol, 2010, 95 (1): 32-40. DOI:10.1016/j.radonc.2009.08.003. |
| [12] | Bush DA, Cheek G, Zaheer S, et al. High-dose hypofractionated proton beam radiation therapy is safe and effective for central and peripheral early-stage non-small cell lung cancer: results of a 12-year experience at Loma Linda University Medical Center[J]. Int J Radiat Oncol Biol Phys, 2013, 86 (5): 964-968. DOI:10.1016/j.ijrobp.2013.05.002. |
| [13] | Kanemoto A, Okumura T, Ishikawa H, et al. Outcomes and prognostic factors for recurrence after high-dose proton beam therapy for centrally and peripherally located stage Ⅰ non-small-cell lung cancer[J]. Clin Lung Cancer, 2014, 15 (2): e7-12. DOI:10.1016/j.cllc.2013.11.002. |
| [14] | Makita C, Nakamura T, Takada A, et al. High-dose proton beam therapy for stage Ⅰ non-small cell lung cancer: Clinical outcomes and prognostic factors[J]. Acta Oncol, 2015, 54 (3): 307-314. DOI:10.3109/0284186X.2014.948060. |
| [15] | Miyamoto T, Baba M, Yamamoto N, et al. Curative treatment of stage Ⅰ non-small-cell lung cancer with carbon ion beams using a hypofractionated regimen[J]. Int J Radiat Oncol Biol Phys, 2007, 67 (3): 750-758. DOI:10.1016/j.ijrobp.2006.10.006. |
| [16] | Miyamoto T, Baba M, Sugane T, et al. Carbon ion radiotherapy for stage Ⅰ non-small cell lung cancer using a regimen of four fractions during 1 week[J]. J Thorac Oncol, 2007, 2 (10): 916-926. DOI:10.1097/JTO.0b013e3181560a68. |
| [17] | Iwata H, Murakami M, Demizu Y, et al. High-dose proton therapy and carbon-ion therapy for stage Ⅰ non-small cell lung cancer[J]. Cancer, 2010, 116 (10): 2476-2485. DOI:10.1002/cncr.24998. |
| [18] | Fujii O, Demizu Y, Hashimoto N, et al. A retrospective comparison of proton therapy and carbon ion therapy for stage Ⅰ non-small cell lung cancer[J]. Radiother Oncol, 2013, 109 (1): 32-37. DOI:10.1016/j.radonc.2013.08.038. |
| [19] | Nihei K, Ogino T, Ishikura S, et al. High-dose proton beam therapy for stage Ⅰ non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2006, 65 (1): 107-111. DOI:10.1016/j.ijrobp.2005.10.031. |
| [20] | Hata M, Tokuuye K, Kagei K, et al. Hypofractionated high-dose proton beam therapy for stage Ⅰ non-small-cell lung cancer: preliminary results of a phase Ⅰ/Ⅱ clinical study[J]. Int J Radiat Oncol Biol Phys, 2007, 68 (3): 786-793. DOI:10.1016/j.ijrobp.2006.12.063. |
 2017, Vol. 37
2017, Vol. 37


