放射治疗作为恶性肿瘤的三大治疗手段之一,在多种实体瘤的治疗中发挥着重要作用。精确放疗技术的不断推陈出新,使得射线越来越精准地定位于肿瘤,显著提高了放疗在肿瘤治疗中的疗效和地位[1]。然而,肿瘤细胞放射抗性的存在成为制约放疗疗效的主要因素之一。研究表明,放射抗性的形成涉及凋亡基因的调控、DNA损伤修复能力[2]、乏氧[3]、细胞周期状态[4]以及多种分子信号通路的改变[5]。随着放射抗性研究的日益深入,与放射抗性相关的分子信号通性的研究受到学者的关注。Wnt通路是参与多种细胞功能的较活跃的信号通路,其与放射抗性形成的关系近年来也逐渐受到重视。本文就Wnt通路在放射抗性形成中的最新进展进行归纳梳理,力求发现某些相关联的分子机制,为深入研究Wnt通路与放射抗性的关系寻找有价值的线索。
一、 Wnt信号通路概述Wnt基因于1982年在小鼠乳腺癌中被发现,Wnt家族由一系列分泌性的蛋白构成,是细胞内重要的信号分子,具有广泛的生物功能,参与细胞生成、生长、分化及器官形成等生理过程[6]。根据Wnt蛋白在细胞或动物体内作用的模式,可以分为经典和非经典Wnt蛋白两类[7]。
经典Wnt信号转导通路是通过Wnt蛋白 (如Wntl、Wnt3a、Wnt8、Wntl0b等) 与跨膜受体Frizzled家族和LRP5/LRP6辅助受体结合而被激活。接受信号的Frizzled激活细胞质中Dishevelled蛋白,后者再激活下游因子GSK-3β结合蛋白 (GBP),激活的GBP能识别并抑制GSK-3β的磷酸化活性,使β-连环蛋白不被磷酸化进而在胞质中大量积累而进入核内,与转录因子 (淋巴细胞增强因子/T细胞因子LEF/TCF) 家族及Legless蛋白 (BCL9和BCL9L) 和PYGO结合形成复合物,并启动下游靶基因的表达。此即β-连环蛋白聚集的靶基因调控级联反应过程[8],因此,β-连环蛋白是经典Wnt信号通路上一个重要的下游调节者。
非经典Wnt信号转导通路不涉及β-连环蛋白,该通路信号被转导是通过Frizzled家族受体和ROR2/RYK联合受体结合到Dishevelled依赖 (Rho family GTPases和c-jun NH2-terminal kinase) 或Ca2+依赖的信号级联反应,并与细胞极性信号通路重叠[9]。非经典Wnt通路与细胞极性的建立、细胞骨架重排及细胞运动和黏着性有着重要的调节作用,而与肿瘤关系研究较少。
二、 经典wnt信号通路参与肿瘤放射抗性形成放射抗性作为肿瘤放疗失败的主要原因备受关注,而经典Wnt通路与肿瘤放射抗性形成密切相关,成为近几年的研究热点。Wnt/β-连环蛋白信号通路通过影响肿瘤细胞的细胞周期、细胞增殖、DNA损伤修复、细胞凋亡、侵袭等参与了肿瘤放射抗性形成。
1.细胞周期:细胞处于不同细胞周期时放射敏感性不同,通常G2/M期细胞对射线最敏感,G0/G1期次之,S期对射线最抗拒,静止期癌细胞可能是导致肿瘤放射抗性增加和肿瘤放射治疗后复发的主要细胞学基础[10]。熊伟等[11]利用基因芯片技术筛选两对细胞TE13和TE13R、KYSE170和KYSE170R在放射线照射前后基因表达的差异中发现,在接受照射后,抵抗细胞系中LEF1及CTNNB1的表达较亲代细胞系均有上调,而KYSE170R在照射后发生G2期阻滞较KYSE170更明显,研究人员猜测LEF1和CTNNB1可能通过经典Wnt通路,改变食管癌细胞照射后的细胞周期,导致细胞发生G2期阻滞,发挥放射抵抗作用。Zhang等[12]在对非小细胞肺癌细胞H1299和H1975研究中,使用一种新型小分子抑制剂BC-23(C21H14ClN3O4S), 其作用靶点为β-Catenin/Tcf4,能够有效抑制经典wnt通路,下调c-Myc与Cyclin D1表达,使对射线抵抗性最强的S期下降,进而提高放射敏感性。综上所述,Wnt/β-连环蛋白信号通路可能参与肿瘤细胞周期再分布,通过使肿瘤细胞S期比例上升或是发生G2期阻滞进而导致放射抗性增强。
2.细胞增殖:细胞异常增殖是肿瘤的重要特征之一,也是肿瘤病例及临床评估肿瘤恶性程度及肿瘤行为学的重要信息。放疗过程中,肿瘤细胞的加速再增殖,是产生放射抗性的重要原因[13]。苏华芳等[14]与李海英等[15]在对食管癌放射抗拒细胞KYSE-150R及其亲本细胞KYSE-150研究中发现,相对于KYSE-150,KYSE-150R细胞中经典Wnt信号通路相关基因表达明显上调,其中β-连环蛋白表达增多导致其参与调控的下游蛋白Cyclin D1和WISP1表达升高,使得KYSE-150R细胞表现出更强的增殖能力,并且李海英等[15]通过小鼠体内实验证实,食管癌放射抗性细胞在小鼠体内能够表现出更强的增殖和成瘤能力,提示经典Wnt通路的激活促进了食管放射抵抗细胞系KYSE-150R细胞的增殖。Che等[16]研究环氧合酶-2(COX-2) 抑制剂NS398(对甲磺基苯一环乙醚) 对放射抗拒食管癌细胞系Eca109R50Gy的放射增敏作用发现,Eca109R50Gy细胞具有干细胞的一些性质,其表现出更高的增殖能力和集落形成能力,使用NS398可增强Eca109R50Gy细胞放射敏感性并伴随着β-连环蛋白表达下调,下游靶基因COX-2表达降低,推测NS398可能通过抑制经典wnt信号通路增加了放射敏感性。Su等[17]的研究显示,特异性β-连环蛋白/TCF抑制剂明显降低放射抗性食管鳞癌细胞KYSE-150R放射抗性,并且发现其主要原因是由于FH535特异性阻断经典Wnt信号通路,使下游蛋白CTNNB1和Cyclin D1的表达明显降低,致使细胞增殖能力降低,并伴随KYSE-150R的上皮间质转化 (epithelial mesenchymal transition, EMT) 过程逆转,最终引起KYSE-150R细胞放射敏感性增强。Lee等[18]发现使用经典Wnt通路抑制剂GDK-100017(2, 3, 6-喹喔啉衍生物) 阻断β-连环蛋白-TCF/LEF相互作用,使经典Wnt通路靶基因Cyclin D1和Dkk1表达下调,可以抑制人非小细胞肺癌细胞A549的增殖活性,提高放射敏感性。Wu等[19]研究显示,敲低人非小细胞肺癌细胞A549中甲状腺癌相关基因1(Thyroid cancer 1,TC-1) 联合照射,经典Wnt通路明显受到抑制, 该通路靶基因c-myc, c-met及CyclinD1表达下调,并明显降低细胞增殖, 证明TC-1通过经典Wnt信号通路影响肺癌细胞放射抗性。综上,经典wnt信号通路的激活可以通过加速肿瘤细胞增殖提高该肿瘤细胞的放射抗性。
3. DNA损伤修复:DNA双链断裂损伤是电离诱发细胞最为严重的分子损伤类型,是照射细胞凋亡的直接原因,而DNA双链断裂损伤残留是决定细胞放射敏感性的一个重要分子指标[20]。在众多的DNA修复基因中,Jun等[21]发现,Wnt/β-连环蛋白信号转导通路的激活可以上调人类结直肠癌细胞中LIG4(DNA连接酶4) 的表达,且LIG4的表达受β-连环蛋白调控,而LIG4的上调与人类结直肠癌细胞的放射抗性存在密切关系,其机制可能与LIG4能使DNA双链断裂的非同源末端链接修复能力增强有关。反之,阻断LIG4的表达可使人结直肠癌细胞的放射敏感性增强。Chang等[22]利用siRNA对具有放射抗拒性人喉癌细胞株AMC-HN-9进行RNA干扰,沉默蛋白β-连环蛋白的表达,发现发生β-连环蛋白沉默的AMC-HN-9经照射后其放射抗性较对照组细胞显著下降;同时,作为DNA损伤修复发起因子的Ku70/80,在经照射且β-连环蛋白蛋白沉默的喉癌细胞系AMC-HN-9中表达明显减少;而β-连环蛋白蛋白沉默激活了LKB1/AMPK,因此研究者猜测LKB1/AMPK信号通路可能参与介导Wnt/β-连环蛋白通路和KU70/Ku80 DNA损伤修复机制。Zhang等[23]研究发现,Wnt诱导的分泌型蛋白1(WISP1) 作为经典Wnt信号通路的下游关键靶基因,被认为是食管癌放疗后的预后指标,其功能获得和缺失实验证实WISP1在食管鳞癌细胞和裸鼠移植瘤模型中均可介导辐射抗性。进一步研究发现,当电离辐射诱导的DNA双链断裂 (DSBs) 导致组蛋白H2AX迅速发生磷酸化时,WISP1能使磷酸化组蛋白2(γ-H2AX) 直接去磷酸化,γ-H2AX对信号和修复蛋白聚集并保持在DSBs位点是必不可少的,并且在DNA修复中起着重要作用,因此推测经典Wnt信号通路激活后可通过WISP1参与DNA损伤修复进而参与食管癌放射抗性形成。Su等[17]不仅证实了特异性β-连环蛋白/TCF抑制剂FH535能降低放射抗性食管鳞癌细胞KYSE-150R增殖能力,使其放射敏感性增加,并且通过彗星实验证实FH535作用于KYSE-150R后通过阻断经典wnt信号通路,使靶基因Cyclin D1表达下调,削弱其DNA损伤修复能力,使其放射敏感性增加。上述研究均提示,肿瘤细胞中经典Wnt信号通路的激活可能通过上调DNA连接酶Ⅳ、Ku70/80、WISP1的表达等多种方式,增强细胞的DNA损伤修复能力,进而诱导放射抗性的产生。
4.细胞凋亡:一般认为,凋亡反应的提高提示细胞有更高的放射敏感性,增加凋亡反应的同时伴随着细胞敏感性的增加,因此有学者将诱导凋亡水平作为肿瘤放射敏感性衡量指标[24]。Wang等[25]利用表达谱分析发现相较癌旁细胞及组织,lincRNA-p21在结直肠癌细胞及组织中表达降低,并伴随β-连环蛋白表达升高。此外研究还发现,接受X射线照射后的结直肠癌细胞lincRNA-p21表达上调,而lincRNA-p21过表达使凋亡细胞增多进而使放射敏感性增强。进一步研究发现,lincRNA-p21过表达可抑制β-连环蛋白表达,阻断经典Wnt通路,使β-连环蛋白及下游靶基因c-myc、cyclin D1表达降低,通过促进细胞凋亡而使放射敏感性增强。Wu等[19]发现,敲低非小细胞肺癌细胞A549中甲状腺癌相关基因1(thyroid cancer 1,TC-1) 后辐射,随着经典Wnt通路受到明显抑制,靶基因c-myc, c-met及cyclin D1表达下调,不仅抑制肿瘤细胞的增殖,细胞凋亡也明显增多。以上证明,经典Wnt信号通路的激活可能通过降低肿瘤细胞的凋亡诱导放射抗性的产生,但其参与凋亡过程的具体分子机制仍不甚清楚。
5.细胞侵袭及转移:电离辐射可以通过改变肿瘤细胞表型或肿瘤微环境、增加残存肿瘤侵袭性导致转移概率增加[26]。Dong等[27]发现,将人胶质瘤细胞系U87照射3 Gy后,细胞侵袭能力增强,β-连环蛋白/Tcf表达增高并在细胞核内积聚。TOP/FOP荧光素酶试验检测被照射的U87显示Wnt/β-连环蛋白信号通路被激活,且该通路靶基因MMP-2和MMP-9表达上调。而在使用Wnt/β-连环蛋白通路抑制剂XAV 939后,抑制β-连环蛋白表达,MMP-2和MMP-9表达下调,同时显著抑制了肿瘤侵袭。因此认为,经典Wnt通路在放射过程中诱导肿瘤细胞侵袭,并产生放射抗性。Li等[28]在对鼻咽癌细胞和组织观察中发现miR-185-3p和Wnt2B表达呈负相关,且在对鼻咽癌细胞系CNE-2和5-8F研究中发现,miR-185-3p能够抑制Wnt2B表达,阻断经典Wnt通路,使其下游基因β-连环蛋白、GSK-3b、c-Myc表达下调,同时证实Wnt2B/β-连环蛋白信号通路激活能够引起鼻咽癌EMT (上皮间质转化) 的发生,促进肿瘤发生转移,增强肿瘤放射抗性,认为miR-185-3p可通过调节Wnt2B影响鼻咽癌细胞的放射抗性。由此推测,经典Wnt信号通路的激活可能使某些肿瘤细胞发生侵袭和转移,且与细胞发生EMT存在一定联系,从而使肿瘤放射治疗后预后不佳。
6.细胞分化:肿瘤放疗后仍有较高的局部复发和 (或) 远处转移率,肿瘤细胞群中存在放射敏感性差的异质性亚群是重要原因之一[29]。Cojoc等[30]研究发现,乙醛脱氢酶 (ALDH) 表达阳性的前列腺癌细胞具有放射抗拒性,该基因表达受β-连环蛋白/TCF转录复合物调控,激活经典Wnt通路可使ALDH表达上调,并伴有肿瘤细胞发生上皮间质转化 (EMT) 和DNA损伤修复能力增强,致使肿瘤细胞抗辐射能力增高;经典Wnt信号通路受阻后,ALDH (+) 细胞数量减少,放射抗性下降,因此认为ALDH可作为评估前列腺癌放射抗性的一项指标。李晓青等[31]对经反复X射线照射形成的食管癌放射抗性细胞系进行了基因表达谱分析,发现这类细胞中miR-21表达增高,并伴有Wnt/β-连环蛋白信号通路活化,β-连环蛋白表达上调,通过调控细胞的凋亡和增殖,使肿瘤对放射产生抵抗。为进一步研究下调miR-21对食管癌TE-1细胞放射敏感性的影响,该实验组成功构建了miR-21稳定下调的食管癌细胞系,比较发现下调miR21可以增强食管癌TE-1细胞的放射敏感性,其机制可能与Wnt/β-连环蛋白信号通路的活化程度降低,β-连环蛋白表达降低,以及食管癌TE-1细胞中p75NTR+细胞比例减少有关。现有关于经典Wnt信号通路、细胞分化与放射抵抗性三者关系的研究甚少,目前认为经典wnt信号通路激活在使肿瘤细胞发生分化改变的同时,也通过影响肿瘤细胞EMT、DNA损伤修复能力、细胞凋亡和增殖来参与放射抗性形成,因此细胞分化可否作为独立的因素介导放射抗性,有待进一步研究。
三、 分子机制与细胞功能的相互关系经典Wnt信号通路参与放射抗性的复杂机制尚不清楚,就目前的研究现状来看错综复杂,涉及细胞周期、细胞增殖、DNA损伤修复能力、细胞凋亡、细胞侵袭及转移的改变等, 各种机制相互协调共同发挥对放射抗性的影响。其相互影响归纳起来有以下几点:①研究主要集中在β-连环蛋白及下游信号蛋白的变化,例如TCF/LEF、c-Myc、Cyclin D1、WISP1等。②相同靶基因可能通过参与不同机制而影响放射抗性,如Cyclin D1与细胞周期、增殖、凋亡有关;c-Myc与周期、凋亡、侵袭转移有关;COX-2与细胞增殖有关。③经典Wnt通路上的基因可通过影响通路外其他基因或通路参与放射抗性形成,如β-连环蛋白可调节LIG4表达、WISP1能使磷酸化组蛋白2(γ-H2AX) 直接去磷酸化、β-连环蛋白/TCF转录复合物调节ALDH表达,而LIG4、γ-H2AX和ALDH可增强DNA损伤修复能力参与肿瘤放射抗性形成;LKB1/AMPK信号通路可能参与介导Wnt/β-连环蛋白通路和KU70/Ku80 DNA损伤修复机制等 (图 1)。本文主要综述了Wnt/β-连环蛋白通路激活后参与放射抗性的形成机制,然而Wnt本身的调节机制也很复杂,Zhou等[32]研究发现,NRAGE可能通过自身的亚细胞定位变化介导β-连环蛋白核移位,激活经典Wnt通路,进而促进食管癌的抗辐射形成。Yang等[33]发现,miR-146b-5p/HuR/lincRNA-p21/β-连环蛋白信号通路能使脑胶质瘤干细胞放射抗性增强。因此想彻底弄清经典Wnt通路影响放射抗性的机制还很多工作要做。随着基因芯片、蛋白质芯片、基因测序以及质谱技术的广泛应用,通过大数据的筛选,发现存在差异的Wnt通路上游信号基因或蛋白以及与Wnt存在相互联系的信号通路将逐渐的成为可能,并将进一步揭示经典Wnt通路在肿瘤放射抗性形成过程中的作用。
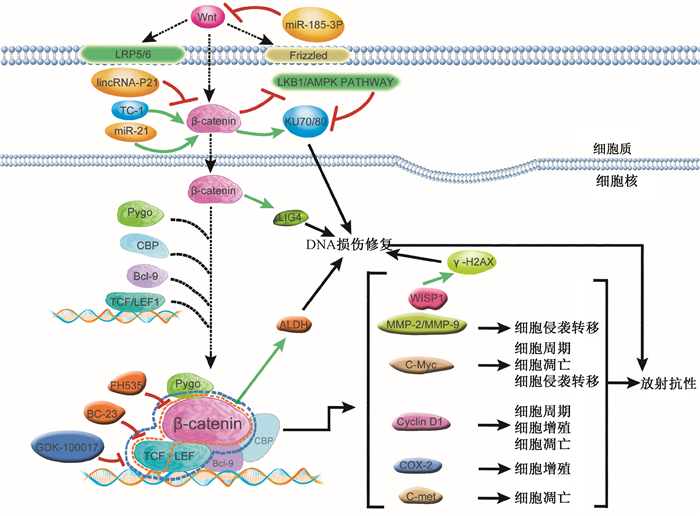
|
图 1 经典Wnt通路在肿瘤放射抗性形成过程中的作用 Figure 1 Role of the canonical Wnt pathway in the formation of tumor radiation resistance |
四、 总结与前景
放射抗性的产生是制约放疗疗效的重要原因,Wnt/β-连环蛋白通路与肿瘤放射抗性形成密切相关。因此,对经典Wnt通路与放射抗性关系的研究为在分子水平提高放疗效果带来希望:一方面可通过对经典Wnt通路相关标记物表达检测,预测放疗疗效,及时改变治疗方案;另一方面,可指导针对经典Wnt信号通路增敏剂的研发,为相关药物的研发提供分子靶点,最终达到提高放疗疗效的目的。由此可见,探索并阐明经典Wnt信号通路与肿瘤放射抗性的关系仍将是肿瘤相关研究的热点,相关研究具有较好的转化价值。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 杨玉负责收集文献,撰写初稿,追踪文献进展;薛晓英负责明确课题方向,拟定写作思路,修改文章;周欢娣协助上述工作;张歌、韩雪涛负责文章的校对
| [1] | Ahmed KM, Li JJ. ATM-NF-kappaB connection as a target for tumor radiosensitization[J]. Curr Cancer Drug Targets, 2007, 7 (4): 335-342. DOI:10.2174/156800907780809769. |
| [2] | Krause M, Dubrovska A, Linge A, et al. Cancer stem cells: Radioresistance, prediction of radiotherapy outcome and specific targets for combined treatments[J]. Adv Drug Deliv Rev, 2017, 109 : 63-73. DOI:10.1016/j.addr.2016.02.002. |
| [3] | Yaromina A, Thames H, Zhou X, et al. Radiobiological hypoxia, histological parameters of tumour microenvironment and local tumour control after fractionated irradiation[J]. Radiother Oncol, 2010, 96 (1): 116-122. DOI:10.1016/j.radonc.2010.04.020. |
| [4] | Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 59 (4): 928-942. DOI:10.1016/j.ijrobp.2004.03.005. |
| [5] | Ogawa K, Yoshioka Y, Isohashi F, et al. Radiotherapy targeting cancer stem cells: current views and future perspectives[J]. Anticancer Res, 2013, 33 (3): 747-754. |
| [6] | Vincan E, Barker N. The upstream components of the Wnt signalling pathway in the dynamic EMT and MET associated with colorectal cancer progression[J]. Clin Exp Metastasis, 2008, 25 (6): 657-663. DOI:10.1007/s10585-008-9156-4. |
| [7] | Reya T, Clevers H. Wnt signalling in stem cells and cancer[J]. Nature, 2005, 434 (7035): 843-850. DOI:10.1038/nature03319. |
| [8] | Pinson KI, Brennan J, Monkley S, et al. An LDL-receptor-related protein mediates Wnt signalling in mice[J]. Nature, 2000, 407 (6803): 535-538. DOI:10.1038/35035124. |
| [9] | Katoh M. WNT/PCP signaling pathway and human cancer (review)[J]. Oncol Rep, 2005, 14 (6): 1583-1588. DOI:10.3892/or.14.6.1583. |
| [10] | Ju X, Liang S, Zhu J, et al. Extracellular matrix metalloproteinase inducer (CD147/BSG/EMMPRIN)-induced radioresistance in cervical cancer by regulating the percentage of the cells in the G2/m phase of the cell cycle and the repair of DNA Double-strand Breaks (DSBs)[J]. Am J Transl Res, 2016, 8 (6): 2498-2511. |
| [11] |
熊伟, 赵静, 黄晓智, 等. 钙黏蛋白相关蛋白及淋巴细胞结合增强因子通过Wnt通路调控G2期阻滞发挥食管癌放射抵抗作用[J].
中国煤炭工业医学杂志, 2013, 16 (2): 173-176. Xiong W, Zhao J, Huang XZ, et al. Role of CTNNB1 and LEF1 in regulating G2 accumulation of radioresistance of human esophageal carcinoma by the Wnt pathway[J]. Chin J Coal Industry Med, 2013, 16 (2): 173-176. DOI:10.11723/mtgyyx1007-9564201302001. |
| [12] | Zhang Q, Gao M, Luo G, et al. Enhancement of radiation sensitivity in lung cancer cells by a novel small molecule inhibitor that targets the beta-Catenin/Tcf4 interaction[J]. PLoS One, 2016, 11 (3): e0152407 DOI:10.1371/journal.pone.0152407. |
| [13] | Linard C, Ropenga A, Vozenin-Brotons MC, et al. Abdominal irradiation increases inflammatory cytokine expression and activates NF-kappaB in rat ileal muscularis layer[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 285 (3): G556-565. DOI:10.1152/ajpgi.00094.2003. |
| [14] |
苏华芳, 万秋燕, 邹燕, 等. 具干细胞特性食管癌耐放射细胞株基因表达分析[J].
肿瘤学杂志, 2010, 16 (1): 40-45. Su HF, Wan QY, Zou Y, et al. An analysis of the gene expression profiles of radioresistance and stem cell[J]. J Oncol, 2010, 16 (1): 40-45. |
| [15] |
李海英, 张力, 潘欢乐, 等. Wnt信号通路在食管癌细胞放射抗拒性形成中的作用[J].
中国病理生理杂志, 2012, 28 (9): 1623-1626. Li HY, Zhang L, Pan HL, et al. Role of Wnt signaling pathway in development of radioresistance in esophageal cancer[J]. Chin J Pathophysiol, 2012, 28 (9): 1623-1626. DOI:10.3969/j.issn.1000-4718.2012.09.015. |
| [16] | Che SM, Zhang XZ, Liu XL, et al. The radiosensitization effect of NS398 on esophageal cancer stem cell-like radioresistant cells[J]. Dis Esophagus, 2011, 24 (4): 265-273. DOI:10.1111/j.1442-2050.2010.01138.x. |
| [17] | Su H, Jin X, Zhang X, et al. FH535 increases the radiosensitivity and reverses epithelial-to-mesenchymal transition of radioresistant esophageal cancer cell line KYSE-150R[J]. J Transl Med, 2015, 13 : 104 DOI:10.1186/s12967-015-0464-6. |
| [18] | Lee SB, Gong YD, Park YI, et al. 2, 3, 6-Trisubstituted quinoxaline derivative, a small molecule inhibitor of the Wnt/beta-catenin signaling pathway, suppresses cell proliferation and enhances radiosensitivity in A549/Wnt2 cells[J]. Biochem Biophys Res Commun, 2013, 431 (4): 746-752. DOI:10.1016/j.bbrc.2013.01.038. |
| [19] | Wu D, Li L, Yan W. Knockdown of TC-1 enhances radiosensitivity of non-small cell lung cancer via the Wnt/beta-catenin pathway[J]. Biol Open, 2016, 5 (4): 492-498. DOI:10.1242/bio.017608. |
| [20] | Zhou PK, Sun WJ, Sui JL, et al. DNA double-strand break repair and prediction of radiosensitivity of tumor cells[J]. Chin Med J, 1997, 110 (9): 670-672. |
| [21] | Jun S, Jung YS, Suh HN, et al. LIG4 mediates Wnt signalling-induced radioresistance[J]. Nat Commun, 2016, 7 : 10994 DOI:10.1038/ncomms10994. |
| [22] | Chang HW, Nam HY, Kim HJ, et al. Effect of beta-catenin silencing in overcoming radioresistance of head and neck cancer cells by antagonizing the effects of AMPK on Ku70/Ku80[J]. Head Neck, 2016, 38 (Suppl 1): E1909-1917. DOI:10.1002/hed.24347. |
| [23] | Zhang H, Luo H, Hu Z, et al. Targeting WISP1 to sensitize esophageal squamous cell carcinoma to irradiation[J]. Oncotarget, 2015, 6 (8): 6218-6234. DOI:10.18632/oncotarget.3358. |
| [24] | Engelberg-Kulka H, Amitai S, Kolodkin-Gal I, et al. Bacterial programmed cell death and multicellular behavior in bacteria[J]. PLoS Genet, 2006, 2 (10): e135 DOI:10.1371/journal.pgen.0020135. |
| [25] | Wang G, Li Z, Zhao Q, et al. LincRNA-p21 enhances the sensitivity of radiotherapy for human colorectal cancer by targeting the Wnt/beta-catenin signaling pathway[J]. Oncol Rep, 2014, 31 (4): 1839-1845. DOI:10.3892/or.2014.3047. |
| [26] | Park CM, Park MJ, Kwak HJ, et al. Ionizing radiation enhances matrix metalloproteinase-2 secretion and invasion of glioma cells through Src/epidermal growth factor receptor-mediated p38/Akt and phosphatidylinositol 3-kinase/Akt signaling pathways[J]. Cancer Res, 2006, 66 (17): 8511-8519. DOI:10.1158/0008-5472.can-05-4340. |
| [27] | Dong Z, Zhou L, Han N, et al. Wnt/beta-catenin pathway involvement in ionizing radiation-induced invasion of U87 glioblastoma cells[J]. Strahlenther Onkol, 2015, 191 (8): 672-680. DOI:10.1007/s00066-015-0858-7. |
| [28] | Li G, Wang Y, Liu Y, et al. miR-185-3p regulates nasopharyngeal carcinoma radioresistance by targeting WNT2B in vitro[J]. Cancer Sci, 2014, 105 (12): 1560-1568. DOI:10.1111/cas.12555. |
| [29] |
姜桔红, 余忠华, 王捷, 等. 鼻咽癌细胞系放射敏感性的异质性[J].
中华放射医学与防护杂志, 2002, 22 (4): 286-287. Jiang JH, Yu ZH, Wang J, et al. Heterogeneity of the radiation sensitivity of nasopharyngeal carcinoma cell line[J]. Chin J Radiol Med Prot, 2002, 22 (4): 286-287. DOI:10.3760/cma.j.issn.0254-5098.2002.04.019. |
| [30] | Cojoc M, Peitzsch C, Kurth I, et al. Aldehyde dehydrogenase is regulated by beta-catenin/TCF and promotes radioresistance in prostate cancer progenitor cells[J]. Cancer Res, 2015, 75 (7): 1482-1494. DOI:10.1158/0008-5472.can-14-1924. |
| [31] |
李晓青, 陈鑫, 黄珊, 等. 下调miR-21可以增强食管癌TE-1细胞的放射敏感性[J].
南方医科大学学报, 2012, 32 (11): 1559-1563. Li XQ, Chen X, Huang S, et al. Down-regulation of miR-21 expression enhances the radiosensitivity of TE-1 cells in vitro[J]. J Southern Med Univ, 2012, 32 (11): 1559-1563. DOI:10.3969/j.issn.1673-4254.2012.11.006. |
| [32] | Zhou H, Zhang G, Xue X, et al. Identification of novel NRAGE involved in the radioresistance of esophageal cancer cells[J]. Tumour Biol, 2016, 37 (7): 8741-8752. DOI:10.1007/s13277-015-4747-6. |
| [33] | Yang W, Yu H, Shen Y, et al. MiR-146b-5p overexpression attenuates stemness and radioresistance of glioma stem cells by targeting HuR/lincRNA-p21/beta-catenin pathway[J]. Oncotarget, 2016, 7 (27): 41505-41526. DOI:10.18632/oncotarget.9214. |
 2017, Vol. 37
2017, Vol. 37


