随着肿瘤分子生物学的不断发展以及对肿瘤驱动基因研究的不断深入,分子靶向药物已逐渐成为治疗晚期非小细胞肺癌的重要手段。研究表明,表皮生长因子受体-酪氨酸激酶抑制剂 (EGFR-TKI) 对EGFR基因突变的非小细胞肺癌高度敏感[1-3]。一些临床研究也证实,相比于一线化疗,一线TKI可明显提高晚期肺癌的客观缓解率 (ORR) (58%~84% vs.15%~47%) 及中位无进展生存 (PFS) (9.5~13.7个月vs. 4.6~6.9个月)[4-10]。
放疗作为肿瘤局部控制的有效手段,可以相对有效地缓解局部肿瘤的侵袭生长及破坏,延长生存时间,提高生活质量。一项前瞻性Ⅱ期的研究表明,胸部放疗联合同步TKI治疗晚期肺癌的不良反应少,生存结果尚可[11]。因此,本研究将对EGFR-TKI联合或不联合胸部原发灶放疗做随机对照研究,探索两组间的疗效及不良反应。
资料与方法1.患者资料:入组标准:经组织学或细胞学确诊为非小细胞肺癌 (NSCLC);经超声、CT、MRI及PET/CT等检查明确为Ⅳ期寡转移患者 (外周转移灶数≤5);既往未接受过治疗;年龄18岁以上;存在EGFR基因敏感突变 (Del 19突变或21外显子L858R点突变);体能状况评分 (performance status,PS)0~2分;预计生存期>3个月。排除标准:妊娠期或哺乳期妇女;有症状的脑转移患者;肿瘤弥漫性转移或无法控制的恶性胸腔积液;存在其他肿瘤;接受过放化疗或者复发的患者。2012年12月至2016年6月期间,本院共入组83例符合上述标准的患者,采用随机数字表法分成联合治疗组和单纯药物组,两组间临床资料差异无统计学意义 (P > 0.05,表 1)。本研究经绍兴市人民医院伦理委员会审批同意 (2014伦理第004号),所有患者在治疗前均签署治疗知情同意书。
|
|
表 1 83例NSCLC患者临床资料 Table 1 The characteristics in 83 patients with NSCLC |
2.治疗方法:联合治疗组41例,肺原发病灶调强放疗或三维适形放疗,放疗总剂量60~66 Gy,放疗期间予埃克替尼125 mg/次,3次/d,放疗结束后继续予埃克替尼治疗,直至出现不可耐受反应或疾病进展。单纯药物组42例,单纯埃克替尼125 mg/次,3次/d,直至出现不可耐受反应或疾病进展。
3.疗效评价与不良反应观察:近期疗效按照实体瘤的疗效评价标准 (RECIST 1.1版),在治疗开始后3个月进行评价,分为完全缓解 (CR)、部分缓解 (PR)、稳定 (SD) 及进展 (PD)。客观有效率 (ORR)= (CR+PR)/(CR+PR+SD+PD)×100%,疾病控制率 (DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。中位无进展生存时间指治疗开始时至病灶进展或出现新病灶的时间。不良反应评估按照美国癌症研究所常见不良反应判定标准 (NCI-CTC 3.0版)、抗癌药物不良反应评价标准及美国肿瘤放射治疗协作组织/欧洲癌症研究与治疗组织 (RTOG/EORTC) 急性放射不良反应评价标准所列选取其中8项指标进行评价。
4.统计学处理:采用SPSS 19.0软件进行分析。对计量资料进行t检验或秩和检验,计数资料进行χ2检验,生存时间采用Kaplan-Meier分析,Log-rank检验差异。P < 0.05为差异有统计学意义。
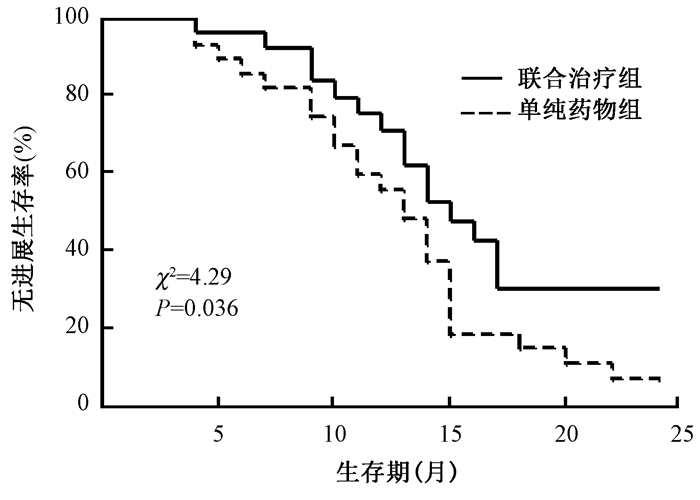
结 果1.临床疗效:至末次随访时间2016年6月30日,所有患者均未失访,中位随访时间为18.2个月。联合治疗组的中位PFS为15.2个月 (95%CI:12.2~17.4个月),单纯药物组的中位PFS为13.2个月 (95% CI:10.8~14.9个月),差异有统计学意义 (χ2=4.29,P=0.036),见图 1;联合治疗组和单纯药物组1年PFS率分别为70.3%和61.2%;ORR分别为32/41和24/42 (χ2=5.16,P=0.028);DCR分别为39/41和39/42 (P > 0.05),见表 2。
|
图 1 两组间患者无进展生存率的Kaplan-Meier生存曲线 Figure 1 Kaplan-Meier survival curves for progression free survival between the two groups |
|
|
表 2 两组患者疗效的比较 Table 2 Comparison of efficacy between two groups |
2.不良反应:两组患者治疗耐受性良好。非血液学不良反应包括皮疹、腹泻、乏力、口腔溃疡、放射性肺炎、放射性食管炎,血液学不良反应包括中性粒细胞减少、贫血、血小板减少等,两组的发生率相似,差异无统计学意义 (P > 0.05)。两组患者中各有4例出现3级皮疹反应,其他均为1、2级及轻度反应,经治疗后均好转 (表 3)。
|
|
表 3 两组患者1、2级治疗相关不良反应比较 Table 3 Comparison of treatment-related adverse reactions with grade one and two between two groups |
讨 论
埃克替尼是由我国自主研发的EGFR-TKI药物,Ⅳ期研究及最近的CONVINCEⅢ期研究已证实埃克替尼疗效确切,不良反应轻微,可作为进展期EGFR基因突变的肺癌的一线治疗方案,其中CONVINCE研究结果提示,埃克替尼显著改善患者中位PFS (埃克替尼组296 d vs.化疗组219 d,P=0.008) 和ORR (埃克替尼组64.8% vs.化疗组33.8%,P < 0.001)[12-13]。
目前,Ⅳ期EGFR突变的非小细胞肺癌患者的一线治疗为EGFR抑制剂[3],但接受EGFR抑制剂的患者未来仍会出现EGFR抑制剂耐药,其中胸部病灶复发可能性很高,并因此影响患者的生活质量甚至生命。EGFR抑制剂具有明确的放射增敏作用,肿瘤细胞的放射敏感度与EGFR的表达水平呈负相关,即EGFR表达水平越高,放射抵抗性就越强,这一理论也在多项临床前研究中得到证实。研究发现,EGFR的信号传导能诱导肿瘤细胞对放疗耐受,使EGFR失活能让细胞对传统放化疗变得敏感[14]。目前,国内外针对胸部原发灶放疗联合同步TKI治疗晚期非小细胞肺癌的随机对照研究较少,Wang等[11]报道了一项关于吉非替尼或厄洛替尼联合胸部放疗的单臂研究,入组的患者包括初治的或复发的进展期非小细胞肺癌,结果提示中位无进展生存时间 (PFS) 为10.2个月,中位总生存 (OS) 为21.8个月,1年和2年的PFS率均为42%,1、2和3年的OS率分别为57%、45%和30%。Martínez等[15]报道了一项关于比较厄洛替尼联合胸部放疗和单纯胸部放疗疗效的Ⅱ期研究结果,共入组90例EGFR基因突变状态未经选择的不可手术的ⅠA~ⅢB非小细胞肺癌患者,结果提示同步治疗组的CR率更高 (41.5% vs. 21.4%,P=0.046),ORR两组相近 (73.6% vs.78.6%),两组的中位癌症相关死亡时间差异无统计学意义 (21.4 vs.17.7,P=0.645)。RTOG 0972试验对于未经选择的、一般情况较差的Ⅲ期非小细胞肺癌在化疗后行厄洛替尼联合放疗的治疗方案,结果提示中位PFS、OS分别为11、17个月,1年总生存率为57%,治疗效果较好[16]。朱川等[17]回顾性分析了64例EGFR-TKI联合胸部同步放疗治疗ⅢB/Ⅳ期非鳞肺癌患者的安全性及临床疗效,结果提示联合治疗组ORR较高 (71.1% vs. 46.2%, P=0.02),同步治疗组和单独治疗组的中位PFS分别为11.5和10.1个月 (P=0.85),中位OS分别为26.7和23.4个月 (P=0.32),不良反应方面两组均较轻微。
本研究对埃克替尼联合或不联合胸部原发灶的放疗EGFR突变的非小细胞肺癌患者做了随机对照。结果提示,相比于单纯埃克替尼组,同步治疗组的中位无进展生存时间更长 (15.2个月vs. 13.2个月,P=0.036);1年PFS率绝对值明显升高 (70.3% vs. 61.2%);同步治疗组的ORR明显升高 (78.0% vs.57.1%,P=0.028)。不良反应方面,两组除了各有4例3级皮疹发生,余未见明显的3~4级不良反应;同步治疗组的放射性肺炎和食管炎发生率增加,但3~4级放射性肺炎及放射性食管炎均未发生;其他的不良反应,如腹泻和乏力等,两组相近。目前本研究所有入组患者的中位随访时间为18.2个月,较短,长期的生存及终点事件仍有待继续跟踪随访。
综上所述,埃克替尼联合胸部原发灶的放疗治疗EGFR突变晚期非小细胞肺癌的短期疗效较好,不良反应可耐受,但本研究的病例数较少,随访时间较短,最终结论有待扩大样本及延长随访时间来验证。
利益冲突 本研究还接受绍兴市科技计划项目 (2015B70067) 资助,本人与其他作者以及基金无任何利益冲突作者贡献声明 王建芳负责数据收集、统计分析及论文撰写;孙彩萍、刘建江和叶万立负责论文数据收集及统计分析;陈遐林负责论文撰写指导及修改
| [1] | O' Rourke N, Roqué IFM, Farré BN, et al. Concurrent chemoradiotherapy in non-small cell lung cancer[J]. Cochrane Database Syst Rev, 2010, 6 (6): CD002140 DOI:10.1002/14651858.CD002140.pub3. |
| [2] | Kobayashi K, Hagiwara K. Epidermal growth factor receptor (EGFR) mutation and personalized therapy in advanced nonsmall cell lung cancer (NSCLC)[J]. Target Oncol, 2013, 8 (1): 27-33. DOI:10.1007/s11523-013-0258-9. |
| [3] | Antonicelli A, Cafarotti S, Indini A, et al. EGFR-targeted therapy for non-small cell lung cancer: focus on EGFR oncogenic mutation[J]. Int J Med Sci, 2013, 10 (3): 320-330. DOI:10.7150/ijms.4609. |
| [4] | Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361 (10): 947-957. DOI:10.1056/NEJMoa0810699. |
| [5] | Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362 (25): 2380-2388. DOI:10.1056/NEJMoa0909530. |
| [6] | Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial[J]. Lancet Oncol, 2010, 11 (2): 121-128. DOI:10.1016/S1470-2045(09)70364-X. |
| [7] | Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12 (8): 735-742. DOI:10.1016/S1470-2045(11)70184-X. |
| [8] | Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012, 13 (3): 239-246. DOI:10.1016/S1470-2045(11)70393-X. |
| [9] | Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15 (2): 213-222. DOI:10.1016/S1470-2045(13)70604-1. |
| [10] | Sequist LV, Yang JC, Yamamoto N, et al. Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J]. J Clin Oncol, 2013, 31 (27): 3327-3334. DOI:10.1200/JCO.2012.44.2806. |
| [11] | Wang J, Xia TY, Wang YJ, et al. Prospective study of epidermal growth factor receptor tyrosine kinase inhibitors concurrent with individualized radiotherapy for patients with locally advanced or metastatic non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 81 (3): e59-65. DOI:10.1016/j.ijrobp.2010.12.035. |
| [12] | Hu X, Han B, Gu A, et al. A single-arm, multicenter, safety-monitoring, phase Ⅳ study of icotinib in treating advanced non-small cell lung cancer (NSCLC)[J]. Lung Cancer, 2014, 86 (2): 207-212. DOI:10.1016/j.lungcan.2014.08.014. |
| [13] | Shi YK, Wang L, Han BH, et al. First-line icotinib versus cisplatine/pemetrexed plus pemetrexed maintenance therapy in lung adenocarcinoma patients with sensitizing EGFR mutation (CONVINCE)[J]. Ann Oncol, 2016, 27 (Suppl 6): 1229P DOI:10.1093/annonc/mdw383.29. |
| [14] | Bernier J, Schneider D. Cetuximab combined with radiotherapy: an alternative to chemoradiotherapy for patients with locally advanced squamous cell carcinomas of the head and neck?[J]. Eur J Cancer, 2007, 43 (1): 35-45. DOI:10.1016/j.ejca.2006.08.035. |
| [15] | Martínez E, Martínez M, Rico M, et al. Feasibility, tolerability, and efficacy of the concurrent addition of erlotinib to thoracic radiotherapy in locally advanced unresectable non-small-cell lung cancer: a Phase Ⅱ trial[J]. Onco Targets Ther, 2016, 9 : 1057-1066. DOI:10.2147/OTT.S89755. |
| [16] | Lilenbaum R, Samuels M, Wang X, et al. A phase Ⅱ study of induction chemotherapy followed by thoracic radiotherapy and erlotinib in poor-risk stage Ⅲ non-small-cell lung cancer: results of CALGB 30605 (Alliance)/RTOG 0972 (NRG)[J]. J Thorac Oncol, 2015, 10 (1): 143-147. DOI:10.1097/JTO.0000000000000347. |
| [17] |
朱川, 蔡祖艾, 李湘宜, 等. 表皮生长因子受体酪氨酸激酶抑制剂联合同步放疗治疗晚期非鳞肺癌疗效观察[J].
中国基层医药, 2016, 23 (11): 1687-1691. C, Cai ZA, Li XY, et al. Effect of EGFR-TKI combined with concurrent radiotherapy in the treatment of advanced non-squamous lung cancer[J]. Chin J Primary Med Pharm, 2016, 23 (11): 1687-1691. DOI:10.3760/cma.j.issn.1008-6706.2016.11.022. |
 2017, Vol. 37
2017, Vol. 37


