放射治疗是肺癌、乳腺癌、食管癌等胸部肿瘤最主要的治疗手段之一,治疗过程会引起不同程度的肺损伤,影响放射治疗的疗效。近年来研究发现,NLRP3炎症复合体高表达与急性肺损伤及肺间质纤维化联系密切[1-2]。关于NLRP3炎症复合体的调节已经确定的机制是NLRP3转录表达依赖于NF-κB[3]。而其在辐射诱导的肺组织损伤研究中的调节机制国内外报道较少。
萝卜硫素 (sulforaphane,SF) 是从十字花科蔬菜中提取出来的,具有抗炎、抗氧化作用的植物活性物质。研究证实,SF可通过降低IL-1β的表达发挥抗炎抗氧化作用[4],NF-κB是SF发挥抗炎作用的关键靶点[5]。本研究通过构建小鼠急性放射性肺损伤模型,探索电离辐射对NLRP3炎症复合体的激活或抑制的调节机制,并观察SF对NLRP3炎症复合体及相关因子表达的影响,探究其可能的机制,为放射性肺损伤防护提供依据。
材料与方法1.主要试剂和仪器:萝卜硫素 (纯度I > 90%,美国Sigma公司);TRIzol Reagent (美国Invitrogen公司);RT-PCR试剂盒 (日本TaKaRa公司);NLRP3多克隆抗体 (美国Novus公司);NF-κB p65单克隆抗体 (美国CST公司);β-肌动蛋白 (美国Protein Tech公司);全蛋白提取试剂盒 (江苏凯基生物公司);BCA蛋白浓度测定试剂盒 (北京索莱宝公司);Western blot试剂盒、山羊抗鼠、山羊抗兔二抗 (江苏碧云天公司);ECL发光液 (美国GE公司);小鼠IL-6、TNF-α、TGF-β1 ELISA试剂盒 (江苏雨桐生物科技公司);胞质-核蛋白抽提试剂盒 (美国PIERCE公司);非放射性EMSA试剂盒 (美国PIERCE公司);免疫组织化学染色试剂盒、浓缩型DAB试剂盒 (北京中杉金桥生物公司);UNIQUE直线加速器 (美国Varian公司)。
2.动物与照射:8周龄SPF级C57BL/6J雌性小鼠40只,体重 (20±2) g,购于大连医科大学实验动物中心,许可证编号SCXK (辽) 2013-0003,饲养于大连医科大学实验动物中心屏障系统,动物饲养合格证号SCXK (13) 2002-0002,饲以SPF级维持饲料,动物饮用水供其自由饮用,温度 (24±2) ℃,相对湿度为50%~60%,昼夜12 h交替。购买后观察3 d称重,并用随机数字表法将小鼠分为健康对照组、单纯照射组、照射+SF 3 mg/kg组、照射+SF 5 mg/kg组和照射+SF 10 mg/kg组,每组8只。4%水合氯醛腹腔 (0.1 ml/10 g) 注射麻醉,塑料鼠夹固定,6 MV X射线,吸收剂量率0.4 Gy/min,源皮距=100 cm。健康对照组小鼠同等条件下全肺假照射,其余各组小鼠单次全肺照射12 Gy。
3.给药方法:药物干预组小鼠分别给予3、5和10 mg/kg剂量的SF,SF以二甲基亚砜 (DMSO) 为溶剂,生理盐水稀释后于照射前7 d开始至照射后7 d,隔天腹腔注射给药,每次0.4 ml,共7次,健康对照组和单纯照射组注射同等剂量的DMSO+生理盐水溶剂。
4.苏木素-伊红 (HE) 和免疫组织化学检测:解剖小鼠取肺组织,4%多聚甲醛固定24 h,常规脱水、透明、石蜡包埋、切片、HE染色,镜下观察病理组织结构改变。免疫组织化学检测步骤:石蜡切片常规脱蜡至水,3%双氧水室温孵育18 min,PBS 3 min×3次。抗原修复,以0.01 mol/L柠檬酸盐缓冲液 (pH 6.0) 浸泡,加热10 min×2次,期间取出补加缓冲液,加热后自然冷却至室温,PBS 3 min×3次。正常山羊血清封闭,室温15 min;滴加NLRP3一抗工作液 (1:100),4 ℃过夜 (> 18 h);37 ℃复温1 h,磷酸盐缓冲液 (PBS) 3 min×3次;滴加生物素化二抗工作液,37 ℃孵育15 min,PBS 3 min×3次;滴加辣根酶标记链霉卵白素工作液,37 ℃孵育15 min,PBS 3 min×3次。DAB溶液显色,适时终止反应;苏木素-伊红复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。镜下观察小鼠肺组织中NLRP3蛋白定位及表达,每张切片高倍镜下随机选择10个视野,以镜下染色强度和阳性细胞百分比进行评分,总分为两者乘积。染色强度:无棕黄色颗粒为0分;淡黄色颗粒为1分;棕黄色颗粒为2分;大量深棕色或褐色颗粒为3分。阳性细胞的比例:没有阳性细胞为0分; < 25%为1分,25%~50%为2分,51%~80%为3分,> 80%为4分。由两名病理科医师进行免疫组织化学法诊断及阳性细胞计数。
5. ELISA法测定肺泡灌洗液中炎性因子:4%水合氯醛 (0.1 ml/10 g),充分麻醉小鼠,切开颈部皮肤游离气管,静脉留置针行气管插管,0.8 ml生理盐水灌洗全肺,收集支气管肺泡灌洗液,重复3次,共回收约2 ml,4 ℃,离心半径15.7 cm,1 000 r/min离心10 min,收集上清液置于-80 ℃冰箱保存,按说明书采用ELISA试剂盒测定肺泡灌洗液中的炎性因子白介素6 (IL-6)、肿瘤坏死因子α (TNF-α)、转化生长因子β1 (TGF-β1),绘制标准曲线,计算炎性因子浓度。
6. RNA提取及qRT-PCR:TRIzol法提取组织总RNA,测定纯度 (A260/A280为1.8~2.0) 定量后按照日本TaKaRa公司反转录试剂盒说明书合成cDNA。PCR反应的引物序列NLRP3:上游引物为5′ ACAGCATTGAAGAGGAGTGGA 3′,下游引物为5′ TCGTGTGTAGCGTTTGTTGAG 3′;IL-1β:上游引物为5′ GTGGCAATGAGGATGACTTGT 3′,下游引物为5′ TGTAGTGGTGGTCGGAGATTC 3′;GAPDH:上游引物为5′ GGTGAAGGTCGGTGTGAACGGA 3′,下游引物为5′ CCAAAGTTGTCATGGATGACCTTGG 3′(安徽通用生物公司合成)。反应体系如下:SYBR Premix Ex Taq Ⅱ (Tli RNaseH Plus) (2×) 10 μl,上游引物1 μmol/L,下游引物1 μmol/L, ROX Reference Dye (50×) 0.4 μl,DNA模板2 μl,dH2O 5.6 μl。反应条件为:预变性95 ℃ 30 s;PCR反应95 ℃ 3 s,55 ℃ 30 s,72 ℃ 30 s,共40个循环;溶解曲线95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s。荧光信号检查、数据存储和分析由美国安捷伦PCR仪及其软件完成。
7. Western blot法检测NF-κB p65、NLRP3、IL-1β蛋白表达水平:将冷冻肺组织样品 (30~50 mg) 研成粉末,加入适量裂解液,冰浴超声裂解后4 ℃,离心半径9.5 cm,12 000 r/min离心10 min,收集上清,BCA法测定蛋白浓度。电泳条件:浓缩胶电压80 V,分离胶电压120 V;转膜条件 (湿转):恒流200 mA,2 h;5%脱脂奶粉封闭2 h,NF-κB p65、NLRP3、IL-1β一抗 (1:1 000)、内参β-肌动蛋白 (1:3 000) 4 ℃孵育过夜,TBST缓冲盐溶液 (1×TBS+0.1% Tween 20) 洗膜15 min×3次,二抗 (1:5 000) 室温作用1 h,TBST缓冲盐溶液洗膜15 min×3次。ECL化学显色试剂盒显影,Image Lab凝胶成像系统显色发光,Gelpro32图像分析软件分析目的及内参条带的灰度值,并用目的蛋白的灰度值比内参蛋白的灰度值,最终得出目的蛋白的相对表达量。
8.凝胶迁移实验 (EMSA) 测定NF-κB的活性:按核蛋白抽提试剂盒说明书提取核蛋白,蛋白定量后-80 ℃保存备用;按非放射性EMSA试剂盒说明书检测小鼠肺组织中NF-κB活性。步骤如下:结合体系10×结合液2 μl,poly (di:dC) 1 μl,核蛋白1~3 μl,生物素标记的探针0.5 μl,补水至10 μl,室温放置20 min,加入10×上样缓冲液;制备6.5%聚丙烯酰胺凝胶;预电泳120 V 1 h;上样后180 V电泳70 min;转膜,稳流390 mA,40 min;紫外交联5 min;封闭30 min;1:750 streptavidin-HRP反应20 min;1×Wash Buffer洗膜4×5 min;平衡5 min;化学发光检测,Gelpro32图像分析各条带吸光度 (A)。
9.统计学处理:计量资料用x±s表示,采用SPSS 17.0软件进行数据分析。不同组间比较方差齐性检验后采用方差分析,同一指标两组间比较,经正态性检验后符合正态分布,采用独立样本t检验。P < 0.05为差异有统计学意义。
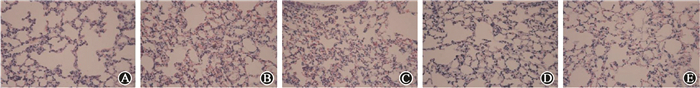
结 果1.病理组织学改变:HE染色显示,健康对照组肺组织中肺泡毛细血管结构清晰,肺泡壁完整,无渗出和出血。单纯照射组小鼠肺组织中可见明显的肺泡毛细血管亚单位破坏,肺泡壁及肺间质中毛细血管充血扩张,伴有中性粒细胞及淋巴细胞等炎性细胞浸润,肺泡壁表现为代偿性增厚,肺泡腔缩小,壁内Ⅱ型上皮细胞、巨噬细胞增多。各药物干预组的小鼠肺组织炎症渗出等病理表现较单纯照射组减轻,其中照射+SF 10 mg/kg组减轻最显著 (图 1)。
|
图 1 各组小鼠肺组织的病理改变HE染色×400 A.健康对照组;B.单纯照射组;C.照射+SF 3 mg/kg组;D.照射+SF 5 mg/kg组;E.照射+SF 10 mg/kg组 Figure 1 The pathological changes in lung tissue of mice HE staining × 400 A. Control group; B. Radiation group; C. Radiation plus SF 3 mg/kg group;D. Radiation plus SF 5 mg/kg group;E. Radiation plus SF 10 mg/kg group |
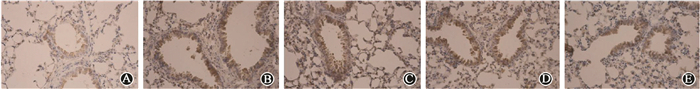
2.免疫组织化学法检测肺组织中NLRP3蛋白表达:对照组肺组织中NLRP3肺间质及肺上皮细胞胞质中有少量呈现弱阳性表达;单纯照射组肺组织中出现明显阳性甚至强阳性表达,主要表达于肺间质及肺上皮细胞胞质,部分视野中见巨噬细胞胞质也出现阳性表达;照射+SF组小鼠肺组织中NLRP3蛋白表达较单纯照射组低,其中照射+SF 10 mg/kg组NLRP3表达降低最显著 (图 2)。免疫组织化学检测评分结果显示,健康对照组、单纯照射组、照射+SF 3 mg/kg组、照射+SF 5 mg/kg组、照射+SF 10 mg/kg组NLRP3免疫组织化学评分分别为1.10±0.32、5.60±0.84、5.20±1.03、4.80±1.03、2.70±1.16。与健康对照组比较,单纯照射组及各照射+SF组的NLRP3评分分值均升高,差异有统计学意义 (F=42.750,P < 0.05);各照射+SF组与单纯照射组比较,NLRP3评分分值有降低趋势,但其中照射+SF 3 mg/kg组和照射+SF 5 mg/kg组与单纯照射组之间差异无统计学意义 (P > 0.05),健康对照组、照射+SF 10 mg/kg组与单纯照射组比较,差异有统计学意义 (F=42.750,P < 0.05)。
|
图 2 各组小鼠肺组织的NLRP3蛋白表达免疫组织化学染色×200 A.健康对照组;B.单纯照射组;C.照射+SF 3 mg/kg组;D.照射+SF 5 mg/kg组;E.照射+SF 10 mg/kg组 Figure 2 The expression of NLRP3 protein in lung tissue of mouse Immunohistochemical staining × 200 A. Control group; B. Radiation group; C. Radiation plus SF 3 mg/kg group; D. Radiation plus SF 5 mg/kg group; E. Radiation plus SF 10 mg/kg group |
3.小鼠肺泡灌洗液中炎性因子的表达:与健康对照组比较,单纯照射组小鼠肺泡灌洗液中IL-6、TNF-α、TGF-β1含量均明显增高 (t=89.08、82.32、50.53,P < 0.05)。各照射+SF组TGF-β1含量下降 (t=-58.22、-50.55、-46.10,P < 0.05),IL-6、TNF-α含量较单纯照射组明显降低 (tIL-6=-21.00、-38.92、-62.65,tTNF-α=-16.57、-26.63、-32.18,P < 0.05),且随着SF剂量的增高,下降程度逐渐增大。各照射+SF组TGF-β1含量差异无统计学意义 (P > 0.05),见表 2。
|
|
表 2 各组小鼠肺泡灌洗液中IL-6、TNF-α、TGF-β1含量 (pg/ml,x±s) Table 2 The levels of IL-6, TNF-α and TGF-β1 in alveolar lavage fluid of mouse (pg/ml, x±s) |
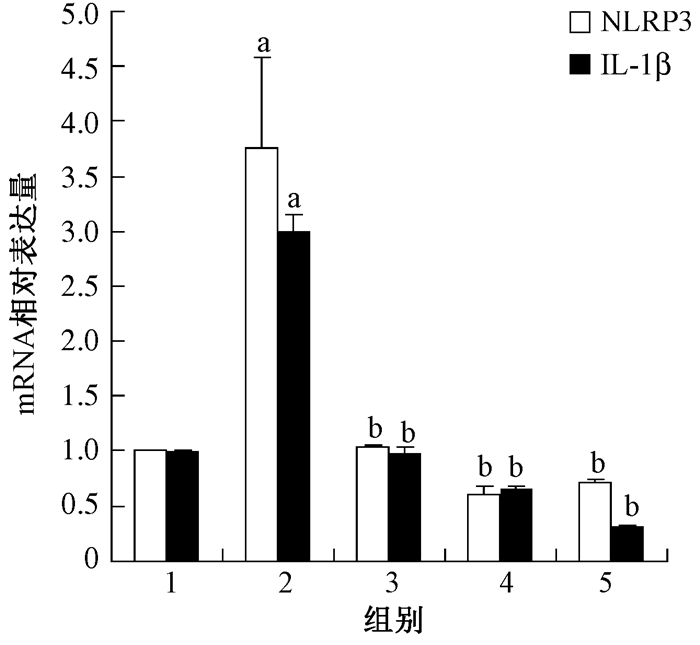
4.小鼠肺组织中NLRP3、IL-1β mRNA的表达:与健康对照组相比,单纯照射组小鼠肺组织内NLRP3、IL-1β mRNA表达显著增高 (t=5.75、22.18,P < 0.05)。与单纯照射组比较, SF联合照射组小鼠NLRP3、IL-1β mRNA表达显著降低 (tNLRP3=-5.68、-6.56、-6.34,tIL-1β=-21.20、-25.76、-29.75,P < 0.05),随SF剂量增高,IL-1β mRNA表达逐渐降低。其中SF 10 mg/kg组NLRP3 mRNA表达较SF 5 mg/kg组略高,但差异无统计学意义 (P > 0.05),见图 3。
|
图 3 各组小鼠肺组织NLRP3、IL-1β mRNA表达水平 注:1.健康对照组;2.单纯照射组;3.照射+SF 3 mg/kg组;4.照射+SF 5 mg/kg组;5.照射+SF 10 mg/kg组。a与同一指标健康对照组相比,t=5.75、22.18,P < 0.05;b与对应单纯照射组比较,tNLRP3=-5.68、-6.56、-6.34,P < 0.05; tIL-1β=-21.20、-25.76、-29.75,P < 0.05 Figure 3 The expressions of NLRP3 and IL-1β mRNAs in lung tissue of mouse |
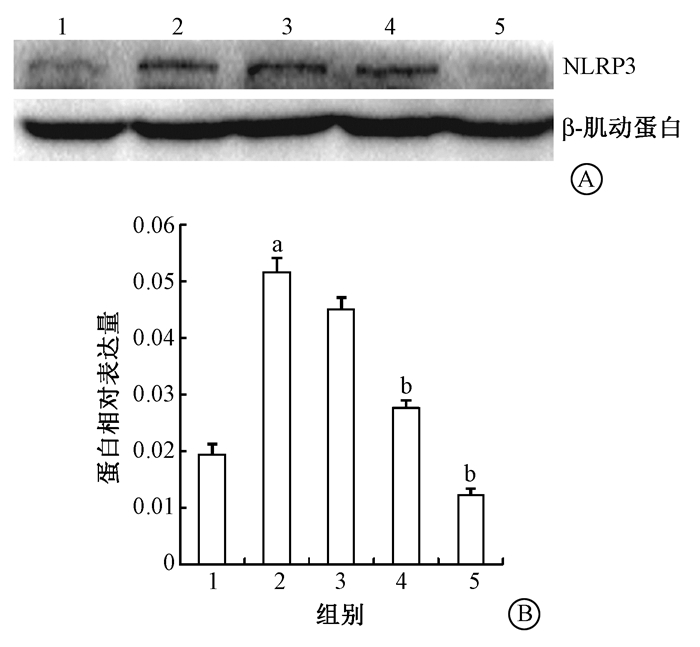
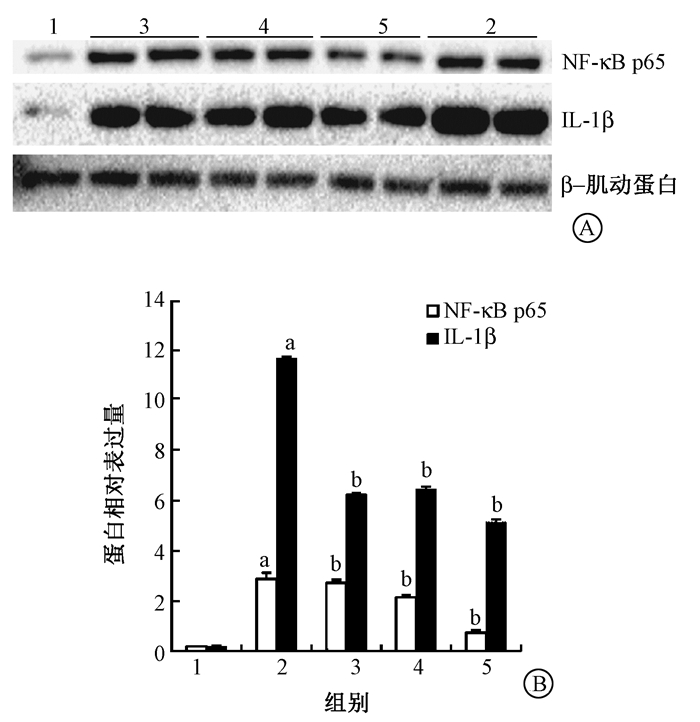
5.小鼠肺组织中NF-κB p65、NLRP3、IL-1β蛋白表达:Western blot结果显示,照射后小鼠肺组织内NLRP3蛋白表达较健康对照组显著升高 (t=16.88,P < 0.01),SF 5 mg/kg与10 mg/kg组小鼠NLRP3蛋白表达较单纯照射组降低 (t=-16.91、-25.01,P < 0.05),并且呈药物浓度依赖性降低 (r=0.926),其中SF 10 mg/kg组NLRP3蛋白表达抑制最明显 (图 4)。NF-κB p65、IL-1β蛋白表达结果显示,单纯照射组蛋白表达较健康对照组均明显增高 (t=149.64、181.95,P < 0.05),SF干预的各组小鼠NF-κB p65、IL-1β蛋白表达较单纯照射组降低 (tNF-κB p65=-1.71、-12.43、-34.00,tIL-1β=-73.70、-55.14、-63.90,P < 0.05)。其中NF-κB p65呈药物浓度依赖性降低 (r=0.945),SF 10 mg/kg组的NF-κB p65、IL-1β蛋白表达抑制最明显 (图 5)。
|
图 4 Western blot检测各组小鼠肺组织NLRP3蛋白表达A. Western blot蛋白条带;B. NLRP3蛋白相对表达量 注:1.健康对照组;2.单纯照射组;3.照射+SF 3 mg/kg组;4.照射+SF 5 mg/kg组;5.照射+SF 10 mg/kg组。a与健康对照组比较,t=16.88,P < 0.05;b与单纯照射组比较,t=-16.91、-25.01,P < 0.05 Figure 4 The expression level of NLRP3 in lung tissue of mouse A. Western blot protein bands; B.The relative expression of NLRP3 |
|
图 5 Western blot检测各组小鼠肺组织NF-κB p65、IL-1β蛋白表达水平A. Western blot蛋白条带;B.蛋白相对表达量 注:1.健康对照组;2.单纯照射组;3.照射+SF 3 mg/kg组;4.照射+SF 5 mg/kg组;5.照射+SF 10 mg/kg组。a与健康对照组比较,t=149.64、181.95,P < 0.05;b与单纯照射组比较,tNF-κB p65=-1.71、-12.43、-34.00,P<0.05;tIL-1β=-73.70、-55.14、-63.90,P < 0.05 Figure 5 The expression levels of NF-κB p65 and IL-1β in lung tissue of mouse A. Western blot protein bands; B. The relative expression of NF-κB p65 and IL-1β |
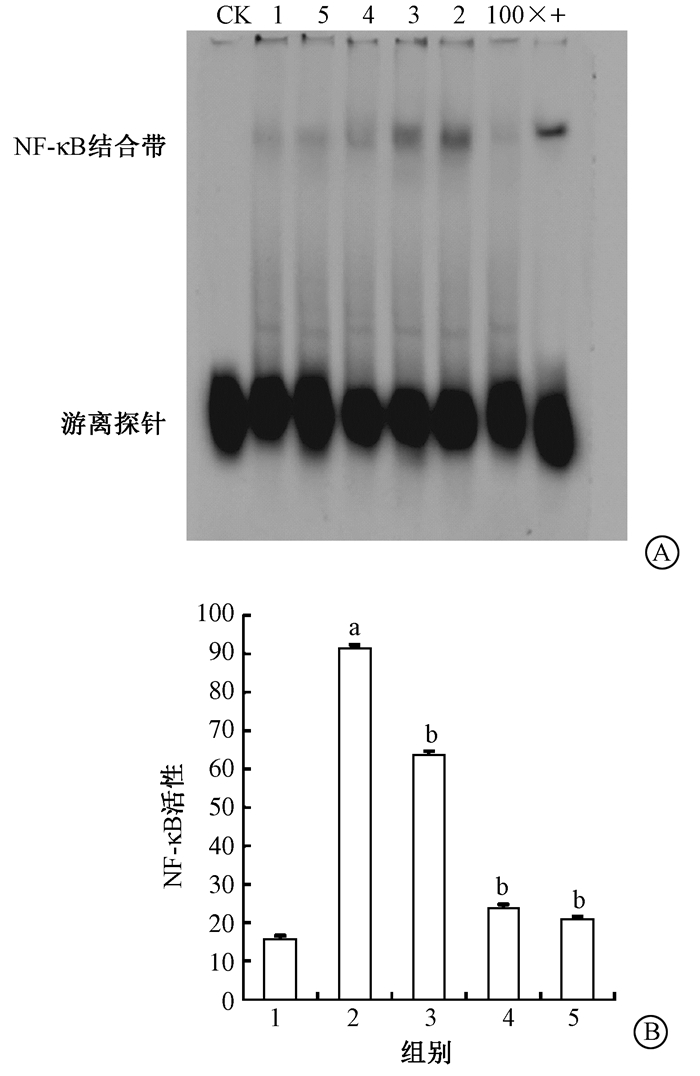
6.EMSA检测NF-κB的活性:与健康对照组比较,照射后小鼠肺组织中NF-κB的活性明显升高 (t=933.15,P < 0.01),健康对照组小鼠肺组织中仅检测到微弱的NF-κB激活现象。与单纯照射组比较,照射+SF组NF-κB活性下降 (tNF-κB=-35.76、-382.13、-1 158.60,P < 0.01),其中以照射+SF 10 mg/kg组NF-κB活性下降最明显 (图 6)。
|
图 6 EMSA检测各组小鼠肺组织NF-κB活性A. EMSA蛋白条带;B. NF-κB的活性定量图 注:CK.阴性对照;100×.游离探针;+.阳性对照:SGC7901细胞经20 ng/ml TNF终浓度处理45 min后提取核蛋白。1.健康对照组;2.单纯照射组;3.照射+SF 3 mg/kg组;4.照射+SF 5 mg/kg组;5.照射+SF 10 mg/kg组。a与健康对照组比较,t=933.15,P < 0.05;b与单纯照射组比较,t=-35.76、-382.13、-1 158.60,P < 0.05 Figure 6 The activity of NF-κB in lung tissue of mouse A. EMSA protein bands; B. The quantitative activity of NF-κB |
讨 论
作为辐射中度敏感器官,肿瘤附近的肺组织受到超过其生物效应阈值的放射剂量会产生不同程度的损伤。放射性肺损伤 (radiation-induced lung injury,RILI) 是胸部肿瘤放射治疗中的常见并发症。尽管放射治疗设备及技术在不断提高,但肺损伤发生率仍有14.6%~37.2%[6]。RILI严重影响肿瘤患者生活质量和生存期,同时也限制了放疗技术的应用和发展。研究表明,RILI是多种细胞参与并分泌多种炎性因子共同调控复杂病理过程,肺泡Ⅱ型上皮细胞、血管内皮细胞等受辐射损伤后,释放TNF-α、IL-1、IL-6等细胞因子诱发急性炎症反应,进而激活巨噬细胞释放TGF-β1,促进纤维母细胞转化增生并合成基质蛋白,最终导致肺间质纤维化[7-8]。
NLRP3是细胞胞质内重要的模式识别受体,能感知胞内病原微生物及代谢物,起始炎症复合体的组装,是构成炎症复合体的核心部分。研究表明,NLRP3炎症复合体参与慢性阻塞性肺疾病、急性肺损伤、特发性肺纤维化疾病等多种肺部疾病调控[2, 9]。但其是否参与放射性肺损伤过程及其在肺损伤中的作用研究较少。研究发现,照射后NLRP3炎性复合体的表达明显上调,提示放射性肺损伤的发生与NLRP3密切相关[10]。NF-κB作为NLRP3上游转录调控因子,可以通过JNK等多种信号通路激活下游的NLRP3[11-12],在介导炎性细胞因子释放中发挥着重要的作用。SF是抗炎、抗氧化最好的植物活性物质。研究发现,SF能有效地抑制紫外线引起皮肤急性炎症反应,阻断包括NLRP3炎性复合体在内的多种炎性复合体激活[13-14]。射线引起的电离辐射对机体造成损伤与紫外线辐射类似,因而本研究探讨SF是否能通过抑制NLRP3发挥放射防护作用。
本实验采用12 Gy单次照射小鼠全肺,HE染色观察到照射后肺组织中Ⅱ型肺泡上皮细胞增生,SF干预后Ⅱ型上皮细胞增生相对照射组不显著。Ⅱ型肺泡上皮细胞的增生为肺泡损伤和修复的重要标记,证明SF可以减弱放射性肺损伤。岳海英等[15]检测到受照射猪肺组织Ⅱ型肺泡上皮细胞间质转化及TGF-β1变化与放射性肺损伤之间的相关性。其免疫组织化学实验观察到,照射后小鼠肺组织中NLRP3蛋白表达水平明显升高,并且同病理学结果一致。然而,经过SF干预后NLRP3蛋白表达受到抑制。NLRP3通过与接头蛋白 (ASC) 募集,活化Caspase-1调控IL-1β、IL-18等多种促炎细胞因子的修饰与活化,主要在巨噬细胞、上皮细胞、平滑肌细胞等多种细胞中表达[16]。IL-1β和IL-18都属于IL-1超家族,主要由单核巨噬细胞分泌,作为机体内重要的细胞因子,作用于免疫相关细胞,促使这些细胞产生相应的免疫效应[17]。近年来有研究表明,放射治疗与免疫关系密切,局部放疗能够激发全身、远位或照射野外的效应,同时能够引起DNA损伤反应和免疫事件,并和炎性反应相互联系[18]。ELISA结果显示,辐射后小鼠肺泡盥洗液中IL-6、TNF-α、TGF-β1炎性因子的表达较健康对照组显著升高。给予SF干预后IL-6、TNF-α表达水平随着SF剂量的增加呈现出梯度下降,这与Qi等[19]在小鼠急性肺损伤的模型中得出的结果类似,证实SF可以通过抑制Nrf2/ARE通路,降低IL-6及TNF-α等炎性因子表达。而TGF-β1的表达虽然较照射组下降,但不同剂量的SF对TGF-β1的表达并差异不显著。由于本研究检测的是照射后2周小鼠肺泡盥洗液中炎性因子的含量,提示IL-6和TNF-α炎性因子在早期的放射性肺损伤过程发挥作用较TGF-β1显著,因而能更好地预测早期放射性肺损伤的发生。这与Dadrich等[20]的研究结论一致,TGF-β1主要参与放射性肺损伤的纤维化过程。
本研究中,照射引起小鼠肺组织中NLRP3 mRNA和蛋白表达升高的同时,IL-1β mRNA和蛋白的表达水平也显著上升,并且趋势与NLRP3一致,说明电离辐射可能是通过NLRP3通路引起的IL-1β的升高,提示IL-lβ是依赖NLRP3的激活而分泌的,与文献报道一致[19-21]。与此同时,检测到NF-κB p65蛋白的表达明显增加,NF-κB活性明显增高,给予SF干预后NF-κB p65蛋白的表达受到抑制,NF-κB活性下降,并且呈SF剂量依赖性。NF-κB是一类具有多向转录调节作用的核蛋白因子,广泛存在于多种组织细胞中,激活后参与许多基因的转录调控,在免疫、炎症、氧化应激、细胞增殖、细胞凋亡等生理病理过程中发挥作用[22-23]。张朦等[24]研究大鼠脑放射性损伤机制时发现,活化的NF-κB通过调节多种细胞因子的表达增加,促进放射性脑损伤的发生发展。分析原因可能是,照后NF-κB主要是通过TNF-α磷酸化、IκB激酶及c-Jun氨基末端激酶的活化,从而激活蛋白激酶级联反应,调节免疫和炎症反应基因表达,SF抑制NF-κB活性有效减轻炎性反应[25-26]。Reddy等[27]研究认为,SF发挥抗炎作用是通过抑制NF-κB信号通路完成的。p65参与构成NF-κB三聚体,可通过磷酸化和乙酰化调节,活化NF-κB转位到核内与与其相关的DNA基序结合以诱导靶基因转录[28]。且NLRP3和NF-κB p65蛋白表达及NF-κB活性变化一致,以上结果证实SF对NLRP3的调控是通过NF-κB信号通路完成的。Zhong等[29]认为,NF-κB通过消除体内损伤的线粒体从而抑制NLRP3表达,修复组织损伤完成的,这有待进一步研究证实。
综上所述,SF可抑制体内NLRP3表达减轻辐射引起的放射性肺损伤,其机制之一可能是通过抑制NF-κB活性,进而抑制NLRP3基因的转录和表达,从而减少炎性因子释放来实现的。随着分子生物学研究的进一步发展,SF防护放射性肺损伤的更多分子机制将被逐一揭开,这必将会为临床防护放射性肺损伤提供一条新的、有效的治疗途径。
利益冲突 本人及家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证。本文全体作者声明不存在任何利益冲突作者贡献声明 宣伟负责实验操作及论文撰写;李帅、吴秀艳负责动物照射;耿艳负责数据统计分析;张卓负责总体实验安排、论文撰写指导
| [1] | Fukumoto J, Fukumoto I, Parthasarathy PT, et al. NLRP3 deletion protects from hyperoxia-induced acute lung injury[J]. Am J Physiol Cell Physiol, 2013, 305 (2): C182-189. DOI:10.1152/ajpcell.00086.2013. |
| [2] | Lee S, Suh GY, Ryter SW, et al. Regulation and function of the nucleotide binding domain leucine-rich repeat-containing receptor, pyrin domain-containing-3 inflammasome in lung disease[J]. Am J Respir Cell Mol Biol, 2016, 54 (2): 151-160. DOI:10.1165/rcmb.2015-0231TR. |
| [3] | Liao PC, Chao LK, Chou JC, et al. Lipopolysaccharide/adenosine triphosphate-mediated signal transduction in the regulation of NLRP3 protein expression and caspase-1-mediated interleukin-1beta secretion[J]. Inflamm Res, 2013, 62 (1): 89-96. DOI:10.1007/s00011-012-0555-2. |
| [4] | An YW, Jhang KA, Woo SY, et al. Sulforaphane exerts its anti-inflammatory effect against amyloid-β peptide via STAT-1 dephosphorylation and activation of Nrf2/HO-1 cascade in human THP-1 macrophages[J]. Neurobiol Aging, 2016, 38 : 1-10. DOI:10.1016/j.neurobiolaging.2015.10.016. |
| [5] | Heiss E, Herhaus C, Klimo K, et al. Nuclear factor kappa B is a molecular target for sulforaphane-mediated anti-inflammatory mechanisms[J]. J Biol Chem, 2001, 276 (34): 32008-32015. DOI:10.1074/jbc.M104794200. |
| [6] | Benveniste MF, Welsh J, Godoy MC, et al. New era of radiotherapy: an update in radiation-induced lung disease[J]. Clin Radiol, 2013, 68 (6): e275-290. DOI:10.1016/j.crad.2013.01.013. |
| [7] | Ding NH, Li JJ, Sun LQ. Molecular mechanisms and treatment of radiation-induced lung fibrosis[J]. Curr Drug Targets, 2013, 14 (11): 1347-1356. DOI:10.2174/13894501113149990198. |
| [8] | Yarnold J, Brotons MC. Pathogenetic mechanisms in radiation fibrosis[J]. Radiother Oncol, 2010, 97 (1): 149-161. DOI:10.1016/j.radonc.2010.09.002. |
| [9] | Liu Z, Zhao H, Liu W, et al. NLRP3 inflammasome activation is essential for paraquat-induced acute lung injury[J]. Inflammation, 2015, 38 (1): 433-444. DOI:10.1007/s10753-014-0048-2. |
| [10] | Sohn SH, Lee JM, Park S, et al. The inflammasome accelerates radiation-induced lung inflammation and fibrosis in mice[J]. Environ Toxicol Pharmacol, 2015, 39 (2): 917-926. DOI:10.1016/j.etap.2015.02.019. |
| [11] | Cao S, Wang JC, Gao J, et al. CFH Y402H polymorphism and the complement activation product C5a: effects on NF-κB activation and inflammasome gene regulation[J]. Br J Ophthalmol, 2016, 100 (5): 713-718. DOI:10.1136/bjophthalmol-2015-307213. |
| [12] | Li Q, Zhang X, Wang W, et al. CPT-11 activates NLRP3 inflammasome through JNK and NF-κB signalings[J]. Toxicol Appl Pharmacol, 2015, 289 (2): 133-141. DOI:10.1016/j.taap.2015.09.025.2015. |
| [13] | Greaney AJ, Maier NK, Leppla SH, et al. Sulforaphane inhibits multiple inflammasomes through an Nrf2-independent mechanism[J]. J Leukoc Biol, 2016, 99 (1): 189-199. DOI:10.1189/jlb.3A0415-155RR. |
| [14] | Lee J, Ahn H, Hong EJ, et al. Sulforaphane attenuates activation of NLRP3 and NLRC4 inflammasomes but not AIM2 inflammasome[J]. Cell Immunol, 2016, 306-307 : 53-60. DOI:10.1016/j.cellimm.2016.07.007. |
| [15] |
岳海英, 胡凯, 蒋健, 等. 小型猪右胸单次大剂量γ射线照射后的肺损伤研究[J].
中华放射医学与防护杂志, 2015, 35 (8): 561-565. H Y, Hu K, Jiang J, et al. The study on lung injury of minipigs' right-thorax with a single high-dose γ-ray irradiation[J]. Chin J Radiol Med Prot, 2015, 35 (8): 561-565. DOI:10.3760/cma.j.issn.0254-5098.2015.08.001. |
| [16] | Bryan NB, Dorfleutner A, Rojanasakul Y, et al. Activation of inflammasomes requires intracellular redistribution of the apoptotic speck-like protein containing a caspase recruitment domain[J]. J Immunol, 2009, 182 (5): 3173-3182. DOI:10.4049/jimmunol.0802367. |
| [17] | [JP3]DuewellP, KonoH, RaynerKJ, 等. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J]. Nature, 2010, 464 (7293): 1357-1361. DOI:10.1038/nature08938. |
| [18] | Scheithauer H, Belka C, Lauber K, et al. Immunological aspects of radiotherapy[J]. Radiat Oncol, 2014, 9 : 185 DOI:10.1186/1748-717X-9-185. |
| [19] | Qi T, Xu F, Yan X, et al. Sulforaphane exerts anti-inflammatory effects against lipopolysaccharide-induced acute lung injury in mice through the Nrf2/ARE pathway[J]. Int J Mol Med, 2016, 37 (1): 182-188. DOI:10.3892/ijmm.2015.2396. |
| [20] | Dadrich M, Nicolay NH, Flechsig P, et al. Combined inhibition of TGFβ and PDGF signaling attenuates radiation-induced pulmonary fibrosis[J]. Oncoimmunology, 2016, 5 (5): e1123366 DOI:10.1080/2162402X.2015.1123366. |
| [21] | Song L, Huang Y, Zhao M, et al. A critical role for hemolysin in vibrio fluvialis-induced IL-1β secretion mediated by the NLRP3 inflammasome in macrophages[J]. Front Microbiol, 2015, 6 : 510 DOI:10.3389/fmicb.2015.00510. |
| [22] | Jimi E, Fukushima H. NF-κB signaling pathways and the future perspectives of bone disease therapy using selective inhibitors of NF-κB[J]. Clin Calcium, 2016, 26 (2): 298-304. |
| [23] |
刘静, 张舒羽, 曹建平. 核转录因子κB分子靶点在克服肿瘤放疗抵抗中的研究进展[J].
中华放射医学与防护杂志, 2013, 33 (6): 675-678. Liu J, Zhang SY, Cao JP. Progress on study of nuclear factor-κB as the molecular target of radiotherapy resistance to cancer[J]. Chin J Radiol Med Prot, 2013, 33 (6): 675-678. DOI:10.3760/cma.j.issn.0254-5098.2013.06.030. |
| [24] |
张朦, 熊耀祖, 涂彧, 等. 大鼠放射性脑损伤模型中核转录因子-κB表达的动态变化规律[J].
中华放射医学与防护杂志, 2015, 35 (9): 657-662. Zhang M, Xiong YZ, Tu Y, et al. The dynamic changes of nuclear factor-κB during brain injury of irradiated rats[J]. Chin J Radiol Med Prot, 2015, 35 (9): 657-662. DOI:10.3760/cma.j.issn.0254-5098.2015.09.004. |
| [25] | Futosi K, Fodor S, Mócsai A. Reprint of neutrophil cell surface receptors and their intracellular signal transduction pathways[J]. Int Immunopharmacol, 2013, 17 (4): 1185-1197. DOI:10.1016/j.intimp.2013.11.010. |
| [26] | Mitchell S, Vargas J, Hoffmann A. Signaling via the NF-κB system[J]. Wiley Interdiscip Rev Syst Biol Med, 2016, 8 (3): 227-241. DOI:10.1002/wsbm.1331. |
| [27] | Reddy SA, Shelar SB, Dang TM, et al. Sulforaphane and its methylcarbonyl analogs inhibit the LPS-stimulated inflammatory response in human monocytes through modulating cytokine production, suppressing chemotactic migration and phagocytosis in a NF-κB-and MAPK-dependent manner[J]. Int Immunopharmacol, 2015, 24 (2): 440-450. DOI:10.1016/j.intimp.2014.12.037. |
| [28] | González-Ramos R, Defrère S, Devoto L. Nuclear factor-kappaB: a main regulator of inflammation and cell survival in endometriosis pathophysiology[J]. Fertil Steril, 2012, 98 (3): 520-528. DOI:10.1016/j.fertnstert.2012.06.021. |
| [29] | Zhong Z, Umemura A, Sanchez-Lopez E, et al. NF-κB restricts inflammasome activation via elimination of damaged mitochondria[J]. Cell, 2016, 164 (5): 896-910. DOI:10.1016/j.cell.2015.12.057. |
 2017, Vol. 37
2017, Vol. 37


