2. 215000 苏州 南京医科大学附属苏州医院放疗科
2. Department of Radiotherapy and Oncology, Nanjing Medical University Affiliated Suzhou Hospital, Suzhou 215000, China
放射治疗在脑部原发及转移肿瘤的治疗中起着不可替代的作用。因此, 与治疗相关的远期不良反应愈来愈受关注。其中, 颅脑放疗后认知功能障碍的发生率逐年升高, 严重影响了患者的生活质量, 已成为目前研究的重点[1-3]。研究表明, 大脑海马区神经发生 (neurogenesis) 在改变神经可塑性过程中起关键作用[4-7]。但是到目前为止, 电离辐射导致神经发生损伤的发病机制仍不清楚。
酪氨酸激酶TrkA作为神经生长因子 (NGF) 的下游信号通路之一, 改变两者的结合信号通路能有效改变神经凋亡及神经发生[8-9]。而TrkB作为脑源性神经因子 (BDNF) 的下游信号通路之一, 两者结合可有效激活ERK1/2、AKT信号, 发生级联相关反应, 能够改变细胞的存活[10-12]。因此, 本研究采用高尔基 (Giolgi) 染色、Western blot、RT-PCR技术研究全脑照射对大鼠海马神经发生及TrkA、TrkB蛋白、mRNA表达的影响, 探讨TrkA、TrkB在放射性神经发生损伤中的作用。
材料与方法1.试剂:兔抗TrkA、兔抗TrkB (英国Abcam公司), FITC标记山羊抗兔IgG (H+)(江苏碧云天生物技术研究所), FD Rapid GolgiStainTMKit (美国FD NeuroTechnologies公司), 反转录试剂盒 (美国Thermo公司)。
2.动物分组及照射条件:56只21 d龄SPF级健康雄性SD大鼠 (苏州大学动物实验中心提供, 合格证号:No.201507460), 体重 (50±10) g, 按照随机数字表法分为照射组和健康对照组, 每组28只, 实验动物操作均经过苏州大学实验动物伦理委员会通过。照射组大鼠经3.6%水合氯醛 (360 mg/kg) 腹腔麻醉后, 将大鼠俯卧摆位于治疗床上, 并置于2 cm×3.5 cm特制铅模下, 采用德国西门子公司直线加速器产生的4 MeV电子线进行10 Gy单次全脑照射。照射剂量率为210~220 cGy/min, 源皮距为95 cm, 电子线透过铅模照射孔到达大鼠头部, 铅模上有射孔8个, 每次可同时照射大鼠8只。照射野前界为双眼后眦连线, 后界为双耳后连线, 左右露空, 用铅块遮盖照射野内大鼠眼睛及其他部位。健康对照组大鼠经腹腔麻醉后置于相同照射环境下, 给予0 Gy照射。闭路电视监控过程, 照射结束待其苏醒后分笼饲养。
3. Western blot检测:大鼠经3.6%水合氯醛 (360 mg/kg) 腹腔麻醉后, 分离海马组织, 裂解液裂解后12 000×g离心10 min, 取上清, BCA蛋白定量试剂盒检测蛋白浓度, 变性, -20℃储存, 按每空上样量30 μg进行SDS-PAGE电泳, 300 mA恒流转膜90 min, 5%脱脂奶粉封闭1 h。一抗4℃孵育过夜 (TrkA 1:2 000和TrkB 1:2 000), 用三 (羟甲基) 氨基甲烷-盐酸缓冲盐溶液洗膜15 min ×3次, 加羊抗兔IgG (1:2 000), 37℃孵育1 h后, 用TBST洗膜5 min×3次。ECL显色试剂盒显影。以上实验重复3次。
4.RT-PCR:提取大鼠海马组织RNA, 应用反转录试剂盒反转录合成cDNA, 引物设计由上海生工生物科技有限公司完成 (TrkA:正义CTGACCAATGAGACCATGCGG, 反义AGAAGGAGACAGGGATGGGGT; TrkB:正义TGGAGGAAGGGAAGTCTGTG, 反义CCTGTGTGTGGCTTGTTTCA)。SYBR Green PCR Master Mix进行实时定量RT-PCR扩增, 以GAPDH作为内参参照, 按照下述公式计算不同处理组基因的相对表达量:基因相对表达量=2-ΔΔCT样品-ΔCT对照。
5.高尔基染色:照射后1个月, 大鼠经3.6%水合氯醛 (360 mg/kg) 腹腔麻醉后, 分离海马组织, 按试剂盒说明置于室温提前混合好的A液和B液中, 14 d, 移入C液中, 24 h后换液, 2~7 d后行冰冻切片, 将片子用双蒸水洗涤两遍, 后放入D液和E液各5 ml以及15 ml双蒸水, 10~15 min后再用双蒸水洗涤两遍, 后行乙醇梯度脱水, 二甲苯透明, 树胶封片。
6.免疫荧光染色:照射后1个月, 大鼠经3.6%水合氯醛 (360 mg/kg) 腹腔麻醉后, 相继用磷酸盐缓冲液 (PBS)、4%多聚甲醛溶液行心脏灌注。取出脑组织, 置入4%多聚甲醛溶液中进行固定, 再经15%、30%蔗糖溶液梯度脱水后冷冻, 切片, 厚度为30 μm。每6张连续的脑片中选取1张进行免疫荧光染色, 切片经PBS漂洗3次, 胎牛血清封闭2 h, 一抗孵育。24 h后脑片经PBS漂洗3次, 二抗孵育1 h后贴片观察。所用一抗为兔抗DCX, 二抗为Alexa Flour 488山羊抗兔。
7.图像采集与分析:使用正置显微镜观察 (德国Leica公司DM500型) 采集照片。采集的照片用Image J进行树突棘形态以及数量的观察。
8.统计学处理:数据以x±s表示, 用GraphPad Prism 5.0软件进行统计分析。经正态性检验符合正态分布, 同一时间点两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
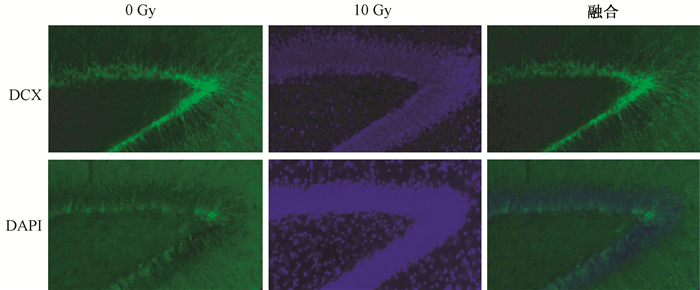
结果1.全脑照射后神经元增殖变化:全脑照射后神经元增殖变化情况见图 1。全脑照射后1个月, 照射组与健康对照组相比, 双皮质素 (DCX) 数量明显减少 (t=6.49, P < 0.05)。
|
图 1 全脑照射后照射组 (10 Gy) 与健康对照组 (0 Gy) 神经元增殖的变化情况 免疫荧光染色×40 Figure 1 The proliferation of neurons between irradiation group (10 Gy) and control group (0 Gy) Immunostaining image ×40 |
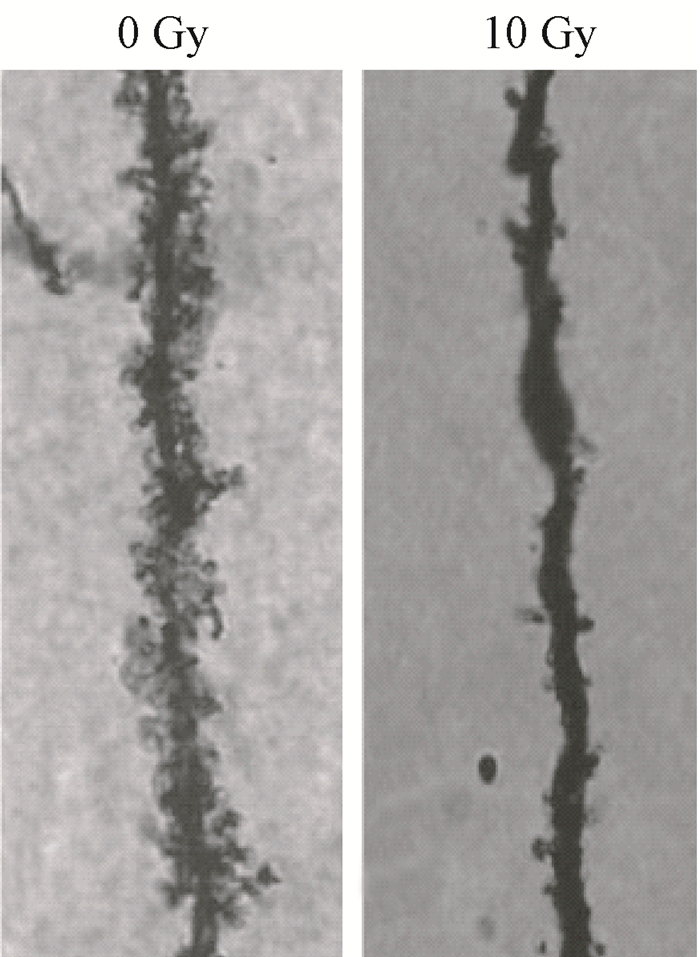
2.全脑照射后树突棘变化:全脑照射后树突棘变化情况见图 2。全脑照射后1个月, 照射组与健康对照组相比树突棘数量明显减少, 树突棘形态明显变小。
|
图 2 全脑照射后照射组 (10 Gy) 与健康对照组 (0 Gy) 树突棘变化对比×100 Figure 2 Morphological changes of dendritic spines between irradiation group (10 Gy) and control group (0 Gy) after whole brain irradiation Image ×100 |
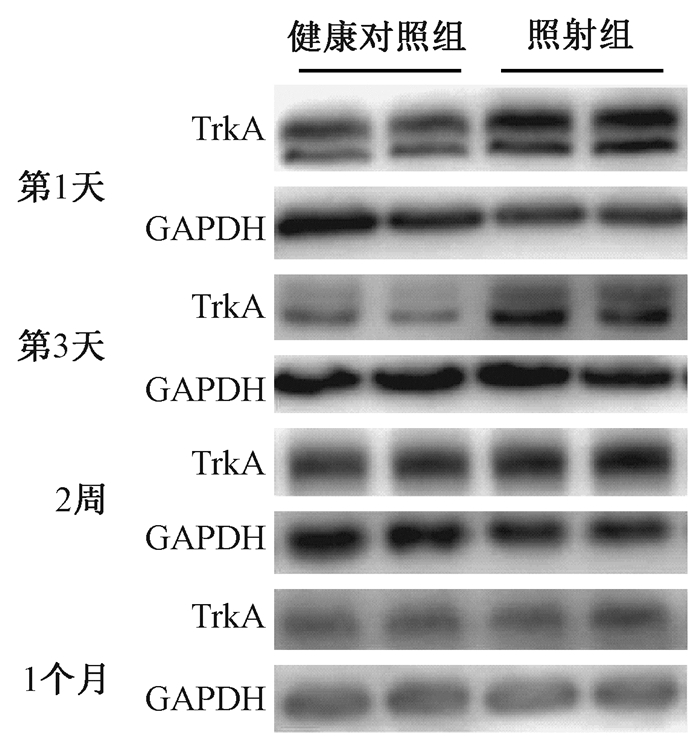
3.TrkA蛋白及mRNA变化情况:全脑照射后各时间点TrkA蛋白水平检测见图 3。全脑照射后1、3 d, 2周、1个月, 照射组与对照组相比, 蛋白水平分别增加了34%、32%、31%、28%, 差异均有统计学意义 (t=2.64、3.06、4.80、2.64, P < 0.05), 见表 1。全脑照射后1、3 d, 2周、1个月, 照射组与健康对照组相比mRNA水平分别增加了40%、27%、47%、28%, 差异均有统计学意义 (t=4.57、3.06、5.39、5.86, P < 0.05), 见表 1。
|
图 3 全脑照射后不同时间两组大鼠海马组织TrkA蛋白表达 Figure 3 Expressions of TrkA protein in hippocampus at different time after whole brain irradiation |
|
|
表 1 全脑照射后不同时间大鼠海马组织TrkA、TrkB蛋白及mRNA的表达 (x±s) Table 1 Expressions of TrkA and TrkB proteins and mRNAs in hippocampus at different time after whole brain irradiation (x±s) |
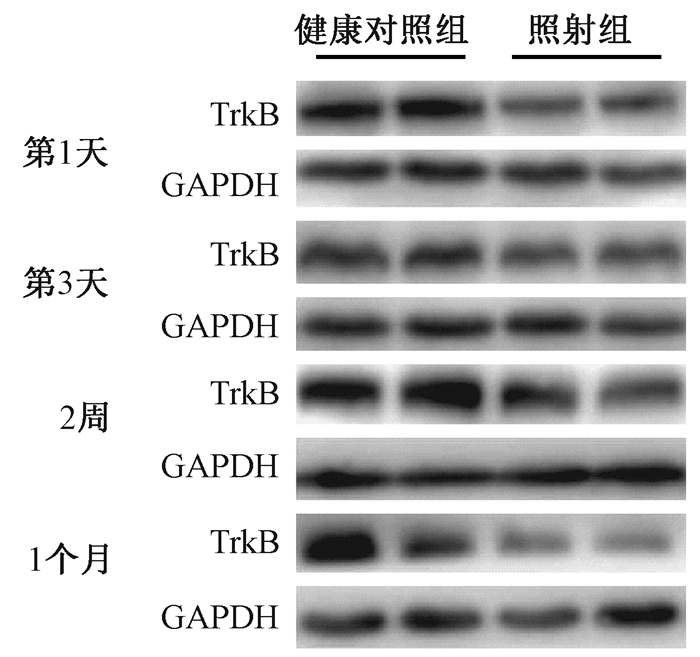
4.TrkB蛋白及mRNA变化情况:全脑照射后各时间点TrkB蛋白水平检测见图 4。全脑照射后1、3 d, 2周、1个月, 照射组和对照组相比蛋白水平分别降低了25%、43%、30%、38%, 差异均有统计学意义 (t=4.59、3.06、2.81、2.57, P < 0.05), 见表 1。全脑照射后1、3 d、2周, 照射组与健康对照组相比mRNA水平分别下降了62%、36%、33%, 差异均有统计学意义 (t=14.87、11.69、4.98, P < 0.05), 照射后1个月, 照射组与对照组相比mRNA水平下降了26%, 但差异无统计学意义 (P > 0.05), 见表 1。
|
图 4 全脑照射后不同时间大鼠海马组织TrkB蛋白表达水平 Figure 4 Expressions of TrkB protein level in hippocampus at different time after whole brain irradiation |
讨论
TrkA, 即跨膜络氨酸激酶A, 作为NGF下游信号通路分子, 与细胞存活密切相关, NGF通过TrkA影响其下游PI3K/AKT及MEK/ERK, 产生级联反应, 干预神经元凋亡, 影响神经发生[9]。TrkB, 即原肌球蛋白受体激酶B, 作为BDNF下游信号通路分子, 与轴突再生密切相关, 研究表明, TrkB基因敲除大鼠, 其树突再生明显受损, 从而影响认知及学习功能[13]。本实验通过给予SD大鼠10 Gy全脑照射, 成功建立放射脑损伤模型。全脑照射导致海马齿状回神经发生减弱在许多研究中得以证实[14]。神经发生主要发生在侧脑室下区 (SVZ) 和海马齿状回颗粒细胞下层 (SGZ)[15]。DCX是脑组织特异性微管相关蛋白, 其功能促进微管蛋白的聚合, 主要表达在处于迁移状态神经元前体细胞及年幼的神经元, 海马齿状回DCX阳性细胞数目与细胞增殖水平具有一定的相关性, DCX可以作为正常或疾病状态下定量研究神经发生水平的合适指标[16]。高尔基染色是研究神经元正常和非正常形态的最有效方法之一, 能够发现神经树突和树突棘微小的改变。
本研究通过对NGF以及BDNF下游的TrkA、TrkB进行蛋白以及mRNA水平研究, 探讨全脑照射后TrkA/TrkB在大鼠海马神经发生障碍中的作用机制。本组的前期研究中, 发现BDNF/TrkB信号通路在全脑照射后认知功能的改变中起重要作用, 提高BDNF/TrkB的表达能够有效改善认知以及学习功能[17]。在TrkA/TrkB之前的研究中, 发现其在阿尔茨海默病中扮演重要的角色, TrkA的改变代表上游NGF以及NGF前体的改变, 从而影响胆碱能神经元的退行性改变, 引起认知和学习记忆功能的改变[9,18]。
本研究发现在全脑照射后的1个月内, TrkA呈现明显的上升趋势, 而TrkB呈现明显的下降趋势, 在照后1个月时, TrkB的蛋白水平明显下降, 而mRNA水平也下降, 但差异无统计学意义, 可能与mRNA与蛋白变化不同步有关, 转录与翻译的水平不一致, 但整体上都呈下降趋势, 树突棘的形态数量与对照组明显改变, 推测两者在全脑照射后急性期海马的神经发生中存在着某种联系, 共同对全脑照射后海马神经发生障碍产生作用, 但其具体的机制仍需进一步研究。有报道证实, 通过小分子蛋白影响TrkA/TrkB受体的表达, 能够改善神经凋亡以及认知功能障碍, 可能通过BDNF/TrkB以及NGF/TrkA信号通路影响神经元的退行性改变[9,19-20]。
综上所述, 本研究发现了TrkA/TrkB在全脑照射后的不同变化情况, 为全脑照射导致的认知以及学习功能障碍研究提供了新的依据, 但仍有许多问题有待进一步研究, 包括如何干预TrkA/TrkB的表达, 从而改变认知和学习功能, 为临床研究提供实验基础。尽管如此, 该实验发现了TrkA/TrkB在全脑照射后的不同变化情况, 为以后的研究提供了参考。
利益冲突 本人与本人家属、其他研究者, 未因进行该研究而接受任何不正当的职务或财务利益, 在此对研究的独立性和科学性予以保证作者贡献声明 吴昊昊、丁昕为实验主要完成者, 收集数据撰写论文; 徐美玲、戴培文、张军军协助部分实验的完成; 冀胜军、田野设计研究方案并指导实验进行及论文修改
| [1] | Dropcho EJ. Neurotoxicity of radiation therapy[J]. Neurol Clin, 2010, 28 (1): 217-234. DOI:10.1016/j.ncl.2009.09.008. |
| [2] | Spalding KL, Bergmann O, Alkass K, et al. Dynamics of hippocampal neurogenesis in adult humans[J]. Cell, 2013, 153 (6): 1219-1227. DOI:10.1016/j.cell.2013.05.002. |
| [3] | Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial[J]. Lancet Oncol, 2009, 10 (11): 1037-1044. DOI:10.1016/S1470-2045(09)70263-3. |
| [4] | Greene-Schloesser D, Robbins ME. Radiation-induced cognitive impairment—from bench to bedside[J]. Neuro Oncol, 2012, 14 (Suppl 4): 37-44. DOI:10.1158/1078-0432.CCR-11-2903. |
| [5] | Hernandez-Rabaza V, Llorens-Martin M, Velazquez-Sanchez C, et al. Inhibition of adult hippocampal neurogenesis disrupts contextual learning but spares spatial working memory, long-term conditional rule retention and spatial reversal[J]. Neuroscience, 2009, 159 (1): 59-68. DOI:10.1016/j.neuroscience.2008.11.054. |
| [6] |
黄国栋, 罗鸣, 屈晓飞, 等. 电离辐射抑制海马区神经发生与放射性脑损伤认知损害的关系[J].
中华放射医学与防护杂志, 2013, 33 (2): 113-118. Huang GD, Luo M, Qu XF, et al. Relationship between impaired hippocampal neurogenesis and cognitive dysfunction induced by cranial radiation therapy[J]. Chin J Radiol Med Prot, 2013, 33 (2): 113-118. DOI:10.3760/cma.j.issn.0254-5098.2013.02.001. |
| [7] |
冀胜军, 孙锐, 蔡尚, 等. 组蛋白H3乙酰化在电离辐射所致神经发生障碍中的作用[J].
中华医学杂志, 2015, 95 (5): 374-377. Ji SJ, Sun R, Cai S, et al. Association of irradiation-induced hippocampal neurogenesis impairment with histone H3 acetylation[J]. Chin J Radiol Med Prot, 2015, 95 (5): 374-377. DOI:10.3760/cma.j.issn.0376-2491.2015.05.014. |
| [8] | Fortress AM, Buhusi M, Helke KL, et al. Cholinergic degeneration and alterations in the TrkA and p75NTR balance as a result of Pro-NGF injection into aged rats[J]. J Aging Res, 2011, 2011 : 460543 DOI:10.4061/2011/460543. |
| [9] | Lazaridis I, Charalampopoulos I, Alexaki VI, et al. Neurosteroid dehydroepiandrosterone interacts with nerve growth factor (NGF) receptors, preventing neuronal apoptosis[J]. PLoS Biol, 2011, 9 (4): e1001051 DOI:10.1371/journal.pbio.1001051. |
| [10] | Kim GS, Cho S, Nelson JW, et al. TrkB agonist antibody pretreatment enhances neuronal survival and long-term sensory motor function following hypoxic ischemic injury in neonatal rats[J]. PLoS One, 2014, 9 (2): e88962 DOI:10.1371/journal.pone.0088962. |
| [11] | Castello NA, Nguyen MH, Tran JD, et al. 7, 8-Dihydroxyflavone, a small molecule TrkB agonist, improves spatial memory and increases thin spine density in a mouse model of Alzheimer disease-like neuronal loss[J]. PLoS One, 2014, 9 (3): e91453 DOI:10.1371/journal.pone.0091453. |
| [12] | Rostami E, Krueger F, Plantman S, et al. Alteration in BDNF and its receptors, full-length and truncated TrkB and p75(NTR) following penetrating traumatic brain injury[J]. Brain Res, 2014, 15 (42): 195-205. DOI:10.1016/j.brainres.2013.10.047. |
| [13] | English AW, Liu K, Nicolini JM, et al. Small-molecule trkB agonists promote axon regeneration in cut peripheral nerves[J]. Proc Natl Acad Sci USA, 2013, 110 (40): 16217-16222. DOI:10.1073/pnas.1303646110. |
| [14] | Gao G, Tian B, Liu L, et al. Expression of deinococcus radiodurans PprI enhances the radioresistance of escherichia coli[J]. DNA Repair (Amst), 2003, 2 (12): 1419-1427. DOI:10.1016/j.dnarep.2003.08.012. |
| [15] | Griffin CS, Thacker J. The role of homologous recombination repair in the formation of chromosome aberrations[J]. Cytogenet Genome Res, 2004, 104 (1-4): 21-27. DOI:10.1159/000077462. |
| [16] | Gupta RC, Bazemore LR, Golub EI, et al. Activities of human recombination protein Rad51[J]. Proc Natl Acad Sci USA, 1997, 94 (2): 463-468. DOI:10.1073/pnas.1303646942. |
| [17] | Ji JF, Ji SJ, Sun R, et al. Forced running exercise attenuates hippocampal neurogenesis impairment and the neurocognitive deficits induced by whole-brain irradiation via the BDNF-mediated pathway[J]. Biochem Biophys Res Commun, 2014, 443 (2): 646-651. DOI:10.1016/j.bbrc.2013.12.031. |
| [18] | Yu T, Calvo L, Anta B, et al. Regulation of trafficking of activated TrkA is critical for NGF-mediated functions[J]. Traffic, 2011, 12 (4): 521-534. DOI:10.1111/j.1600-0854.2010.01156.x. |
| [19] | Barcelona PF, Saragovi HU. A Pro-Nerve growth factor (proNGF) and NGF binding protein, alpha2-Macroglobulin, differentially regulates p75 and TrkA receptors and is relevant to neurodegeneration ex vivo and in vivo[J]. Mol Cell Biol, 2015, 35 (19): 3396-3408. DOI:10.1128/MCB.00544-15. |
| [20] | Alsina FC, Irala D, Fontanet PA, et al. Sprouty4 is an endogenous negative modulator of TrkA signaling and neuronal differentiation induced by NGF[J]. PLoS One, 2012, 7 (2): e32087 DOI:10.1371/journal.pone.0032087. |
 2017, Vol. 37
2017, Vol. 37


