目前,乳腺癌保乳术+术后放疗的方法,已成为早期乳腺癌的首选治疗方式[1-2],它可在保证患者生存率的同时,又兼顾了乳房美观,大大提高患者生活质量。当前,调强放疗技术越来越多的应用于乳腺癌保乳术后的放疗[3],因为它可以更好地降低正常组织并发症的发生率,同时提高肿瘤局控率[4]。螺旋断层放疗 (Tomotherapy) 系统是目前实施调强放疗最先进的设备之一。治疗过程中通过床的进动,TOMO系统不仅可以对整个靶区行360°的全角度薄层照射,即TomoHelical螺旋断层治疗模式[5];而且可以通过设定固定的机架角度,对整个靶区实施固定野薄层照射,即TomoDirect固定野断层治疗模式[6]。本研究回顾性地将4野和6野TomoDirect (TD4和TD6) 及TomoHelical (TH) 技术分别应用于左侧乳腺癌保乳术后患者,旨在系统比较和评估3种技术所得到的乳腺癌放疗计划的剂量学优劣,以期为左侧乳腺癌保乳术后患者的临床治疗提供参考。
资料与方法1.临床资料:选取2016年1月至2016年9月在福建省肿瘤医院接受放疗的16例左侧保乳术后的早期乳腺癌女性患者,术后病理分期0~ⅡA期,病理类型为浸润性导管癌,需要接受术后放疗。年龄为28~56岁,中位年龄43岁,靶区体积为 (512.0±152.1) cm3。患者均通过医院伦理委员会论证,签署知情同意书。
2.模拟定位及靶区、危及器官勾画:乳腺癌患者取仰卧位,手臂充分上抬,采用真空垫加体部网膜固定,在大孔径Brilliance Bigbore CT (美国飞利浦公司) 下,选取层厚5 mm,进行定位扫描。扫描得到的CT图像数据传至医生工作站,由专业的放疗科主任医师勾画靶区和危及器官。其中, CTV包含左侧乳腺腺体及胸壁的淋巴引流区, CTV均匀外扩0.5 cm形成PTV, PTV前界回缩至皮下0.5 cm。危及器官包括:患侧肺、健侧肺、健侧乳腺、心脏、脊髓。勾画好靶区和危及器官的CT图像数据传输至Tomotherapy (美国Accuray公司) 系统,分别设计4野和6野的TomoDirect及TomoHelical 3种模式的治疗计划。
3.治疗计划设计与计划目标:PTV处方剂量为45 Gy/25次,要求处方剂量包绕95%靶区体积。危及器官限量要求:脊髓最大剂量 (Dmax)<40 Gy,心脏平均剂量 (Dmean)<7 Gy,健侧乳腺最大剂量 (Dmax)<10 Gy,接受5 Gy照射的肺体积占肺总体积的百分比 (V5)<60%,接受20 Gy照射的肺体积占肺总体积的百分比 (V20)<20%。
TomoHelical技术设计治疗计划的剂量计算网格选择精细 (Fine),以提供最精确的分辨率,射野宽度为5 cm,调制因子2.8,螺距0.287;TomoDirect治疗计划采取与TomoHelical治疗计划相同的参数设置。TomoDirect设计治疗计划中,4野计划的布野角度分别为305°±10°,325°±10°,115°±10°和130°±10°;6野计划的布野角度在4野的基础上,增加2个照射野335°±10°和105°±10°。布野总体原则是根据靶区与危及器官间的关系确定合适的射野角度。为减少研究中的干扰因素,TomoDirect治疗计划的其他参数设置与TomoHelical计划保持一致。
4.放疗计划评估指标:通过剂量体积直方图 (DVH) 和剂量分布来评估计划,评估参数按照国际辐射单位和测量委员会 (ICRU)83号报告建议[7],评估PTV 98%、95%、50%、2%体积的剂量:D98%、D95%、D50%、D2%,平均剂量 (Dmean),及均匀性指数HI和适形指数CI。均匀性指数定义为HI=(D2%-D98%)/D50%,0<HI<1,该值越接近0,表示靶区剂量均匀性越好;适形指数定义为CI=Vt, ref×Vt, ref /Vt×Vref, 其中Vt为靶区体积,Vt, ref为处方剂量所包绕的靶区体积,Vref为处方剂量线所包绕的体积,0<CI<1,该值越接近1,表示靶区剂量适形度越高[3]。危及器官评估:患侧肺和全肺的Dmean、V5、V15、V20、V30,心脏Dmean、V30、V40,脊髓Dmax、D1cc,健侧乳腺Dmax、Dmean,体轮廓扣除靶区后的正常组织区域 (E-P) 的V5、V10、V22.5(Vx表示靶区接受x剂量的照射体积;Dmean平均剂量,D1cc表示1 cm3的体积接受的剂量;Dmax表示最大剂量;Dx表示x%的体积接受的剂量)。统计3种技术设计的计划的总机器跳数和治疗时间。
5.统计学处理:数据采用x±s的形式表示。通过SPSS 15.0软件对数据进行单因素方差分析,组内比较采用最小显著差异法 (LSD),P<0.05为差异有统计学意义。
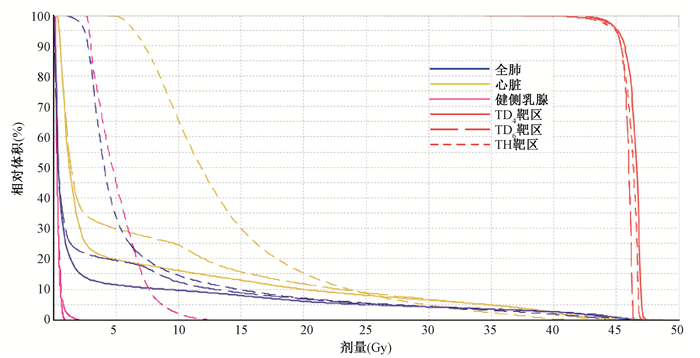
结果1.靶区剂量体积参数比较:表 1为3种TOMO治疗计划的靶区PTV剂量学参数,TD4、TD6和TH 3种技术设计的左侧乳腺癌保乳术后放疗计划都能达到满意的靶区剂量覆盖,且靶区受到的高量D2%差异无统计学意义 (P>0.05),但是对于低量区,TD4的D98%最低 (F=4.10,P<0.05),TD6与TH相当。将靶区均匀性、适形度进行优劣排序,分别为TH=TD6>TD4和TH>TD6>TD4(F=60.93,P<0.05)。图 1为1例乳腺癌患者同一部位3种放疗计划的剂量体积直方图。
|
|
表 1 乳腺癌患者3种TOMO治疗计划的靶区剂量学参数比较 (x±s) Table 1 Comparison of PTV for left-breast cancer among three treatment plans in Tomotherapy system (x±s) |
|
图 1 1例乳腺癌患者3种放疗计划的剂量体积直方图 (DVH) Figure 1 The dose volume histogram (DVH) of three treatment plans for one left-breast cancer patient |
2.危及器官和正常组织的剂量体积参数比较:结果显示,对于脊髓和健侧乳腺的保护,TD技术极大地优于TH技术,且以TD4技术设计的计划为最优 (F=595.60、129.24,P<0.05);对于心脏的受量,TD4和TD6的Dmean均低于TH (F=65.37,P<0.05);正常组织E-P的受量情况,低剂量参数V5和V10,以TD4和TD6技术设计的计划有明显优势 (F=111.48、41.07,P<0.05),但对比高剂量参数V22.5,3种技术设计的计划差异无统计学意义 (P>0.05),见表 2。在肺的受量上,低剂量参数V5以TD4技术有明显优势,TD6技术次之,TH技术为最差 (F=60.443,P<0.05);对于肺的V15、V20和V30,3种技术设计的计划没有统计学差异 (P>0.05),如表 3所示。综上表明TomoDirect技术对于左侧乳腺癌保乳术后患者的正常器官的保护具有明显的优势。
|
|
表 2 乳腺癌患者3种TOMO治疗计划的脊髓、心脏、健侧乳腺及正常组织区域的剂量参数比较 (x±s) Table 2 Comparison of dose parameters of cord, heart, breast-R and E-P in left-breast cancer patients among three treatment plans in Tomotherapy system (x±s) |
|
|
表 3 乳腺癌患者3种TOMO治疗计划的患侧肺和全肺的剂量参数比较 (x±s) Table 3 Comparison of dose parameters of Lung-L and Lung-all in left-breast cancer patients among three treatment plans in Tomotherapy system (x±s) |
3.计划治疗参数比较:对于机器跳数,TD4、TD6和TH技术设计的计划的平均机器跳数分别为3229, 2941和4077 MU, TD4和TD6技术较TH技术分别减少了20.80%和27.85%(F=24.89,P<0.05),而TD4和TD6技术间差异无统计学意义 (P>0.05);治疗时间上,TD4、TD6和TH技术设计的计划的平均治疗时间分别为266、265和293 s,TD4和TD6技术较TH技术分别缩短了9.36%和9.47%(F=3.75,P<0.05),而4野和6野TomoDirect技术间差异仅0.13%(P>0.05),可见对于TomoDirect技术其执行时间和机器跳数均具有优势,既缩短了治疗时间,降低了患者在治疗分次内的误差,又减少了加速器的损耗。
讨论临床上任何一项新发展的放疗技术,通常需要满足两个特征:一是能够改进剂量分布,二是能够缩短治疗时间。但往往为了提高剂量分布,治疗时间将被延长[8-9],故需要寻求二者间的平衡点。TomoHelical技术可以从360°(51个投射角) 断层式照射靶区,能提供适形度高且均匀性好的靶区剂量分布,可以实现较理想的临床剂量分布[4],但全角度的大面积照射,又势必造成除靶区外的其他危及器官和正常组织的低剂量区变大。因此,本研究中,为了更好地保护患侧肺和心脏,TomoDirect技术,即在TOMO机上实施固定野照射技术,加速器机头固定于某个角度,通过床的移动来对整个靶区长度实施断层照射,并结合叶片的开关及相应的时间对野内射线强度进行调制[5]。通过选择合适的切线野方向和数目,在保证靶区剂量均匀性和适形度的同时,可大大降低正常组织受照剂量及患者治疗时间。本研究对TomoDirect (4野和6野) 和TomoHelical技术应用于左侧乳腺癌保乳术后放疗计划的剂量学差异进行了系统比较。
研究结果表明,TomoDirect和TomoHelical两种TOMO治疗技术设计的乳腺癌计划,均能满足临床的要求。其中,4野TomoDirect技术对于危及器官和正常组织的剂量限制比TomoHelical技术低很多,但是对于靶区剂量均匀性和适形度方面,二者刚好相反。6野TomoDirect技术,在保证较TomoHelical技术低的危及器官限量的条件下,提高了4野TomoDirect计划的靶区均匀性和适形度。具体地,对于危及器官和正常组织来说,TomoDirect技术可以明显降低脊髓、健侧乳腺最大受照剂量。根据相关研究表明,健侧乳腺的受照剂量是放射诱导第二原发肿瘤的关键因素[10],TomoDirect技术则大大降低了这一风险的发生。对于肺的受量,Wang等[11]研究指出,肺V5是预测放射性肺炎的重要指标。Schllenkamp等[12]研究也表明,小剂量大体积的肺 照射比大剂量小体积的肺照射对肺功能损伤更大, 建议将V5控制在60%以内。本研究中,4野和6野TomoDirect技术设计的计划的肺V5均比TomoHelical的低,从而有效降低了乳腺癌患者放射性肺炎的发生。TomoHelical技术下肺V5偏高的原因为该技术在360°范围内51个方向上旋转连续出束,不可避免地造成肺组织低剂量区受照体积偏高。在心脏的受量方面,放射性心脏损伤是乳腺癌放射治疗中另一个重要的并发症。心脏Dmean的减少,对降低远期心脏损伤的发生具有关键的意义[13-14],在本研究中,比起TomoHelical技术,TomoDirect技术设计出的计划心脏Dmean更低,故而可以更好地保护心脏。
分析可见,4野TomoDirect技术设计出的乳腺癌计划,对于危及器官和正常组织的放射损伤控制得最为理想,但靶区剂量分布均匀性和适形度较差 (影响术后乳房美容效果)[15],分析原因是射野数过少。因此,本研究在4野调强照射的基础上,又增加了2个照射野,提出6野TomoDirect技术设计方案。从结果可以看出,虽然6野TomoDirect计划的靶区均匀性和适形度仍略逊于TomoHelical计划,但较之4野TomoDirect计划已有很大改善。此外,需要指出的是,6野TomoDirect计划的危及器官的受量虽然较4野有些许提高,但仍远远低于TomoHelical计划。
综上所述,对于左侧乳腺癌保乳术后放疗,TomoDirect技术可以给出较TomoHelical技术优越的危及器官受量,但4野TomoDirect计划的靶区剂量分布均匀性和适形度较TomoHelical计划差很多。相比之下,6野TomoDirect计划在二者之间取得了较好的平衡,在保证较TomoHelical技术低的危及器官限量的条件下,同时又减少了机器跳数和治疗时间,提高了4野TomoDirect计划的靶区均匀性和适形度,兼顾了早期乳腺癌患者的乳房美观,更有助于提高患者的远期生活质量。当然,由于本研究的结论很大程度依赖于靶区勾画和计划设计,因此,此研究结论很大程度与本研究的医生与物理师的水平和工作习惯相关。若其他医院参考本结论时,建议依据自身工作经验与习惯进行分析与借鉴。
利益冲突 作者申明与其他作者以及基金无任何利益冲突作者贡献声明 林金勇负责计划设计、数据整理与分析、论文撰写;吴君心和潘建基负责病例选择和靶区以及危及器官的勾画;郑明志、陈济鸿和程燕铭参与计划设计和数据采集;胡彩容和柏朋刚参与数据统计处理;张秀春和陆军负责实验总体安排和论文修改
| [1] | Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15 (7): e279-e289. DOI:10.1016/S1470-2045(13)70567-9. |
| [2] |
李建彬, 于金明, 徐敏. 乳腺癌保乳术后放疗进展[J].
中华放射肿瘤学杂志, 2010, 19 (2): 170-175. Li JB, Yu JM, Xu M. Advances in radiotherapy for breast cancer after breast conserving surgery[J]. Chin J Radiat Oncol, 2010, 19 (2): 170-175. DOI:10.3760/cma.j.issn.1004-4221.2010.02.027. |
| [3] |
周桂霞, 戴相昆, 徐寿平, 等. 乳腺癌术后放疗3种治疗计划的剂量学研究[J].
中华放射医学与防护杂志, 2010, 30 (3): 314-316. Zhou GX, Dai XK, Xu SP, et al. Dosimetric study of three different kinds of radiotherapy technique for post-operative breast cancer[J]. Chin J Radiol Med Prot, 2010, 30 (3): 314-316. DOI:10.3760/cma.j.issn.0254-5098.2010.03.022. |
| [4] | Vicini FA, Sharpe M, Kestin L, et al. Optimizing breast cancer treatment efficacy with intensity-modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2002, 54 (5): 1336-1344. DOI:10.1016/S0360-3016(02)03746-X. |
| [5] | Jeraj R, Mackie TR, Balog J, et al. Radiation characteristics of helical tomotherapy[J]. Med Phys, 2004, 31 (2): 396-404. DOI:10.1118/1.1639148. |
| [6] | Lee HC, Kim SH, Suh YJ, et al. A prospective cohort study on postoperative radiotherapy with TomoDirect using simultaneous integrated boost technique in early breast cancer[J]. Radiat Oncol, 2013, 9 (1): 244-244. DOI:10.1186/s13014-014-0244-0. |
| [7] | Hodapp N. The ICRU Report 83:prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188 (1): 97-99. DOI:10.1093/jicru/ndw028. |
| [8] | Hall EJ. Intensity-modulated radiation therapy, protons, and the risk of second cancers[J]. Int J Radiat Oncol Biol Phys, 2006, 65 (1): 1-7. DOI:10.1016/j.ijrobp.2006.01.027. |
| [9] | Seppälä J, Lahtinen T, Kolmonen P. Major reduction of monitor units with the avoidance of leaf-sequencing step by direct aperture based IMRT optimisation[J]. Acta Oncol, 2009, 48 (3): 426-430. DOI:10.1080/02841860802372264. |
| [10] | Yadav BS, Sharma SC, Patel FD, et al. Second primary in the contralateral breast after treatment of breast cancer[J]. Radiother Oncol, 2008, 86 (2): 171-176. DOI:10.1016/j.radonc.2007.10.002. |
| [11] | Wang SL, Liao ZX, Wei X, et al. Analysis of clinical and dosimetric factors associated with treatment-related pneumonitis (TRP) in patients with non-small-cell lung cancer (NSCLC) treated with concurrent chemotherapy and three-dimensional conformal radiotherapy (3D-CRT)[J]. Int J Radiat Oncol Biol Phys, 2006, 66 (5): 1399-407. DOI:10.1016/j.ijrobp.2006.07.1337. |
| [12] | Schallenkamp JM, Miller RC, Brinkmann DH, et al. Incidence of radiation pneumonitis after thoracic irradiation:dose-volume correlates[J]. Int J Radiat Oncol Biol Phys, 2007, 67 (2): 410-416. DOI:10.1016/j.ijrobp.2006.09.030. |
| [13] | Sardaro A, Petruzzelli M F, D'Errico M P, et al. Radiation-induced cardiac damage in early left breast cancer patients:risk factors, biological mechanisms, radiobiology, and dosimetric constraints[J]. Radiother Oncol, 2012, 103 (2): 133-142. DOI:10.1016/j.radonc.2012.02.008. |
| [14] |
杨波, 刘志凯, 侯晓荣, 等. 乳腺癌保乳术后螺旋断层治疗技术的剂量学研究[J].
中华放射肿瘤学杂志, 2013, 22 (5): 411-413. Yang B, Liu ZK, Hou XR, et al. Study the dosimetric for whole breast irradiation with fixed field IMRT and helical tomotherapy[J]. Chin J Radiat Oncol, 2013, 22 (5): 411-413. |
| [15] | Pignol JP, Olivotto I, Rakovitch E, et al. A multicenter randomized trial of breast intensity-modulated radiation therapy to reduce acute radiation dermatitis-breast diseases:a YB quarterly[J]. J Clin Oncol, 2008, 26 (13): 2085-2092. DOI:10.1200/JCO.2007.15.2488. |
 2017, Vol. 37
2017, Vol. 37


