2. 266001 青岛, 青岛大学附属医院耳鼻喉头颈外科
2. Department of Otolaryngology, The Affiliated Hospital of Qingdao University, Qingdao 266001, China
放疗与抗肿瘤药物联合是临床上大多数中晚期肿瘤的常用治疗方法,但肿瘤中普遍存在对放射治疗抗拒的乏氧细胞,是肿瘤复发和转移的主要根源之一。抗血管生成治疗可在一定的时间窗内使肿瘤血管“正常化”,改善血供,降低乏氧细胞比例,增强对放疗的敏感性。目前已发现,内源性抗血管新生药物重组人内皮抑素 (恩度) 能使肿瘤血管正常化,与传统的放化疗联合应用,使癌症患者获得了生存获益,显示了良好的应用前景[1-3]。但是,恩度与放化疗联合的机制尚未明了。本研究通过重组人内皮抑素联合放疗对胃癌小鼠生长抑制情况及RGS5、VEGF和HIF-1α表达的影响,探讨抗血管生成治疗联合放疗协同抑瘤作用的可能机制。
材料与方法1.实验动物及试剂:昆明小鼠32只,雌性,SPF级,6~8周,体重18~20 g,购于青岛药监局实验动物中心 (质量合格证号NO.003366)。小鼠胃癌细胞株 (MFC细胞系),购于青岛大学附属医院中心实验室。恩度注射液15 mg/支,由中国先声药业公司提供。兔抗鼠CD34抗体、兔抗鼠HIF-1α抗体、兔抗鼠VEGF抗体、兔抗鼠Ⅳ型胶原抗体、二氨基联苯胺 (DAB) 显色试剂、二抗均购自北京博奥森生物技术有限公司。兔抗鼠RGS5抗体购自美国ASSAY BIOTECH公司。美国瓦里安23EX直线加速器照射荷瘤小鼠,选用6 MV的X射线照射小鼠,覆盖厚度为1 cm的组织等效材料。
2.荷瘤小鼠的分组及处理:取对数生长期的MFC胃癌细胞,制备成浓度为5×106/ml的细胞悬液,将0.2 ml细胞悬液接种于小鼠左侧腋窝皮下,约1周后成瘤。待移植瘤直径达8~10 mm时,将32只荷瘤小鼠按随机数字表法分为生理盐水对照组 (NS对照组)、恩度组、单纯照射组 (RT组) 和恩度+单纯照射组 (恩度+RT组),4组,每组8只。NS对照组尾静脉注射生理盐水0.2 ml,连续注射14 d。恩度组尾静脉注射恩度2 mg/kg,约0.2 ml/只,连续注射14 d。RT组选用选用6 MV的X射线照射小鼠,源皮距100 cm,单次照射10 Gy,吸收剂量率300 Gy/min,恩度+RT组尾静脉注射恩度2 mg/kg,约0.2 ml/只,连续14 d,并于给药第7天进行同RT组的照射。
3.标本取材及肿瘤生长情况:小鼠进行不同处理后14 d采用颈椎脱位处死,摘取瘤体,称重,以10%甲醛溶液固定,待用。小鼠移植瘤成瘤后隔天检查其生长状态,使用游标卡尺隔日测量肿瘤最长直径a(mm) 与最短直径b(mm) 并按公式V=ab2/2计算肿瘤体积,绘制各组肿瘤生长曲线。根据肿瘤的重量来计算肿瘤生长抑制率 (IR)%=(1-各处理组平均瘤质量/对照组平均瘤质量)×100%。并观察小鼠的生活习性及精神状的变化。
4.微血管密度 (MVD) 测定:处死小鼠后取移植瘤组织,免疫组织化学 (SP法) 检测肿瘤组织中CD34表达情况。根据MVD的判定标准[4],采用先低倍后高倍的方法,先在低倍镜下选出微血管数量最丰富的区域,然后再计算4个高倍视野内的微血管的数量,计算其平均值。
5.检测VEGF及RGS5的表达:免疫组织化学 (SP法) 染色,瘤细胞和血管内皮细胞的胞浆内出现了棕黄色颗粒为VEGF的阳性表达;肿瘤细胞胞浆内出现棕黄色颗粒则为RGS5阳性表达。实验结果采用半定量分析的方法进行评分[4],0分为阴性,1~4分为弱阳性,5~8分为阳性 (++),9~12分为强阳性 (+++),阴性表达包括阴性和弱阳性,阳性表达包括阳性和强阳性。
6.肿瘤乏氧检测:采用免疫组织化学 (SP法) 检测HIF-1α表达,阳性表达可见胞浆内有棕黄色颗粒,且颜色明显高于背景底色。观察乏氧细胞在肿瘤组织中的分布情况,进一步采用如上所述的半定量积分法来判断其表达量的高低。
7.统计学处理:选择SPSS18.0软件包进行数据分析。数据结果采用x±s表示。用成组t检验进行组间差异的比较,相关性的判定用Pearson相关分析。P < 0.05为差异有统计学意义。
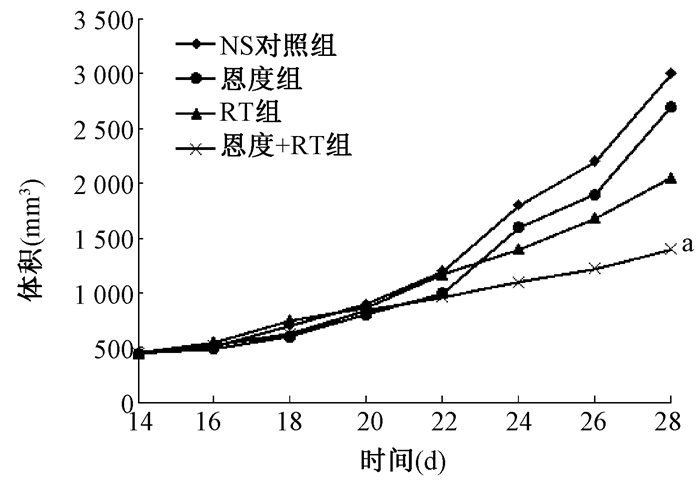
结果1.荷瘤小鼠移植瘤生长曲线及抑瘤率:对照组移植瘤生长迅速,部分肿瘤表面皮肤有破溃,RT组、恩度+RT组体积明显减小。从肿瘤生长曲线 (图 1) 可见,在种瘤后21 d肿瘤体积明显升高,4组进行比较发现,RT、恩度+RT组较恩度组、NS对照组生长明显减缓。最终,与其余3组比较,恩度+RT组肿瘤体积最小,差异有统计学意义 (t=7.6、6.9、4.5,P<0.05);恩度组比NS对照组肿瘤体积小,但差异无统计学意义 (P>0.05), 见图 1。各处理组肿瘤质量均比NS对照组减小,恩度+RT组、RT组较NS对照组差异有统计学意义 (t=7.4、5.6,P < 0.05),但恩度组、NS对照组间比较差异无统计学意义 (P﹥0.05),恩度+RT组小于RT组,差异有统计学意义 (t=4.2,P < 0.05)。恩度+RT组抑瘤率明显高于其他3组。
|
图 1 4组荷瘤小鼠移植瘤体积生长情况 注:a与NS对照组比较,t=7.6, P < 0.05。RT组.单纯照射组 Figure 1 The growth curves of transplantation tumor for four groups in mice |
2.小鼠移植瘤组织MVD测定结果:与NS对照组相比,其他3组CD34阳性微血管分布稀疏,染色较浅。NS对照组微血管密度高,恩度+RT组MVD值最低为 (19±5)/m2。恩度组 (41±11)/m2与NS对照组 (61±8)/m2比较,差异有统计学意义 (t=4.20,P<0.05)。
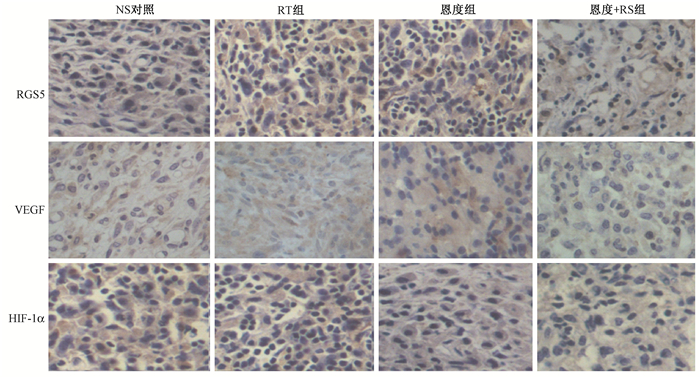
3.小鼠移植瘤组织中RGS5、VEGF及HIF-1α表达情况:NS对照组中,RGS5、VEGF及HIF-1α蛋白表达阳性肿瘤细胞染色较强,分布广泛。恩度组和恩度+RT组染色较弱,细胞阳性率低 (图 2)。恩度组、RT组及恩度+RT组HIF-1α表达比对照组减弱,其中恩度+RT组最明显 (t=6.5、8.2、13.1,P < 0.05)。与NS对照组相比,RT组VEGF表达量升高,恩度组和恩度+RT组表达量降低 (t=8.4、7.3、10.1,P < 0.05)。同时对比RGS5的表达,与NS对照组相比,恩度组和恩度+RT组明显降低 (t=6.2、7.4,P < 0.05),而RT组表达升高 (表 1)。
|
图 2 免疫组织化学染色测定RGS5、VEGF、HIF-1α在荷瘤小鼠移植瘤组织中的表达×400 Figure 2 IHC assay of RGS5, VEGF and HIF-1α in tumor tissue ×400 |
|
|
表 1 荷瘤小鼠移植瘤组织中RGS5、VEGF、HIF-1α的表达 (x±s) Table 1 The expression levels of RGS5, VEGF, and HIF-1α intransplantation tumor (x±s) |
4. HIF-1α与VEGF、RGS5的相关性分析:经t检验及Pearson相关性分析HIF-1α与VEGF、RGS5在荷瘤小鼠的移植瘤组织中表达情况得知,HIF-1α与VEGF、RGS5存在正相关 (r=0.57、0.71,P<0.05)。
讨论目前,恶性肿瘤的治疗仍是以放化疗为主,放化疗存在效率低、不良反应重、特异性差及近年无明显突破进展等局限性,这使得放化疗治疗肿瘤进入瓶颈期[5]。有研究认为,肿瘤生长转移是建立在血管过度生成基础上,肿瘤血管生成会促进肿瘤的发生、发展、浸润和转移,可通过阻断肿瘤血管的生成途径来取得良好的控制效果[6-9]。然而抗血管生成治疗治疗时间长、治疗不彻底,肿瘤会在治疗停止后复发,并没有取得人们预想的疗效[10]。对此,Jain [11-12]、Folkman和Kerbel[13]提出另一个观点, 即通过合理化的应用抗血管生成药物来改善肿瘤周边的微环境,使肿瘤周边的氧和药物的浓度显著升高从而取得更好的放化疗效果。
重组人血管内皮抑素2005年9月得到国家食品药品监督管理局 (SFDA) 批准上市[3],是目前临床上常用的一种抗血管生成药物。一项已完成的Ⅲ期多中心临床试验研究报道,恩度与化疗联合应用,可给肺癌患者带来生存获益,目前的临床实践指南已推荐Endostar与化疗联合做为非小细胞肿癌 (NSCLC) 的一线用药[14-16]。目前认为恩度通过抑制内皮细胞迁移来达到抑制肿瘤血管新生的作用,但是,具体机制尚未明确[17-18]。有关恩度联合放疗的机制,可以用“血管正常化时间窗”来解释,窗口期内氧供改善,增加了放射线杀伤肿瘤作用。此外,也有人认为与血管抑制剂减少了肿瘤细胞和内皮细胞等耗氧细胞的数量,增加了氧合有关;血管抑制剂还可以抑制放射治疗诱导的多种因子的产生,提高放射治疗敏感性。
本研究在预实验中已证实移植瘤血管正常化在6~8 d最明显,考虑此时乏氧状况改善最佳[19],因此,将照射时间定于第7天。本实验发现照射和恩度联合能在一定程度上抑制胃癌的移植瘤的生长,且联合治疗在疗效方面更优,对荷瘤小鼠毒性作用未见明显差异。抗血管生成抑制剂是通过抑制血管而产生间接抑瘤作用,单独的药物应用并不能收到明显的治疗效果。目前学界对于恩度联合放疗抑制肿瘤的生长研究有待深入,其确切机制也并不明确[20-23]。本实验发现与NS对照组、RT组相比,恩度组和恩度+RT组的微血管密度是降低的。这与恩度的抗血管生成作用有关。
本实验NS对照组中肿瘤的缺血缺氧会上调HIF-1α表达,促进下游基因转录,使VEGF产生适应性调节[24],是重要的上调VEGF因素。因此,HIF-1α与VEGF都是高表达,且呈正相关。单纯放疗会上调VEGF的表达,原因可能是放疗直接杀伤了肿瘤内的组织细胞和一部分的内皮细胞,从而导致残余和新生的肿瘤细胞因为需要血管的供氧和营养物质而进一步地生长,会促进血管保护因子VEGF的产生。而恩度的抗血管生成作用可下调VEGF的表达,恩度联合照射时,由于在放疗前一周就开始应用恩度,肿瘤血管被有效抑制,减弱了放射治疗的促进VEGF分泌的作用,恩度联合照射使VEGF的表达降低。另一方面放射治疗将大量肿瘤细胞杀伤后,降低了其负荷,细胞耗氧减少;同时血管保护因子的分泌减弱了放疗所致的血管抑制作用,放疗后原来肿瘤内的乏氧细胞可发生再氧合。综合以上肿瘤组织内发生的变化,肿瘤细胞内的氧供较未治疗者相对充足,RT组HIF-1α低表达。恩度使肿瘤血管正常化,改善乏氧,恩度组HIF-1α表达降低,因此放疗联合恩度可使HIF-1α表达进一步降低。此外,肿瘤血管内皮细胞形态异常,周细胞也有形态异常和功能缺失;未成熟周细胞相互之间及其与内皮细胞之间的联系松散,甚至消失。RGS5表达在未成熟周细胞,因此RGS5在NS对照组是高表达的[25-26]。Jin等[27]研究表明:RGS5是HIF-1α依赖的,并且接受低氧浓度的诱导调控。应用恩度后,肿瘤血管受到血管生成抑制剂的攻击而发生形态学上的改变,即血管趋正常化[28]。在此期间,未成熟周细胞分化为成熟周细胞,血管趋于稳定,形态相对规则,肿瘤乏氧改善,RGS5的表达是降低的。
可以进一步猜测恩度的血管正常化作用与下调RGS5表达有关。与NS对照组相比,恩度联合照射也会下调RGS5的表达,差异有统计学意义。进一步的相关性分析发现:HIF-1α与VEGF、RGS5在荷瘤小鼠的移植瘤组织中表达情况存在正相关。恩度联合放疗组抑瘤效果好的可能机制是通过抑制HIF-1α的表达,下调VEGF、RGS5的表达,抑制移植瘤血管生成,使其由杂乱趋于正常,提高放射治疗效果。
综上,本实验研究发现,恩度联合照射对胃癌荷瘤小鼠的移植瘤生长,VEGF、RGS5、HIF-1α的表达及微血管的生成均有抑制作用,说明联合治疗可能是通过抑制胃癌组织中HIF-1α的表达,下调VEGF、RGS5的表达,抑制胃癌微血管生成,提高放射治疗效果。本研究结果可为将恩度联合放疗试用于临床、改善患者预后提供了一定的参考。关于恩度联合放疗抑制肿瘤生长的作用机制目前已有多项研究,仍处于探索阶段,未达成一致。恩度联合照射的抑瘤作用是否存在其他机制, 对其机制更深入的研究尚有待于大量的实验室和临床的探索,对于恩度联合放疗的时序及血管正常化问题尚待进一步探讨。
利益冲突 文章全体作者无学术纷争,所写内容均中立客观,不存在任何利益冲突作者贡献声明 谭叶负责动物模型的建立、部分实验操作及论文撰写;王效军负责免疫组化;李美玲负责数据收集、统计分析;陆海军负责整体实验设计、论文撰写指导及修改
| [1] | Ling Y, Yang Y, Lu N, et al. Endostar, a novel recombinant human endostatin, exerts antiangiogenic effect via blocking VEGFinduced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J]. Biochem Biophys Res Commun, 2007, 361 (1): 79-84. DOI:10.1016/j.bbrc.2007.06.155. |
| [2] | Wen QL, Meng MB, Yang B, et al. Endostar, a recombined humanized endostatin, enhances the radioresponse for human nasopharyngeal carcinoma and human lung adenocarcinoma xenografts in mice[J]. Cancer Sci, 2009, 100 (8): 1510-1519. DOI:10.1111/j.1349-7006.2009.01193.x. |
| [3] | Ettinger DS, Wood DE, Akerley W, et al. NCCN guidelines insights:non-small cell lung cancer, version 4.2016[J]. J Natl Compr Canc Netw, 2016, 14 (3): 255-264. |
| [4] |
许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J].
中国癌症杂志, 1996, 6 (4): 229-231. Xu LZ, Yang WT. Criterria for immunohistochemistry results[J]. China Oncol, 1996, 6 (4): 229-231. |
| [5] | Hu Y, Fang JY, Xiao SD. Can the incidence of gastric gastric cancer be further reduced in the new century?[J]. J Dig Dis, 2013, 14 (1): 11-15. DOI:10.1111/j.1751-2980.2012.00647.X. |
| [6] | Folkman J, MerlerE, Abernathy C, et al. Isolation of a tumor factor responsible for angiogenesis[J]. J Exp Med, 1971, 133 (2): 275-278. DOI:10.1084/jem.133.2.275. |
| [7] | Folkman J. Antiangiogenesis in cancer therapy-endostatin and its mechanisms of action[J]. Exp Cell Res, 2006, 312 (5): 594-607. DOI:10.1016/j.yexcr.2005.11.015. |
| [8] | Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease[J]. Nat Med, 1995, 1 (1): 27-31. DOI:10.1038/nm0195-27. |
| [9] | Fukumura D, Jain RK. Tumor microvasculature and microenvironment:targets for anti-angiogenesis and normalization[J]. Microvasc Res, 2007, 74 (2-3): 72-84. DOI:10.1016/j.mvr.2007.05.003. |
| [10] | Kerbel R. Antiangiogenic therapy:a universal chemosensitization strategy for cancer?[J]. Science, 2006, 312 (5777): 1171-1175. DOI:10.1126/science.1125950. |
| [11] | Jain RK. Normalizing tumor vasculature with anti-angiogenic therapy:a new paradigm for combination therapy[J]. Nat Med, 2001, 7 (9): 987-989. DOI:10.1038/nm0901-987. |
| [12] | Jain RK. Normalization of tumor vasculature:an emerging concept in antiangiogenic therapy[J]. Science, 2005, 307 (5706): 58-62. DOI:10.1126/science.1104819. |
| [13] | Folkman J, Kerbel R. Clinical translation of angiogenesis inhibitors[J]. Nat Rev Cancer, 2002, 2 (10): 727-739. DOI:10.1038/nrc905. |
| [14] |
王金万, 孙燕, 刘永煜, 等. 重组人血管内皮抑素联合NP方案治疗晚期NSCLC随机、双盲、对照、多中心Ⅲ期临床研究[J].
中国肺癌杂志, 2005, 7 (4): 283-290. Wang JW, Sun Y, Liu YY, et al. Results of randomized, multicenter, double-blind phase Ⅲ trial of rh-endostatin (YH-16) in treatment of advanced non-small cell lung cancer patients[J]. Chin J Lung Cancer, 2005, 7 (4): 283-290. |
| [15] |
曹德东, 戈伟, 王慧敏. 重组人血管内皮抑素联合化疗与单纯化疗在晚期非小细胞肺癌中疗效比较的系统评价[J].
中国肺癌杂志, 2011, 14 (5): 404-413. Cao DD, Ge W, Wang HM, et al. Efficacy and Safety of rh-endostatin combined with chemotherapy versus chemotherapy alone for advanced NSCLC:A Meta-analysis Review[J]. Chin J Lung Cancer, 2011, 14 (5): 404-413. DOI:10.3779/j.issn.1009-3419.2011.05.05. |
| [16] |
蔡萍, 姜亚莉, 顾平荣. 恩度治疗非小细胞肺癌30例临床疗效及安全性观察[J].
中国药业, 2015, 24 (8): 58-60. Cai P, Jiang YL, Gu PR. Clinical efficacy and safety of endostar in treating 30 cases of non-small cell lung cancer[J]. China Pharmaco, 2015, 24 (8): 58-60. |
| [17] |
黄纯, 李凯, 魏熙胤, 等. 晚期非小细胞肺癌循环血管内皮细胞水平的研究[J].
中华肿瘤杂志, 2006, 28 (10): 780-783. Huang C, Li K, Wei XY. Circulating endothelial cells in the peripheral blood of advanced NSCLC patients[J]. Chin J Oncol, 2006, 28 (10): 780-783. DOI:10.3760/j.issn:0253-3766.2006.10.018. |
| [18] |
庞凌坤, 蒋志庆, 田小林. 恩度联合奥沙利铂对裸鼠胃癌种植瘤的抑制作用研究[J].
川北医学院学报, 2016, 31 (5): 666-669. Pang LK, Jiang ZQ, Tian XL. Study on endostar combined with oxaliplatin in inhibiting transplanted gastric tumors in naked mice[J]. J North Sichuan Med Coll, 2016, 31 (5): 666-669. DOI:10.3969/j.issn.1005-3697.2016.05.012. |
| [19] | Zheng AW, Jia DD, Xia LM. Impact of carboplatin plus paclitaxel combined with endostar against A375 melanoma cells:an in vitro and in vivo analysis[J]. Biomed Pharmacother, 2016, 83 : 1321-1326. DOI:10.1016/j.biopha.2016.08.047. |
| [20] |
杨林, 王金万, 汤仲明, 等. 重组人血管内皮抑制素Ⅰ期临床研究[J].
中国新药杂志, 2004, 13 (6): 548-553. Yang L, Wang JW, Tang ZM, et al. A phase Ⅰ clinical trial for recombinant human endostatin[J]. Chin J New Drugs, 2004, 13 (6): 548-553. DOI:10.3969/j.issn.1673-5552.2006.08.036. |
| [21] |
王金万, 杨林. 血管内皮抑制素及其临床研究进展[J].
医学临床研究, 2003, 20 (10): 778-781. Wang JW, Yang L. Endostatin and advances in its clinical research[J]. J Clin Res, 2003, 20 (10): 778-781. DOI:10.3969/j.issn.1671-7171.2003.10.018. |
| [22] |
黄纯, 李凯, 魏熙胤, 等. 晚期非小细胞肺癌循环血管内皮细胞水平的研究[J].
中华肿瘤杂志, 2006, 28 (10): 780-783. Huang C, Li K, Wei XY, et al. Circulating endothelial cells in the peripheral blood of advanced NSCLC patients[J]. Chin J Oncol, 2006, 28 (10): 780-783. DOI:10.3760/j.issn:0253-3766.2006.10.018. |
| [23] |
吴海英, 魏鑫, 王海冀. 恩度联合放疗对胃癌移植瘤小鼠肿瘤微环境的影响[J].
齐鲁医学杂志, 2016, 31 (2): 138-141. Wu HY, Wei X, Wang HJ. Effects of endostar combined with radiotherapy on tumor microenvironment of gastric cancertransplantedmice[J]. Med J Qilu, 2016, 31 (2): 138-141. DOI:10.13362/j.qlyx.201602005. |
| [24] |
何渡, 戈伟, 李长虎, 等. 重组人血管内皮抑制素联合放射治疗对lewis肺癌小鼠的作用[J].
中国肺癌杂志, 2010, 13 (4): 386-390. He D, Ge W, Li CH, et al. Effects of Rh-endostar in combination with radiotherapy on rats with lung cancer[J]. Chin J Lung Cancer, 2010, 13 (4): 386-390. DOI:10.3779/j.issn.1009-3419.2010.04.22. |
| [25] | Sethakorn N, Dulin NO. RGS expression in cancer:oncomining the cancer microarray data[J]. J Recept Signal Transduct Res, 2013, 33 (3): 166-171. DOI:10.3109/10799893.2013.773450. |
| [26] | Hamzah J, Jugnld M, Kiessling F, et al. Vascular normalization in RGS5.deficienttumours promotes immune destruction[J]. Nature, 2008, 457 (7193): 410-414. DOI:10.1038/nature06868. |
| [27] | Jin Y, An X, Ye Z, et al. RGS5, a hypoxia-inducible apoptotic stimulator in endothelial cells[J]. J Biol Chem, 2009, 284 (35): 23436-234343. DOI:10.1074/jbc.M109.032664. |
| [28] | Kerbel RS. Therapeutic implications of intrinsic or induced angiogenic growth factor redundancy in tumors revealed[J]. Cancer Cell, 2005, 8 (4): 269-271. DOI:10.1016/j.ccr.2005.09.016. |
 2017, Vol. 37
2017, Vol. 37


