在许多生理和病理条件下,如细胞内缺血缺氧、糖基化受阻、钙代谢障碍等都会诱导未折叠蛋白 (unfolded protein response, UPR) 或错误折叠蛋白在内质网腔内蓄积、细胞内钙稳态失衡,引发未折叠蛋白反应的激活,导致内质网应激 (endoplasmic reticulum stress ERS)[1-3]。葡萄糖调节蛋白78(GRP78) 是细胞为了适应ERS产生的一类蛋白,与热休克蛋白有较高的同源性,其生成现已被认为是ERS应答启动的一个标志。既往研究显示内质网应激通路与人直肠癌[4]、甲状腺癌[5]等恶性肿瘤的放射敏感性密切相关,但具体机制尚未明确。本研究以人头颈部鳞癌细胞系 (KB、Fadu、Detroit 562) 为细胞模型,观察照射后ERS核心蛋白GRP78的活化并检测ERS通路特异性抑制剂Salubrinal对射线调控头颈鳞癌细胞增殖的影响, 旨在明确ERS通路参与调控人头颈部鳞癌细胞放射敏感性。
材料与方法1.材料:MEM、RPMI 1640培养基和胎牛血清购买于美国GIBCO公司。ERS抑制剂Salubrinal (sal)、DMSO、RIPA裂解液购自于美国Sigma公司。兔抗人β-肌动蛋白、GRP78多克隆抗体购自于美国Cell Signaling公司。吉姆萨染色液、BCA蛋白浓度测定试剂盒、Western blot实验相关试剂购买于中国碧云天生物科技公司。
2.细胞培养:3种头颈部鳞癌细胞 (KB细胞系、Fadu细胞系、Detroit 562细胞系) 购买于上海中国科学院细胞库。KB、Detroit 562(De) 细胞用含有10%胎牛血清的RPMI 1640培养基、Fadu用含有10%胎牛血清的MEM培养基在37℃、5% CO2饱和湿度的恒温培养箱中培养,2~3 d传代1次,选择对数生长期细胞进行实验。
3.Western blot实验检测人头颈部鳞癌细胞中GRP78的表达情况: 25 ml的培养瓶接种细胞,细胞生长至对数期时,应用德国西门子直线加速器X射线进行照射,源靶距为100 cm, 剂量率为300 cGy/min, 吸收剂量为4 Gy,于照射后不同时间点 (0、20 min、1 h、3 h、6 h、12 h、24 h和48 h) 收取细胞。按参考文献[6]的方法检测GRP78蛋白的表达情况。用RIPA裂解液提取细胞总蛋白,参照BCA蛋白检测试剂盒说明书检测蛋白浓度后,用8%SDS-聚丙烯酰胺凝胶电泳和电转移法转至PVDF膜上,用5%BSA封闭后,进行一抗GRP78 4℃过夜,辣根过氧化物酶标记的二抗室温孵育1 h, 洗涤后采用放射自显影技术进行蛋白条带的显影,获得各条带的吸光度 (A) 值。以相应蛋白条带的平均吸光度值与β-肌动蛋白吸光度值的比值表示各组蛋白表达水平,进行统计学分析。另将3种细胞系设立空白对照组和ERS通路抑制剂 (Salburinal) 组 (sal组),以预实验所得Salubrinal的浓度 (10 mmol/L) 于细胞生长至对数状态时处理3种细胞,以同样的方法检测GRP78蛋白的相对表达量。
4.克隆形成实验检测Salubrinal对细胞集落克隆形成的影响:接 种细胞于6孔细胞培养板,细胞贴壁后,以10 mmol/L Salubrinal浓度预处理细胞。将3种细胞分别设立单纯照射组、给药后12 h+照射组、给药后24 h+照射组和给药后36 h+照射组,分别给予0、2、4和6 Gy X射线照射细胞,10~14 d后终止培养,弃上清,用预冷磷酸盐缓冲液 (PBS) 洗涤2次,置4%多聚甲醛中固定细胞10 min。弃固定液,以吉姆萨染色液于室温染色10~30 min,以超纯水缓慢洗去染色液,置室温下干燥,拍照计数。计算细胞存活分数,采用单击多靶模型拟合细胞存活曲线,计算出D0值,进而求出放疗增敏比 (SER)。SER=(单纯照射组D0值与给药+照射组D0值之比)。细胞集落形成率 (PE)=集落数/细胞接种数×100%,细胞存活率 (SF)=某一剂量照射实验组的克隆数/(该组细胞种指数×PE)
5.统计学处理:所有实验均重复3次,结果以x±s表示。应用SPSS 13.0软件进行数据分析,组间比较正态性检验符合正态分布采用独立样本t检验,以P < 0.05为差异有统计学意义。
结果1.射线对人头颈部鳞癌细胞GRP78表达的影响:采用Western blot法检测ERS核心蛋白GRP78的表达发现,GRP78在3种头颈部鳞癌细胞系中均有表达。与0 min组相比,GRP78表达在照射后20 min~1 h开始增加,3 h达到高峰,随后表达逐渐减少,KB细胞表现尤为明显,见图 1。在照射后3 h时,KB细胞、Fadu细胞及De细胞中的GRP78表达水平分别为1.07±0.06、1.03±0.06和0.87±0.05,较各自0 min组的0.56±0.03、0.47±0.04和0.07±0.05均有明显升高,差异有统计学意义 (t=12.72、13、37、18.31,P < 0.05)。

|
图 1 蛋白印迹法检测射线照射后不同时间点3种细胞中GRP78的表达情况A. GRP78的蛋白条带;B. GRP78的相对表达量 注:a与0 min组比较,t=12.72、13、37、18.31,P<0.05 Figure 1 Expression of ERS core protein GRP78 at different time after radiation A. Protein images of Western blotting assay; B. Relative level of GRP78 expressions in three kinds of HNSCC. |
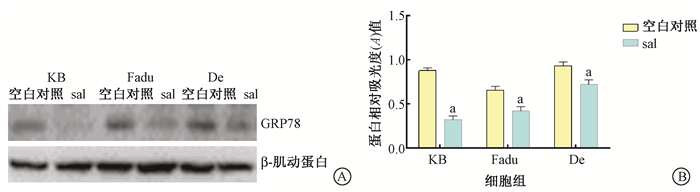
2. Salubrinal对人头颈部鳞癌细胞GRP78表达的影响:Western blot检测ERS特异性抑制剂Salubrinal对GRP78表达的影响发现,KB、Fuda和De 3种细胞sal组GRP78的表达较空白对照组明显减少,见图 2。sal组KB细胞、Fadu细胞及De细胞中GRP78表达水平分别为0.32±0.05、0.41±0.06及0.78±0.06,分别较空白对照组的0.87±0.04、0.65±0.04及0.92±0.04明显下降,两组比较差异有统计学意义 (t=14.25、5.34、3.12,P < 0.05)。
|
图 2 蛋白印迹法检测Salubrinal处理后ERS核心蛋白GRP78的表达情况A. GRP78的蛋白条带; B. GRP78的相对表达量 注:a与空白对照组比较,t=14.25、5.34、3.12,P<0.05 Figure 2 Expression of the core protein GRP78 of ERS after treatment of cells with Salubrinal A. Protein images of Western blotting assay; B. Relative level of GRP78 expressions. |
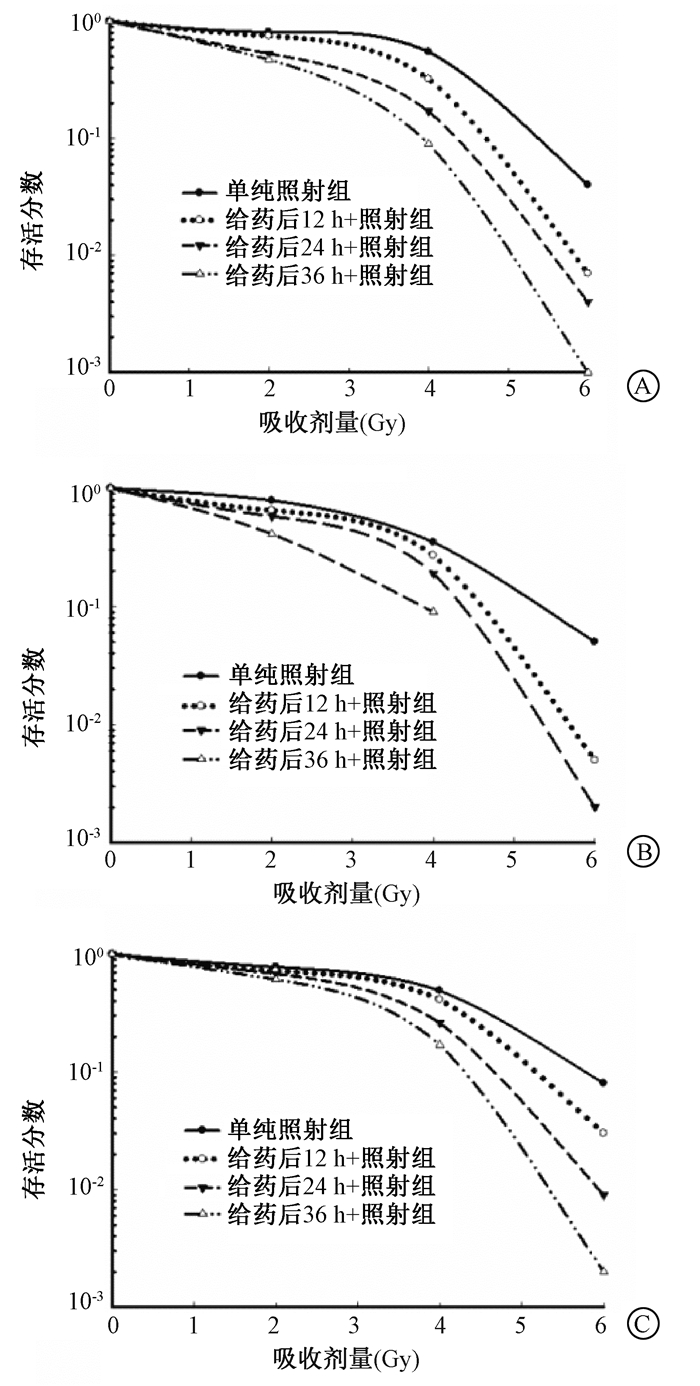
3. ERS抑制剂Salubrinal对人头颈部鳞癌细胞集落克隆形成的影响:集落克隆形成实验发现,Salburinal作用不同时间 (12、24和36 h) 后,给药+照射组头颈部鳞癌细胞细胞存活分数明显低于单纯照射组,见图 3。采用单击多靶模型拟合后,计算细胞平均致死量D0及放射增敏比 (SER),结果提示,Salubrinal作用12 h后照射,3种细胞的D0值由1.69、1.51和1.92降低为1.45、1.43和1.82,放射增敏比分别为1.16、1.05和1.06,随着作用时间延长,SER值增大 (表 1)。提示Salburinal对KB、Fadu及De 3种头颈部鳞癌细胞具有放射增敏效应,且增敏效应与Salburinal具有时间相关性。
|
图 3 不同剂量照射对10 mmol/L Salburinal处理后不同时间头颈部鳞癌3种细胞存活分数的影响A.KB细胞;B.Fadu细胞; C.De细胞 Figure 3 Survival curves of three kind of cells HNSCC irradiated with X-rays. The cells were treated with 10 mmol/LSalburinal at different time before irradiation A.KB; B.Fadu; C.De |
|
|
表 1 各处理组3种细胞单击多靶模型拟合的生物学参数及增敏比 Table 1 Stimulation parameters of the survival curves of three kind of cells and SER of drug treatment. The survival curve was fitted with the Multi-target-single hitting model |
讨论
内质网是真核细胞内重要的膜结合性细胞器,具有重要的生理功能[7]。在多种情况下,都会诱导未折叠蛋白或错误折叠蛋白在内质网腔内蓄积,引起内质网的应激[8](ERS)。研究表明,ERS不仅在正常细胞中存在,也参与肿瘤细胞的发生发展[9],并与肿瘤细胞的浸润、转移等不良预后相关[10-12]。GRP78作为ERS核心蛋白参与肿瘤细胞的微血管形成、转移过程[13-14]。本实验研究发现ERS同样存在于头颈部鳞癌细胞中。射线照射3种细胞系GRP78表达增高,提示射线诱导肿瘤细胞产生ERS并活化其核心蛋白GRP78。
Salubrinal是Boyce课题组通过药物筛选发现小分子去磷酸化的抑制剂,能够对抗ERS引起的不良反应[15],具有保护神经组织[16]和心肌组织[17]的作用。近年Salubrinal在肿瘤细胞综合治疗研究中得到了广泛关注。多项研究表明,Salubrinal联合中药或化学物质在膀胱癌[18]、胆囊癌[19]、卵巢癌[20]等多种肿瘤细胞中通过增加细胞凋亡、诱导细胞自噬以及线粒体功能障碍等多种机制,抑制肿瘤细胞的增殖,提高肿瘤细胞对药物的敏感性[19]。本研究中发现,Salubrinal作为ERS抑制剂联合射线照射肿瘤细胞抑制细胞增殖,降低细胞存活率。作用机制可能与Salubrinal抑制ERS对肿瘤细胞保护作用,降低肿瘤细胞放射抗拒从而提高肿瘤细胞的放射敏感性相关。另有研究发现,Salubrinal联合射线治疗提高软骨肉瘤的放射敏感性,且与Salubrinal浓度相关[21]。
本实验从ERS通路与放射治疗的相关性着手,探讨ERS抑制剂Salubrinal调控头颈部鳞癌放射敏感性,为提高头颈部鳞癌放射敏感性研究提供方向,并为ERS通路靶向药物的研究提供了实验基础。但ERS参与调控肿瘤辐射抗拒作用机制有待进一步研究。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证。与其他作者以及基金无任何利益冲突作者贡献声明 孙超南设计研究方案,收集数据后统计并起草论文;乔俏监督指导实验进行;李光指导审定并修改论文;韩楚阳协助细胞培养与预处理实验;韩凝协助蛋白印记检测实验;张妙协助细胞克隆形成实验及拍照处理
| [1] | Ron D, Walter P. Signal integration in the endoplasmic reticulum unfolded protein response[J]. Nat Rev Mol Cell Biol, 2007, 8 (7): 519-529. DOI:10.1038/nrm2199. |
| [2] | Rutkowski DT, Kaufman RJ. That which does not kill me makes me stronger:adapting to chronic ER stress[J]. Trends Biochem Sci, 2007, 32 (10): 469-476. DOI:10.1016/j.tibs.2007.09.003. |
| [3] | Tsai YC, Weissman AM. The unfolded protein response, degradation from endoplasmic reticulum and cancer[J]. Genes Cancer, 2010, 1 (7): 764-778. DOI:10.1177/1947601910383011. |
| [4] | Drake TM, Ritchie JE, Kanthou C, et al. Targeting the endoplasmic reticulum mediates radiation sensitivity in colorectal cancer[J]. Exp Mol Pathol, 2015, 98 (3): 532-539. DOI:10.1016/j.yexmp. |
| [5] | Wu XY, Fan RT, Yan XH, et al. Endoplasmic reticulum stress protects human thyroid carcinoma cell lines against ionizingradiation-induced apoptosis[J]. Mol Med Rep, 2015, 11 (3): 2341-2347. DOI:10.3892/mmr. |
| [6] |
乔俏, 赵欣宇, 李光. 电离辐射诱导NF-kB-HIF-lα通路在人淋巴瘤细胞中的活化[J].
中华放射医学与防护杂志, 2011, 31 (1): 25-28. Qiao Q, Zhao XY, Li G. Activation of NF-kB-HIF-1a pathway induced by X-ray irradiation in human lymphona cells[J]. Chin J Raiol Med Prot, 2011, 31 (1): 25-28. DOI:10.3760/cma.j.issn.0254-5098.2011.01.007. |
| [7] | Fu S, Watkins SM, Hotamisligil GS. The role of endoplasmic reticulum in hepatic lipid homeostasis and stress signaling[J]. Cell Metab, 2012, 15 (5): 623-634. DOI:10.1016/j.cmet.2012.03.007. |
| [8] | Hetz C. The unfolded protein response:controlling cell fate decisions under ER stress and beyond[J]. Nat Rev Mol Cell Biol, 2012, 13 (2): 89-102. DOI:10.1038/nrm3270. |
| [9] | Piton N, Wason J, Colasse É, et al. Endoplasmic reticulum stress, unfolded protein response and development of colon adenocarcinoma[J]. Virchows Arch, 2016, 469 (2): 145-54. DOI:10.1007/s00428-016-1961-6. |
| [10] | Kaira K, Toyoda M, Shimizu A, et al. Expression of ER stress markers (GRP78/BiP and PERK) in patients with tongue cancer[J]. Neoplasma, 2016, 63 (4): 588-94. DOI:10.4149/neo_2016_412. |
| [11] | Huang YY, Pu LJ, Song LL, et al. Knockdown of GRP78 enhances cell death by cisplatin and radiotherapy in nasopharyngeal cells[J]. Anticancer Drugs, 2016, 27 (8): 726-733. DOI:10.1097/CAD.0000000000000377. |
| [12] | Kim KW, Moretti L, MitchellL R, et al. Endoplasmic reticulum stress mediates radiation-induced autophagy by perk-eIF2alpha in caspase-3/7-deficient cells[J]. Oncogene, 2010, 29 (22): 3241-3251. DOI:10.1038/onc.2010.74. |
| [13] | Dong D, Stapleton C, Luo B, et al. A critical role for GRP78/BiP in the tumor microenvironment for neovascularization during tumor growth and metastasis[J]. Cancer Res, 2011, 71 (8): 2848-2857. DOI:10.1158/0008-5472. |
| [14] | Arap MA, Lahdenranta J, Mintz PJ, et al. Cell surface expression of the stress response chaperone GRP78 enables tumor targeting by circulating ligands[J]. Cancer cell, 2004, 6 (3): 275-284. DOI:10.1158/0008-5472.CAN-10-3151. |
| [15] | Dalal S, Foster CR, Das BC, et al. Beta-adrenergic receptor stimulation induces endoplasmic reticulum stress in adult cardiac myocytes:role in apoptosis[J]. Mol Cell Biochem, 2012, 346 (1-2): 59-70. DOI:10.1007/s11010-011-1205-7. |
| [16] | Qi X, Hosoi T, Okuma Y, et al. Sodium 4-phenylbutyrate protects againstcerebral ischemic injury[J]. Mol Pharmacol, 2004, 66 (4): 899-908. DOI:10.1124/mol.104.001339. |
| [17] | Hu GL, He KL, Fan L, et al. Salubrinal protects endoplasmic reticulum of cardiac muscle cells against stress-associated apoptosis[J]. J Chin PLA Postgrad Med Sch, 2010, 31 (5): 483-485. |
| [18] | Gafar AA, Draz HM, Goldberg AA, et al. Lithocholic acid induces endoplasmic reticulum stress, autophagy and mitochondrial dysfunction in human prostate cancer cells[J]. Peer J, 2016, 4 : e2445 DOI:10.7717/peerj.2445. |
| [19] | Nie J, Liu A, Tan Q, et al. AICAR activates ER stress-dependent apoptosis in gallbladder cancer cells[J]. Biochem Biophys Res Commun, 2017, 482 (2): 246-252. DOI:10.1016/j.bbrc.2016.11.050. |
| [20] | Bastolap P, Neums L, Schoenen FJ, et al. VCP inhibitors induce endoplasmic reticulum stress, cause cell cycle arrest, trigger caspase-mediated cell death and synergistically kill ovarian cancer cells in combination with Salubrinal[J]. Mol Oncol, 2016, 10 (10): 1559-1574. DOI:10.1016/j.molonc.2016.09.005. |
| [21] | Koizumi M, Tanjung NG, Chen A, et al. Administration of salubrinal enhances radiation-induced cell death of SW1353 chondrosarcoma cells[J]. Anticancer Res, 2012, 32 (9): 3667-3673. |
 2017, Vol. 37
2017, Vol. 37


