贫铀 (DU) 武器对人类健康的危害已引起国际社会的广泛关注[1]。肾脏是人体DU内污染的毒性靶器官,其中肾近曲小管上皮细胞对DU毒性最为敏感[2]。采用螯合剂将体内的DU排出体外是其首选的治疗方案,但蓄积于细胞内的DU难以排出是螯合剂治疗面临的重要难题,也是导致慢性细胞毒性甚至致癌的重要原因。因此,探究拮抗DU致肾近曲小管上皮细胞毒性的关键调控分子,对于研究DU内污染致远后效应的防治策略具有重要意义。
糖原合成激酶-3β(GSK-3β) 是参与机体多种重要生命活动的关键激酶,尤其是作为β-连环蛋白核转位的负性调控因子,在多种原因导致的急性肾损伤 (AKI) 及其修复中发挥重要作用[3-4]。本研究采用AKI早期诊断的分子标志物肾损伤分子-1(KIM-1)[5]和中性粒细胞明胶酶相关脂质运载蛋白 (NGAL)[6]作为DU染毒致人肾近曲小管上皮HK-2细胞早期损伤的指标,通过脂质体转染法降低GSK-3β活性以及使β-连环蛋白过表达,观察其对DU致细胞损伤的影响,并进一步观察GSK-3β抑制剂TDZD-8的作用,以期阐明DU致肾毒性的关键调控因子,为DU解毒剂的研发提供新的启示。
材料与方法1.质粒与主要试剂:人GSK-3β(KD) 质粒 (Plasmid #16 262)、pCMV-VSV-G空载体质粒 (Plasmid #8 454) 和β-连环蛋白 (Plasmid #16 828) 质粒、pcDNA3 Flag HA空载体质粒 (Plasmid #10 792) 购自美国Addgene公司。醋酸铀酰购自美国Chem-Impex公司;GSK-3β特异性抑制剂TDZD-8购自美国Selleck公司;DMEM/F12(1[DK]:1) 细胞培养基、BCA蛋白分析试剂盒和蛋白质分子质量标准购自美国Thermo Fisher (北京) 公司;胎牛血清和0.25%胰蛋白酶-EDTA、Lipofectamine转染试剂均购自美国Invitrogen公司;兔抗人p-GSK-3β(S9)、兔抗人GSK-3β和兔抗人β-连环蛋白单克隆抗体购自美国Cell Signaling公司;兔抗人KIM-1多克隆抗体购自美国LifeSpan BioSciences公司;兔抗人NGAL购自美国Abcam公司;兔抗人c-myc单克隆抗体购自美国Epitomics公司;Alexa fluor 488驴抗兔IgG购自美国Life Technologies公司;兔抗人β-微管蛋白单克隆抗体购自杭州华安公司;辣根过氧化物酶标记山羊抗兔和山羊抗小鼠IgG购自美国Immunology Consultants Laboratory公司;电化学发光 (ECL) 试剂盒购自美国Millipore公司;GSK-3β酶活性光度法定量检测试剂盒购自美国Genmed公司。
2.细胞培养及铀染毒:人肾近曲小管上皮HK-2细胞购自上海麦莎生物科技有限公司,用含10%FBS、100 U/ml青霉素和100 μg/ml链霉素的DMEM/F12(1[DK]:1) 完全培养基,在5% CO2、37℃饱和湿度条件下培养。采用0、300和600 μmol/L浓度的DU染毒HK-2细胞3~24 h,进行相应指标检测;采用600 μmol/L DU作用于分别瞬时转染GSK-3β(KD) 或β-连环蛋白质粒及其相应空载体质粒的HK-2细胞24 h,转染各种质粒的细胞均设置空白对照组与DU组;采用600 μmol/L DU单独或联合TDZD-8共同处理HK-2细胞9和24 h,均设置空白对照组、DU组和DU+TDZD-8组。
3.质粒脂质体转染和抑制剂处理:取对数生长期的4×105细胞接种于6孔培养板中,过夜贴壁融合率达70%~80%后,根据Lipofectamine 2000操作说明书进行质粒转染,GSK-3β(KD) 和β-连环蛋白质粒分别为1.2 μg,质粒浓度为4 μg/ml,Lipofectamine 2000浓度为10 μg/ml,转染4~6 h后更换培养液,于转染后48 h收集细胞进行酶活性或Western blot检测。10 μmol/L TDZD-8处理HK-2细胞9和24 h后,收集细胞进行相关指标检测。
4.免疫荧光染色检测KIM-1、NGAL表达和β-连环蛋白核转位:根据文献[7]方法,培养于腔室载玻片中的细胞经4%甲醛固定,0.5% Triton X-100穿孔处理,10%小牛血清/磷酸盐缓冲液 (PBS) 封闭后,分别加入KIM-1、NGAL和β-连环蛋白抗体4℃孵育过夜,次日加入Alexa fluor 488荧光二抗室温避光孵育1 h,加入含DAPI的封固剂封片。在荧光显微镜下观察并记录胞质或胞核含有绿色荧光的细胞数,每个样品计数400个细胞。将所得胞质绿色的细胞数除以总细胞数计算得到KIM-1、NGAL阳性细胞率;将所得胞核绿色的阳性细胞数除以总细胞数计算得到核β-连环蛋白阳性细胞率。
5. Western blot检测:根据文献[7]方法,用胰酶消化收集细胞后,加入100 μl细胞裂解液提取蛋白,采用BCA蛋白分析试剂盒检测蛋白浓度。取100 μg蛋白经沸水加热使蛋白变性后,采用7.5%的SDS-PAGE进行蛋白分离,然后转膜至PVDF膜上,经5%脱脂奶粉封闭后,加入p-GSK-3β(S9)、GSK-3β、c-myc和β-连环蛋白抗体,4℃孵育过夜;再加入相应的二抗室温孵育1 h后,进行ECL显色。采用美国Bio-Rad公司的Chemi Doc XRS数字成像系统对Western blot条带进行采集和分析。
6. GSK-3β酶活性检测:根据GSK-3β酶活性光度法定量检测试剂盒产品说明书的操作步骤,细胞经裂解提取蛋白及蛋白定量后,取5 μl (10~20 μg) 待测蛋白加入到95 μl预先在30℃静置3 min的混合反应液中,混匀后立即使用多功能酶标仪在340 nm波长下,检测即刻 (0 min) 与5 min吸光度 (A) 值。根据说明书中的活性计算公式,计算GSK-3β酶活性。
7.统计学处理:各组数据均服从正态分布,采用x±s表示。采用SPSS 19.0软件对KIM-1和NGAL阳性细胞率、β-连环蛋白入核阳性细胞率、p-GSK-3β/GSK-3β比值以及GSK-3β激酶活性进行分析,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
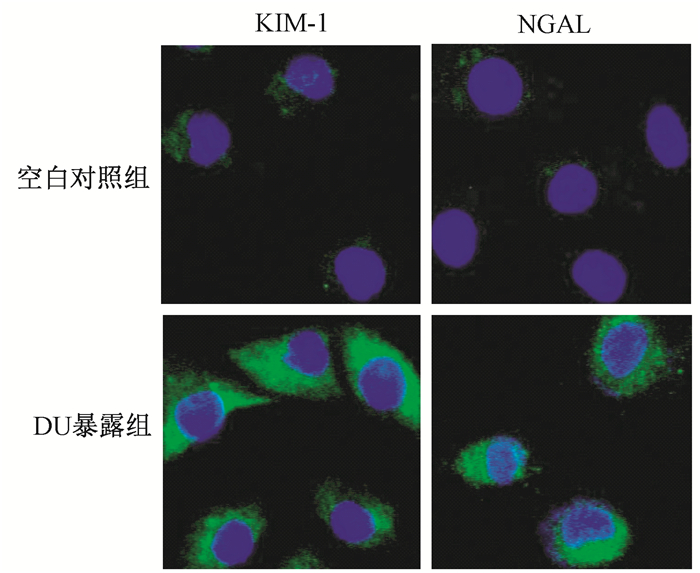
结果1. DU暴露对HK-2细胞的毒性作用:免疫荧光染色显示,DU暴露可诱导HK-2细胞KIM-1和NGAL蛋白表达增加 (图 1),且呈时间和浓度依赖性,表现为300和600 μmol/L DU染毒均可诱导KIM-1和NGAL阳性细胞率随染毒时间的延长而增加,于染毒6、9和24 h明显高于空白对照组 (KIM-1阳性细胞率:t=11.06、18.97、30.49,P < 0.05;t=6.79、16.02、85.45, P < 0.05;NGAL阳性细胞率:t=11.78、11.37、34.29,P < 0.05;t=7.34、21.63、36.84,P < 0.05);而且,600 μmol/L DU染毒组的KIM-1和NGAL阳性细胞率在相同染毒时间明显高于300 μmol/L DU染毒组 (t=4.11、9.83、26.09,P < 0.05;t=4.67、10.41、17.73,P < 0.05),见表 1。
|
图 1 贫铀 (DU) 诱导HK-2细胞KIM-1和NGAL蛋白表达荧光染色×1 000 Figure 1 Fluorescent images of KIM-1 and NGAL protein expressions in DU-exposed HK-2 cells ×1 000 |
|
|
表 1 不同浓度的贫铀诱导HK-2细胞KIM-1和NGAL阳性细胞率 (%, x±s) Table 1 The percentages of KIM-1 and NGAL positive cells in DU-exposed HK-2 cells (%, x±s) |
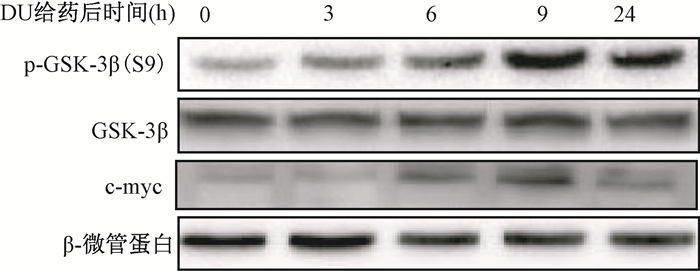
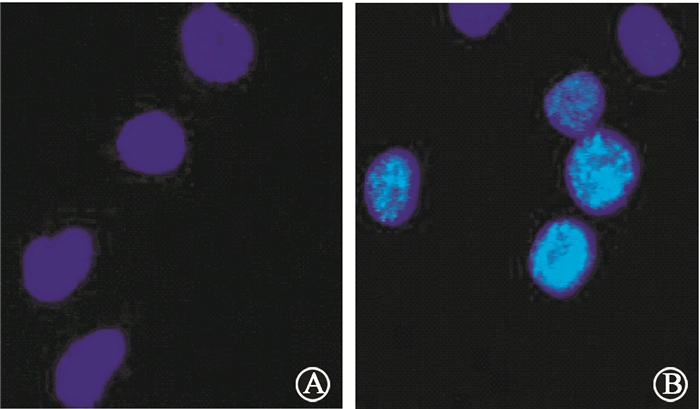
2. GSK-3β磷酸化及β-连环蛋白核定位在DU暴露HK-2细胞中的时相变化:DU染毒诱导HK-2细胞p-GSK-3β(S9)/GSK-3β蛋白表达比值于染毒后3、6、9和24 h明显高于空白对照组 (t=3.95、4.69、5.40、3.34,P < 0.05),于染毒后9 h达高峰 (图 2);而且DU染毒还诱导了β-连环蛋白核转位及下游靶基因c-myc蛋白表达的增加 (图 2、3),核β-连环蛋白阳性细胞率于染毒后3、6、9、24 h分别为0.16%±0.03%、0.28%±0.04%、0.53%±0.02%、0.29%±0.02%,亦明显高于空白对照组的0.11%±0.03%(t=4.61、6.52、36.64、14.93,P < 0.05),于染毒后9 h达高峰;表明随DU诱导细胞损伤的增加,GSK-3β失活和β-连环蛋白核转位增加,以促进细胞存活。
|
图 2 贫铀 (DU) 诱导HK-2细胞GSK-3β磷酸化和c-myc蛋白表达的时相变化 Figure 2 Temporal changes of protein expressions of p-GSK-3β and c-myc in DU-exposed HK-2 cells |
|
图 3 贫铀 (DU) 诱导β-连环蛋白核定位的代表性荧光图片×1 000 A.空白对照组;B. DU暴露组 Figure 3 Representative fluorescent images of nuclear localization of β-catenin in DU-exposed HK-2 cells ×1 000 A. control group; B. DU-exposed group |
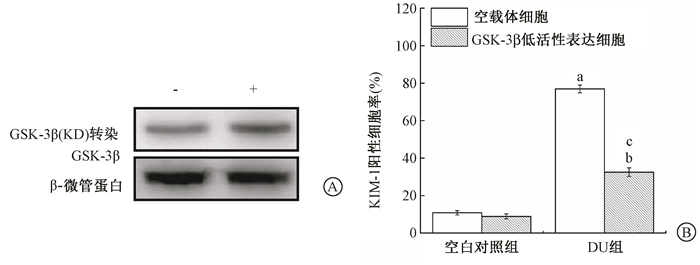
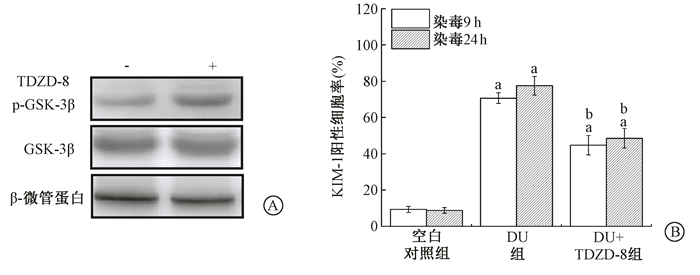
3.抑制GSK-3β活性对DU诱导HK-2细胞损伤的影响:采用GSK-3β(KD) 质粒瞬时转染HK-2细胞,Western blot检测显示,GSK-3β蛋白表达比空载体对照增高 (图 4A),分光光度法检测显示,无激酶活性的GSK-3β可使细胞中GSK-3β激酶活性比空载体对照显著降低 (57%±0.09%)(t=8.07,P < 0.05);GSK-3β活性抑制能显著降低24 h DU染毒诱导HK-2细胞的KIM-1阳性细胞率 (t=24.77,P < 0.05,图 4B)。而且,采用TDZD-8处理细胞9 h就可使p-GSK-3β(S9) 表达增加而抑制GSK-3β活性,且使TDZD-8处理组 (26%±2%) β-连环蛋白核转位比未处理组 (8.7%±0.67%) 明显增加 (t=16.78,P < 0.05),亦能明显降低DU染毒HK-2细胞的KIM-1阳性细胞率 (t=6.25、6.73,P < 0.05,图 5)。
|
图 4 转染无活性的GSK-3β(KD) 抑制HK-2细胞的GSK-3β活性 (A) 及降低贫铀 (DU) 诱导的细胞损伤 (B) 注:a与空白对照组空载体细胞比较,t=47.94,P < 0.05;b与空白对照组GSK-3β低活性表达细胞比较,t=15.30,P < 0.05;c与DU组空载体细胞比较,t=24.77,P < 0.05 Figure 4 Transfection with GSK-3β (KD) plasmid inhibited GSK-3β activity in HK-2 cells (A) and decreased DU-induced cell damage (B) |
|
图 5 TDZD-8处理抑制GSK-3β活性 (A) 及降低DU染毒后不同时间诱导的HK-2细胞损伤 (B) 注:与相同时间空白对照组比较,at=5.30、22.04、8.41、12.33,P < 0.05;与相同时间DU组比较,bt=6.25、6.73,P < 0.05 Figure 5 Treatment of cells with TDZD-8 inhibited GSK-3β activity in HK-2 cells (A) and decreased the DU-induced cell damage (B) |
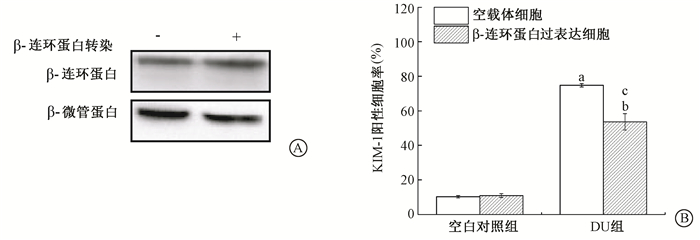
4. β-连环蛋白过表达对DU诱导HK-2细胞损伤的影响:采用β-连环蛋白质粒瞬时转染HK-2细胞,使β-连环蛋白表达显著高于空载体对照 (t=15.42,P < 0.05,图 6A);β-连环蛋白过表达能明显降低DU染毒HK-2细胞的KIM-1阳性细胞率 (t=7.49,P < 0.05),减轻DU诱导的HK-2细胞损伤。
|
图 6 β-连环蛋白过表达 (A) 降低DU诱导的HK-2细胞损伤 (B) Figure 6 Overexpression of β-catenin (A) decreased DU-induced cell damage (B) |
讨论
GSK-3β是调控细胞存活和增殖的一个负性调节蛋白,其活性主要通过第9位丝氨酸 (S9) 的磷酸化和去磷酸化来调节。该丝氨酸位点可被多种蛋白激酶磷酸化,如酪蛋白酶Ⅰ(CK-Ⅰ)、蛋白激酶B (AKT)、蛋白激酶C (PKC) 等,使其不能与底物结合而失去活性;而在去磷酸酶的作用下磷酸化的GSK-3β(S9) 通过去磷酸化可恢复其活性[8]。活性的GSK-3β与息肉病蛋白 (APC)、轴蛋白 (Axin) 及CK-Ⅰ等构成β-连环蛋白降解复合物,导致β-连环蛋白磷酸化及泛素化而沿蛋白酶体途径降解;当GSK-3β(S9) 被磷酸化,它则失去与APC、Axin等的结合能力,β-连环蛋白降解减少,导致β-连环蛋白在胞浆中聚集并转位至细胞核内发挥转录因子的作用,促进细胞增殖与分化,抑制细胞凋亡[9]。
近年来研究表明,DU致肾毒性的主要作用机制是DU蓄积于肾近曲小管上皮细胞中对其产生直接的基因毒性以及诱导线粒体氧自由基的生成[10-11],进一步的分子机制尚不清楚。本研究观察到,DU诱导HK-2细胞损伤与GSK-3β活性变化、β-连环蛋白核转位及其下游靶基因c-myc蛋白表达之间存在时相关系,表现为DU诱导人肾小管上皮细胞损伤的重要早期标志物KIM-1和NGAL阳性细胞率随染毒时间延长而明显增加,表明细胞损伤随染毒时间延长而加重,有研究亦观察到相近浓度的DU染毒能降低人肾小管上皮细胞的存活率[12];而GSK-3β活性降低和β-连环蛋白核转位增加则早于KIM-1和NGAL表达的显著增强,并于KIM-1和NGAL表达明显增加一段时间后达高峰,并伴有c-myc蛋白表达的增高,随后下降,提示GSK-3β/β-连环蛋白信号通路可能在DU诱导的HK-2细胞损伤中发挥重要作用。这种应激反应的生物学意义在于:在染毒后早期GSK-3β活性应激性降低使β-连环蛋白核转位应激性升高,激活下游靶基因如促细胞生长的c-myc蛋白表达增加,以拮抗DU的毒性,促进细胞存活;然而随着损伤的加重,细胞自身已无法抵抗DU毒性,致使GSK-3β活性逐步升高以及β-连环蛋白核转位水平逐步下降。
本研究进一步采用瞬时转染无激酶活性的GSK-3β(KD) 质粒导致细胞中组成性的GSK-3β失活,以及采用GSK-3β特异性抑制剂TDZD-8的方法,观察到降低GSK-3β活性能够拮抗DU诱导的HK-2细胞损伤,这一结果与其他研究报道的抑制GSK-3β活性能拮抗肾缺血再灌注诱导的AKI相一致[13]。而且,TDZD-8在抑制GSK-3β活性的同时使核β-连环蛋白阳性细胞率明显增加,提示抑制GSK-3β活性可能通过促进β-连环蛋白核转位拮抗DU (Ⅵ) 诱导的HK-2细胞损伤。本研究又采用瞬时转染β-连环蛋白质粒的方法,进一步观察到β-连环蛋白过表达能明显减轻DU诱导HK-2细胞损伤,这一结果与β-连环蛋白在拮抗肾缺血再灌注或镉暴露诱导的AKI的作用相一致[14-15]。
以上研究表明,GSK-3β和β-连环蛋白在DU诱导HK-2细胞损伤中发挥重要作用,抑制GSK-3β活性通过促进β-连环蛋白核转位和激活下游靶基因如c-myc表达减轻DU致人肾近曲小管上皮细胞损伤。希望今后进一步通过体内外实验证实GSK-3β抑制剂对DU慢性肾毒性的防治作用,为探寻新的DU解毒剂提供新思路。
利益冲突 无作者贡献声明 李强设计实验方案,进行试验,处理数据并起草论文;暴一众参与实验设计及资料分析;张旭霞、高赟、丁德芳提供实验技术指导;任湘祎参与免疫荧光检测;陈红红负责论文修改及总体研究思路指导
| [1] | Briner W. The toxicity of depleted uranium[J]. Int J Environ Res Public Health, 2010, 7 (1): 303-313. DOI:10.3390/ijerph7010303. |
| [2] | Squibb KS, Leggett RW, McDiarmid MA. Prediction of renal concentrations of depleted uranium and radiation dose in Gulf War veterans with embedded shrapnel[J]. Health Phys, 2005, 89 (3): 267-273. DOI:10.1097/01.hp.0000165451.80061.7e. |
| [3] | Howard C, Tao S, Yang HC, et al. Specific deletion of glycogen synthase kinase-3beta in the renal proximal tubule protects against acute nephrotoxic injury in mice[J]. Kidney Int, 2012, 82 (9): 1000-1009. DOI:10.1038/ki.2012.239. |
| [4] | Zhou D, Li Y, Lin L, et al. Tubule-specific ablation of endogenous beta-catenin aggravates acute kidney injury in mice[J]. Kidney Int, 2012, 82 (5): 537-547. DOI:10.1038/ki.2012.173. |
| [5] | van Timmeren MM, van den Heuvel MC, Bailly V, et al. Tubular kidney injury molecule-1(KIM-1) in human renal disease[J]. J Pathol, 2007, 212 (2): 209-217. DOI:10.1002/path.2175. |
| [6] | Mishra J, Ma Q, Prada A, et al. Identification of neutrophil gelatinase-associated lipocalin as a novel early urinary biomarker for ischemic renal injury[J]. J Am Soc Nephrol, 2003, 14 (10): 2534-2543. DOI:10.1097/01.ASN.0000088027.54400.C6. |
| [7] |
殷丽娜, 张旭霞, 王晶, 等. 氯硝柳胺对人三阴性乳腺癌MDA-MB-231细胞的放射增敏作用研究[J].
中华放射医学与防护杂志, 2014, 34 (4): 244-249. Yin LN, Zhang XX, Wang J, et al. Radiosensitization of human triple-negative breast cancer MDA-MB-231 cells by antihelminthic niclosamide[J]. Chin J Radiol Med Prot, 2014, 34 (4): 244-249. DOI:10.3760/cma.j.issn.0254-5098.2014.04.002. |
| [8] | Jope RS. Lithium and GSK-3:one inhibitor, two inhibitory actions, multiple outcomes[J]. Trends Pharmacol Sci, 2003, 24 (9): 441-443. DOI:10.1016/S0165-6147(03)00206-2. |
| [9] | MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling:components, mechanisms, and diseases[J]. Dev Cell, 2009, 17 (1): 9-26. DOI:10.1016/j.devcel.2009.06.016. |
| [10] | Prat O, Bérenguer F, Steinmetz G, et al. Alterations in gene expression in cultured human cells after acute exposure to uranium salt:Involvement of a mineralization regulator[J]. Toxicol In Vitro, 2010, 24 (1): 160-168. DOI:10.1016/j.tiv.2009.07.035. |
| [11] | Daraie B, Pourahmad J, Hamidi-Pour N, et al. Uranyl acetate induces oxidative stress and mitochondrial membrane potential collapse in the human dermal fibroblast primary cells[J]. Iran J Pharm Res, 2012, 11 (2): 495-501. |
| [12] |
李蓉, 艾国平, 徐辉, 等. 贫铀对人肾小管上皮细胞的毒性作用[J].
第三军医大学学报, 2004, 26 (3): 185-188. Li R, Ai GP, Xu H, et al. Acute toxic effects of depleted uranium and/or phenyl acetate and sodium selenite on human kidney epithelial cells[J]. Acta Acad Med Mil Tert, 2004, 26 (3): 185-188. DOI:10.3321/j.issn:1000-5404.2004.03.001. |
| [13] | Bao H, Ge Y, Wang Z, et al. Delayed administration of a single dose of lithium promotes recovery from AKI[J]. J Am Soc Nephrol, 2014, 25 (3): 488-500. DOI:10.1681/ASN.2013040350. |
| [14] | Kuncewitch M, Yang WL, Corbo L, et al. WNT agonist decreases tissue damage and improves renal function after ischemia-reperfusion[J]. Shock, 2015, 43 (3): 268-275. DOI:10.1097/SHK.0000000000000293. |
| [15] | Edwards JR, Kolman K, Lamar PC, et al. Effects of cadmium on the sub-cellular localization of β-catenin and β-catenin-regulated gene expression in NRK-52E cells[J]. Biometals, 2013, 26 (1): 33-42. DOI:10.1007/s10534-012-9592-0. |
 2017, Vol. 37
2017, Vol. 37


