2. 200040 上海, 复旦大学附属华东医院放疗科
2. Department of Radiotherapy, Huadong Hospital Affiliated to Fudan University, Shanghai 200040, China
立体定向消融放疗(SABR) 是一种有效的低分割、非侵入、根治性治疗方式,其肿瘤局部控制率高且正常组织耐受性好[1]。对于局限的原发性肝癌和肝内寡转移瘤患者,SABR可以获得较好的局部控制率且毒性小,是此类肝肿瘤的备选治疗方案[2]。容积旋转弧形调强放疗(VMAT) 技术的单弧治疗模式支持约两分钟完成整个放射治疗,治疗时机架快速旋转配合多叶准直器(MLC) 动态运动,同时剂量率可变,多参数共同协作可实现快速调强放疗[3]。因而,VMAT技术更加适合大分割的放射治疗,尤其是SABR[4]。肝部肿瘤移动受呼吸运动影响大导致位置误差较大,从而引起剂量偏差。使用自主屏气控制技术(vDEBH) 是肝癌SABR治疗中较常采用的一种呼吸动度控制技术。Wunderink等[5]发现,运用呼吸控制可以把与呼吸运动相关的肿瘤动度控制在5 mm范围内。本研究通过比较IMRT和VMAT两种技术的肝癌SABR放疗方案质量和计划执行效率,评估VMAT技术在肝癌治疗方面的可行性,分析呼吸控制下的位置误差,以进一步提高治疗的精确性。
资料与方法1.临床资料:回顾性分析2015年1月至2016年1月复旦大学华东医院15例经影像引导予以SABR治疗的肝癌患者,其中,原发性肝癌9例,胃肠道肿瘤等肝转移6例。患者中位年龄68.6岁(47~81岁),肝部肿块直径 < 5 cm,病灶≤2个,处方剂量50 Gy/5次(隔天治疗,2周内完成)。所有患者治疗后3个月行定期随访,观察有无发生放射性肝损伤(RILD) 及其它放疗相关不良反应。
2.CT扫描及图像获取:所有患者采用SARB专用体位固定方式,具体为腹部真空垫配合热塑形膜固定体位,所有患者进行呼吸控制训练。按照美国放疗肿瘤学研究组(RTOG)1112报告[6]方法,肝脏肿瘤患者应采用自主深呼气末屏气技术(vDEBH) 来限制脏器呼吸运动,配合呼吸门控技术(门控设备选用美国Varian公司RPM®) 对患者呼吸状态进行有效管理。在RPM中选择“前瞻模式”,呼吸门控给出呼吸信号,实时进行患者屏气(呼气末) 控制,屏气状态下进行CT扫描,层厚3 mm,CT模拟设备为德国Siemens公司的SOMATOM Definition AS®,重复扫描2次,得到2套CT图像以确定ITV。
3.靶区获取及方案优化:CT影像网络传输至三维治疗计划系统(TPS),由高年资放疗科医生确定靶区:可见肿瘤靶区(GTV),内靶区(ITV) 定义为两套影像中所勾画的GTVs叠加体积,计划靶区(PTV) 定义为ITV外放5 mm的体积;正常组织包括正常肝脏(定义为肝脏体积减去ITV的肝脏体积)、肾脏、脊髓和胃等。
15例患者接受VMAT放疗技术完成放射治疗,治疗机为Trilogy®(美国Varian公司)。在保持两种计划优化条件一致的前提下,对每位患者重新设计调强(IMRT) 优化方案,与VMAT方案进行比较,TPS采用Eclipse®V13.5计划系统(美国Varian公司)。VMAT计划采用2个部分弧来调整肿瘤和正常组织的位置,基于PTV的位置调整部分弧的范围并对正常组织进行有效的屏蔽。IMRT初始设置6~9个照射野,通过调整射束的方向来减少临界处正常组织的受照体积。
4.治疗位置验证:治疗时分别扫描两套CBCT影像进行在线位置纠正,第1套CBCT图像在摆位之后立即获取,用来观测在线摆位误差;第2套CBCT图像在照射野完成后获取,用来观测分次间移动误差。计划的最后执行均经过临床放疗医生对图像融合比对结果的认可。统计所有患者每次治疗的系统误差和随机误差,纠正靶区位置在三维坐标中的在线摆位误差,观测当次治疗内的移动误差。
5.剂量学参数评估:评估优化方案的剂量体积直方图(DVH) 及断层剂量分布情况。统计正常组织受量,包括正常肝组织、两侧肾脏、脊髓、小肠、胃和PTV。小肠,脊髓和胃等串行的正常组织通过最大剂量来评估,最大剂量定义为包含1 mm3正常器官体积的最大剂量值;并行组织包括肝和肾,评估平均剂量和最大剂量。此外,统计正常肝脏接受15及21 Gy的体积,用来评估放射性肝损伤。根据国际辐射单位与测量委员会(ICRU)83号报告[7],PTV的最大剂量定义为1 mm3的PTV体积所受的最大剂量,最小剂量定义为98%的PTV体积受到的照射剂量。PTV最大剂量必须 < 150%处方剂量,且100% PTV体积必须被90%处方等剂量线所包绕。
6.治疗方案质量保证(QA):对优化方案进行剂量验证,包括点剂量与面剂量。点剂量采用电离室配合固体水模(红砖体模,美国MEDTEC公司) 实测绝对剂量,点剂量误差阈值设定为±5%。面剂量验证采用OCTAVIUS 4D©验证设备(美国PTW公司),包含729个正立方通气电离室组成的二维矩阵阵列。面剂量用γ分析评估,γ分析采用3% 3 mm的剂量满足度(DTA),设5%的阈值,至少90%通过[8]。
7.统计学处理:数据以x±s表示。采用SPSS 20.0软件进行分析。方差齐性检验后,用单因素ANOVA方法评价剂量学参数结果,从而确定因素对试验结果有无显著性影响;正态性检验符合正态分布,采用配对t检验方法评估两种治疗计划在治疗跳数(MU)、治疗时间及CBCT监控位置误差的差异。P<0.05为差异有统计学意义。
结果1.剂量学参数比较
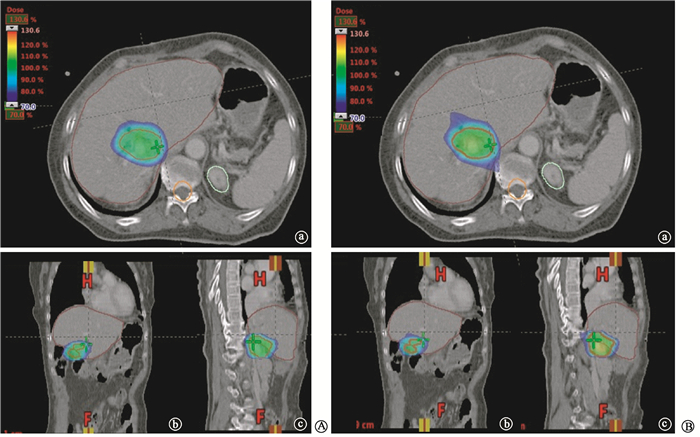
(1) 靶区覆盖范围:IMRT与VMAT优化方案剂量分布如图 1所示。15例患者GTV体积为(44.2±31.22) cm3,PTV体积为(137.7±58.4) cm3。PTV最大、最小和平均剂量差异均无统计学意义(P>0.05)。IMRT与VMAT优化方案剂量分布如图 2所示。无论使用IMRT还是VMAT计划,PTV体积接受至少90%处方剂量线包绕,最大剂量均 < 135%处方剂量。
|
图 1 患者的容积弧形调强放疗计划(A) 与调强放疗计划(B) 的优化方案剂量分布比较a.横断面;b.矢状面;c.冠状面 Figure 1 Comparison of dose distribution of the patient in VMAT plan (A) and IMRT plan (B) a.Transversal-CT; b. Sagittal-CT; c.Frontal-CT |
|
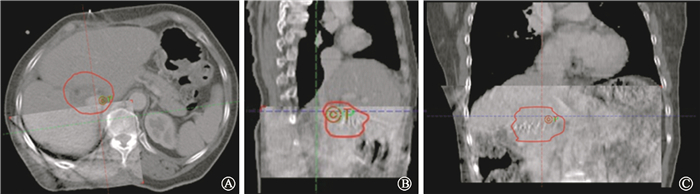
图 2 自主屏气后CBCT与计划CT位置配准A.横断面;B.冠状面;C.矢状面 Figure 2 Registration between CBCT and planning CT under vDEBH A. Transversal-CT; B. Frontal-CT; C. Sagittal-CT |
(2) 正常器官剂量:15例患者VMAT与IMRT优化方案正常组织剂量学参数比较结果列于表 1,IMRT计划与VMAT计划相比,表中所统计的剂量学参数结果差异均无统计学意义(P>0.05)。表明在计划质量方面,VMAT技术可以用于肝癌患者的SABR治疗,和传统的IMRT相比,有相当的剂量分布特点。
|
|
表 1 VMAT与IMRT优化方案靶区及正常组织剂量学参数比较(x±s) Table 1 Dosimetric parameter comparison of PTV and normal tissues between VMAT and IMRT (x±s) |
2.CBCT图像引导下的位置验证:在线摆位系统误差在垂直、头脚、左右方向上分别为(0.35±0.26)、(0.64±0.60) 和(0.22±0.19) cm,随机误差分别为0.31、0.48和0.15 cm。由于患者采用vDEBH来限制脏器呼吸运动和VMAT快速治疗技术,得到其治疗内的系统误差在垂直、患者头脚和横向上分别是(0.10±0.13)、(0.07±0.14) 和(0.07±0.09) cm,随机误差分别是0.11、0.12和0.10 cm。与IMRT技术相比,VMAT技术在分次治疗过程中的移位误差大约减少了20%(t=3.378,P<0.05),最大可能归结于快速治疗所带来的分次内治疗时间大幅减少。
3.MU和传输时间:VMAT和IMRT计划的MU分别为2 537.0±382.9和3 527.6±935.7,相应治疗时间(4.33±0.40) 和(6.33±1.80) min。与IMRT计划相比,VMAT技术的MU缩短了28.1%(t=3.064,P<0.05);计划执行治疗时间减少了31.6%(t=2.278,P<0.05),表明VMAT技术用于肝癌患者的SABR治疗,和传统的IMRT相比,治疗效率更高。
4.剂量验证:面剂量采用γ分析,VMAT和IMRT计划中平均最小的通过率为97.2%和92.3%,平均绝对剂量点差异分别为1.4%和0.7%。验证结果均符合放射治疗计划实施临床QA要求。
讨论通过评估肝部肿瘤SABR技术在IMRT/VMAT优化方案的剂量学结果显示,无论使用IMRT还是VMAT计划,PTV体积接受至少90%处方剂量线包绕,最大剂量均 < 135%处方剂量。与IMRT相比,VMAT技术可以实现与之相当的靶区剂量和临床可接受的正常组织受量。据证实肝脏对放射线非常敏感,而肝硬化或受慢性病毒感染的肝脏其敏感度更是难以预测,因而在肝脏肿瘤的放射治疗中,减少正常肝脏组织受照的平均剂量至关重要,研究表明RILD与正常肝脏组织受到的平均剂量有关[9-10]。最大体积700 ml接受到的总剂量 < 15 Gy且最大体积400 ml接受到的总剂量 < 21 Gy是正常肝组织的放射受量限值[11]。研究中,VMAT和IMRT计划正常肝脏组织受到以上相关参数的剂量均小于限值,且平均剂量分别为11.72和11.26 Gy,并且在放疗后随访中,所有的患者没有出现RILD。
肾脏在放射生物模型中既有串行组织特性也具并行组织特点。在IMRT计划中由DVH得到的对侧肾脏的低剂量体积较VMAT计划小,平均剂量两者都达到临床可接受的范围。尽管在胃的最大剂量没有明显的差异,IMRT技术在DVH数值分布及断层剂量分布上略好。
本研究表明,对于肝癌SABR而言,VMAT技术比传统IMRT技术具有效率方面的更大优势,包括机器治疗时间减少和MU的随之降低。鉴于所有基于VMAT和IMRT技术的SABR计划在治疗过程中都需要严格的患者定位、图像引导和靶区位置验证,这些步骤耗时长,增加了治疗相关的不确定性,因此尽量缩短患者所在治疗床的时间(包括出束时间),有助于降低体位移动所带来的不确定性。VMAT技术可以减少有效出束时间,缩短总的治疗时间,潜在提高患者的舒适度和依从性。更重要的是,较短的出束时间使患者保持屏气状态更加可行,有利于呼吸控制技术的实现,尤其是受呼吸运动影响较大的肝部肿瘤。VMAT技术总MU大幅减少,有利于减少总体散射剂量,降低次级不良反应的发生率,比如潜在血液不良反应等。此外,VMAT较高的执行效率,也有助于降低治疗过程中患者自身的移动和内部器官的位置移动,即减少照射分次内的位移误差。
患者体位固定的舒适性对控制分次移位运动误差是有益的,固定时患者的高舒适性增加固定的重复性,有助于减少分次间的摆位误差,因此,本研究采用的SABR固定装置固定患者,同时治疗过程中基于CBCT的图像引导对于位置验证和评估分次治疗内的位置偏移也非常重要。很多因素导致分次位置移动误差,对于肝部肿块患者呼吸运动引起的误差不容忽视,呼吸运动引起治疗位置的误差直接导致放疗优化方案剂量的偏离[12-13],影响放疗过程中实际的剂量分布。研究表明,由呼吸运动引起的剂量变化在腹部肿瘤中通常是明显的[14-16]。呼吸运动管理策略包括自主屏气控制、实时的肿瘤跟踪技术及呼吸门控技术[17-19]。根据RTOG 1112[6]推荐,肝脏肿瘤患者应采用vDEBH,配合RPM Varian呼吸门控设备帮助观察控制屏气状态。所以,本研究通过图像引导结合vDEBH来限制脏器呼吸运动,纠正摆位误差后,可以将分次内在垂直、患者头脚和左右方向上的位置误差控制在0.10 cm左右。
综上所述,本研究表明,VMAT技术可以用于肝癌患者的SABR治疗,和传统的IMRT相比有相当的剂量分布特点,但VMAT技术的治疗效率更高,使其更易与呼吸运动控制技术相结合,以提高治疗的精准性,同时更好地保护正常组织,获得更佳的总体治疗效果。当然,本研究所纳入的患者数有限,随访时间较短,长期的治疗效果(生存率) 和不良反应(乙型肝炎肝硬化的发生) 仍有待进一步评估。此外,本研究属于回顾性分析,结果仍需在前瞻性的临床研究中加以验证。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 邱健健负责设计研究方案、收集数据后统计,并起草论文;吕博及黄莹负责进行试验,对数据结果进行分析;卓维海及郑向鹏指导、监督试验进行,修改论文
| [1] |
郑向鹏, 许亚萍, 邢向刚, 等.
肿瘤放射治疗最新进展-调强放疗、影像引导放疗与体部立体定向放疗[M]. 北京: 人民军医出版社, 2003: 322-330.
Zheng XP, Xu YP, Xing XG, et al. IMRT, IGRT, SBRT advances in the treatment planning and delivery of radiotherapy[M]. Beijing: People's Military Medical Press, 2003: 322-330. |
| [2] | Bujold A, Massey CA, Kim JJ, et al. Sequential phase I and Ⅱ trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma[J]. J Clin Oncol, 2013, 31 (13): 1631-1639. DOI:10.1200/JCO.2012.44.1659. |
| [3] | Otto K. Volumetric modulated arc therapy:IMRT in a single gantry arc[J]. Med Phys, 2008, 35 (1): 310-317. DOI:10.1118/1.2818738. |
| [4] | Holt A, Vliet-Vroegindeweij CV, Mans A, et al. Volumetric-modulated arc therapy for stereotactic body radiotherapy of lung tumors:a comparison with intensity-modulated radiotherapy techniques[J]. Int J Radiat Oncol Biol Phys, 2011, 81 (5): 1560-1567. DOI:10.1016/j.ijrobp.2010.09.014. |
| [5] | Wunderink W, Méndez RA, Vásquez Osorio EM, et al. Target coverage in image-guided stereotactic body radiotherapy of liver tumors[J]. Int J Radiat Oncol Biol Phys, 2007, 68 (1): 282-290. DOI:10.1016/j.ijrobp.2006.12.034. |
| [6] | Radiation Therapy Oncology Group. RTOG 1112:Randomized phase Ⅲ study of sorafenib versus stereotactic body radiotherapy followed by sorafenib in hepatocellular carcinoma[R]. Philadelphia:RTOG, 2012. |
| [7] | International Commission on Radiation Units and Measurements. Prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy (IMRT):Contents[J]. J ICRU, 2010, 10 (1): 1-106. DOI:10.1093/jicru/ndq002. |
| [8] | Nelms BE, Simon JA. A survey on planar IMRT QA analysis[J]. J Appl Clin Med Phys, 2007, 8 (3): 2448 |
| [9] | Lawrence TS, Ten HRK, Kessler ML, et al. The use of 3-D dose volume analysis to predict radiation hepatitis[J]. Int J Radiat Oncol Biol Phys, 1992, 23 (4): 781-788. DOI:10.1016/0360-3016(91)90564-K. |
| [10] | Dawson LA, Ten HRK, Lawrence TS. Partial irradiation of the liver[J]. Semin Radiat Oncol, 2001, 11 (3): 240-246. DOI:10.1053/srao.2001.23485. |
| [11] | Penna C, Nordlinger B. Colorectal metastasis (liver and lung)[J]. Surg Clin North Am, 2002, 82 (5): 1075-1090. DOI:10.1016/S0039-6109(02)00051-8. |
| [12] | Murphy MJ, Lin PS, Ozhasoglu C. Intra-fraction dose delivery timing during stereotactic radiotherapy can influence the radio-biological effect[J]. Med Phys, 2007, 34 (2): 481-484. DOI:10.1118/1.2409750. |
| [13] | Lujan AE, Balter JM, Ten HRK. A method for incorporating organ motion due to breathing into 3D dose calculations in the liver:sensitivity to variations in motion[J]. Med Phys, 2003, 30 (10): 2643-2649. DOI:10.1118/1.1609057. |
| [14] | Liu Q, McDermott P, Burmeister J. Effect of respiratory motion on the delivery of breast radiotherapy using SMLC intensity mod ulation[J]. Med Phys, 2007, 34 (1): 347-351. DOI:10.1118/1.2405323. |
| [15] | Zhang J, Wu QJ, Godfrey DJ, et al. Comparing digital tomosynthesis to cone-beam CT for position verification in patients undergoing partial breast irradiation[J]. Int J Radiat Oncol Biol Phys, 2009, 73 (3): 952-957. DOI:10.1016/j.ijrobp.2008.10.036. |
| [16] | Bortfeld T, Jiang SB, Rietzel E. Effects of motion on the total dose distribution[J]. Semin Radiat Oncol, 2004, 14 (1): 41-51. DOI:10.1053/j.semradonc.2003.10.011. |
| [17] | Ten HRK, Balter JM, Marsh LH, et al. Potential benefits of eliminating planning target volume expansions for patient breathing in the treatment of liver tumors[J]. Int J Radiat Oncol Biol Phys, 1997, 38 (3): 613-617. DOI:10.1016/S0360-3016(97)00009-6. |
| [18] | Shirato H, Shimizu S, Kitamura K, et al. Four-dimensional treatment planning and fluoroscopic real-time tumor tracking radio-therapy for moving tumor[J]. Int J Radiat Oncol Biol Phys, 2000, 48 (2): 435-442. DOI:10.1016/S0360-3016(00)00625-8. |
| [19] | Kim DJ, Murray BR, Halperin R, et al. Held-breath self-gating technique for radiotherapy of non-small-cell lung cancer:a feasibility study[J]. Int J Radiat Oncol Biol Phys, 2001, 49 (1): 43-49. DOI:10.1016/S0360-3016(00)01372-9. |
 2017, Vol. 37
2017, Vol. 37


