2. 537000 玉林, 广西玉林市第一人民医院 广西医科大学第六附属医院核医学科;
3. 537000 玉林, 广西玉林市第一人民医院 广西医科大学第六附属医院放射科;
4. 530021 南宁, 广西医科大学第一附属医院放疗科
2. Department of Nuclear Medicine, Yulin First People's Hospital, Sixth Affiliated Hospital of Guangxi Medical University, Yulin 537000, China;
3. Department of Radiology, Yulin First People's Hospital, Sixth Affiliated Hospital of Guangxi Medical University, Yulin 537000, China;
4. Department of Radiation Oncology, First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
鼻咽癌(nasopharyngeal carcinoma,NPC) 恶性程度高,生物学行为上有局部广泛蔓延破坏表现,容易累及毗邻的颅底骨质(skull base bone involvement,SBBI),影响到临床分期、放化疗方案制定和预后判断。治疗前判断颅底骨质是否受累及尤为重要,目前主要依赖于影像学,MRI优势已经证实,是目前鼻咽癌治疗前的标准检查手段[1]。SPECT骨显像在肿瘤骨侵犯的诊断上具有敏感性高、早期检出、能进行全身骨显像等优势,已广泛用于鼻咽癌全身骨转移的早期诊断,但对颅底骨侵犯的检测研究较少。鉴于SPECT/CT检测的高敏感性及难以确定的特异性,前瞻性对鼻咽癌初治患者进行SPECT及同机定位CT结合断层骨显像与MRI检测对比研究,通过分析两者对颅底骨侵犯的检测能力,探讨SPECT/CT断层骨显像对鼻咽癌颅底骨侵犯的诊断价值。
资料与方法1.一般临床资料:2014年1月至2015年12月入住玉林市第一人民医院、影像资料完整、经病理证实的鼻咽癌(高位颈椎转移者除外) 初治患者165例。男120例,女45例,年龄24~81岁,中位年龄48岁。有头痛合并或无颅神经麻痹者85例,病理类型均为非角化性癌(其中未分化型151例,分化型14例),以MRI结果为标准,SBBI组92例,无SBBI组73例,根据肿瘤生长累及途径及骨质特点,进一步将颅底骨质分区,后上部斜坡、岩尖区阳性组91例,阴性组74例;上部蝶骨体、蝶窦底区阳性组9例,阴性组156例;前上部的翼突、翼板区阳性组1例,阴性组164例。本研究通过医院伦理委员会论证,所有患者均签署了知情同意书。
2.检查方法:于放疗前2周内行SPECT/CT断层骨显像及MRI检查。采用美国GE公司Infinia+Hawkeye 4型双探头可变角SPECT仪,配低能高分辩平行孔准直器,同机CT为4排螺旋CT。患者准备按骨显像常规,静脉注射740~1 110 MBq 99Tcm-亚甲基二膦酸盐(MDP,北京原子高科股份同位素有限公司)3~6 h后行全身骨显像(WBI),进床速度12 cm/min。头颅SPECT结合定位CT采集:完成全身骨骼平面显像后,进行SPECT/CT颅底断层显像,矩阵256×256,放大倍数1.28,采集360°,双探头各旋转180°,步进6°,30 s/帧。将SPECT和CT图像进行同机融合,重建三维图像,Volumetrix MI同机融合软件进行分析处理。鼻咽MRI平扫及增强按照鼻咽癌规范检查常规方法。
|
|
表 1 165例鼻咽癌患者的临床特征 Table 1 Clinical characteristics of 165 nasopharyngeal carcinoma patients |
3.判断及标准:分别由经验丰富的核医学和放射科专家小组(每组2位) 在双盲情况下阅片,疑难分歧病例则共同研判,对检测病例的颅底骨情况作出判断。半定量分析:在SPECT/CT图像矢状面,颅底放射性浓聚最高部位层面放射计数值(L) 与高位颈椎体(C1~C3) 处勾画大小相同的感兴趣区(ROI) 放射计数值(S),计算其放射性摄取计数值L/S比值。分为3个等级:0级,L/S小于1;1级,L/S=1;2级,L/S>1。0级与1级:考虑颅底骨未受侵犯和轻微的骨膜反应:2级(L/S>1) 考虑颅底侵犯。判断标准参考Jadvar等[2]方法,根据治疗前MRI影像结果结合临床症状明确定性诊断,MRI阳性为颅底骨皮质TWI上低信号的线样结构中断或骨松质骨髓脂肪均匀高信号消失,代之以肿瘤组织不均匀的斑点状低信号,信号强度与肿瘤组织相似,压脂增强后见明显强化。对所有病例随访3~12个月。
4.统计学处理:应用SPSS 17.0软件及MedCalc软件进行分析。对计数资料行χ2检验。P < 0.05为差异有统计学意义。
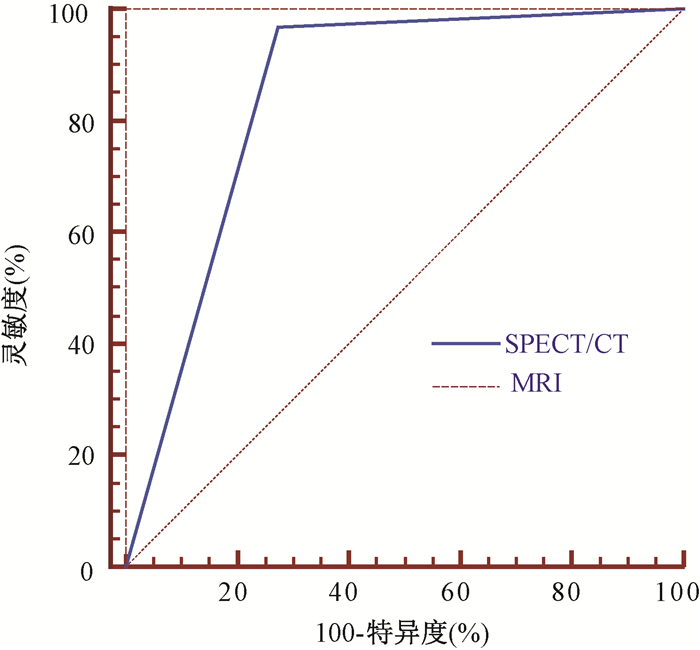
结果1.全部病例SBBI的结果:SPECT/CT和MRI二者对颅底骨侵犯的检测结果列于表 2。MRI的阳性检出率为55.8%(92/165), SPECT/CT为66.1l%(109/165);二者检测符合率为86.06%(142/165),不符合率为13.94%(23/165)。SPECT/CT检测颅底SBBI的灵敏度、特异性、准确度、阳性预测值、阴性预测值和к值分别为96.74%(89/92)、72.60%(53/73)、86.06%(142/165)、81.65%(89/109)、94.64%(53/56) 和0.711。SPECT/CT检测颅底骨破坏ROC曲线示于图 1,ROC曲线下面积0.847,差异有统计学意义(Z=12.436,P < 0.01)。
|
|
表 2 SPECT/CT颅底骨侵犯诊断评价情况 Table 2 Data of skull base invasion detected by SPECT/CT and MRI |
|
图 1 SPECT/CT检测颅底骨破坏的ROC曲线 Figure 1 ROC curve of SPECT/CT in detecting skull base bone destruction |
2.颅底骨不同区域部位检测情况:SPECT/CT和MRI检测颅底骨各区域的结果情况列于表 3。SPECT/CT发现3个区域同时受累有2例,2个区域受累有20例;MRI检测2个区域同时受累有9例。在斜坡、岩尖区,SPECT/CT、MRI检测SBBI符合率为93.33%(154/165),两者检测不符合率为6.67%(11/165);在蝶骨体、蝶窦底区,两者检测符合率为87.27%(144/165),两者检测不符合率为12.73%(21/165);在翼突、翼板区,两者检测符合率为96.36%(159/165),不符合率为3.64%(6/165)。SPECT/CT检测颅底各区域SBBI的灵敏度、特异性、准确度、阳性预测值、阴性预测值和к值列于表 4。
|
|
表 3 颅底骨各区域诊断评价情况 Table 3 Data of the regions of the skull base invasion detected by SPECT/CT and MRI |
|
|
表 4 SPECT/CT检测颅底骨各区域的灵敏度、特异度、准确度、阳性预测值、阴性预测值、κ值 Table 4 Sensitivity, specificity, accuracy, positive predictive value, negative predictive value and κ for each region of skull base detected by SPECT/CT |
3.临床影响因素分析:165例NPC患者是否有头痛症状以及不同病理类型检出结果与SPECT/CT检出结果关系列于表 5。分析发现,头痛症状是SPECT结果阳性的相关因素(χ2=51.662,P < 0.05),而不同病理类型患者SBBI检测阳性率无差异(P>0.05)。
|
|
表 5 SPECT/CT检出结果与头痛症状以及病理类型的关系 Table 5 The findings between headache symptoms, pathological type and SPECT / CT imaging |
讨论
99Tcm-MDP骨显像是探测骨转移最常用的方法,能够1次完成全身骨骼显像,具有费用低、灵敏度高优点[3]。在SBBI诊断效能方面,同机CT融合显像较单独SPECT为优,而WBI较单独SPECT的灵敏度、特异性和准确性低,表明断层显像较平面显像为优[4]。本研究病例是在完成全身骨骼平面显像后再进行SPECT/CT颅底断层显像,主要出于实用性和经济性考虑,全身骨骼平面显像主要目的是判断有无全身骨转移和初步判断颅底骨质情况,而断层显像针对SBBI检测,它能够克服了平面显像时正常与病变组织放射性重叠而影响对病变观察的缺点。目前,大多数现有SPECT结合定位CT用于NPC SBBI价值的研究仅以CT为对照。考虑到MRI比CT更具有优势,本研究以MRI为对照,研究用SPECT结合定位CT断层显像评价NPC SBBI临床检测价值。
为尽可能减少干扰因素,入组标准均为初治,且无高位颈椎转移。研究表明,SPECT结合定位CT检测SBBI的主要诊断性指标灵敏度、特异性均较优,经ROC曲线下面积检验,差异有统计学意义,说明头颅SPECT结合定位CT骨显像对SBBI真实、可靠,有很好的诊断价值,研究结果和姚红霞等[4]报道相似。鼻咽癌有其独特的颅底骨侵犯方式,按部位分析发现,在斜坡、岩尖附近一带区域,SPECT/CT检测SBBI结果最理想,真实可靠,两种影像方法结果高度一致性, 斜坡、岩尖区域炎症、损伤、良性肿瘤机会少见,故敏感度、特异性均佳,临床价值高。在蝶骨体、蝶窦底区域,9例MRI阳性患者,均发现蝶窦腔明确有肿瘤占据,分期偏晚;在翼突、翼板一带区域,只有1例MRI结果阳性,该病例肿瘤范围大,明显累及翼腭窝、翼突内、外板;SPECT/CT阳性而MRI阴性有35例,其中27例分布在蝶骨体、蝶窦底区域和翼突内、外板区域,在这两个区域无SPECT/CT阴性而MRI阳性病例,说明SPECT/CT在蝶窦底壁、翼突等细小骨质发现病灶能力高于MRI,与乐亚丽等[5]报道18F-NaF PET/CT检测能力相似。Iagaru等[6]通过比较99Tcm-MDP骨显像、18F-NaF PET/CT, 对52例癌症患者骨转移瘤检测效能,其中99Tcm-MDP检测出22例,18F-NaF PET/CT检测出24例,认为在图像质量和评估骨转移程度上,18F-NaF PET/CT更优。陈跃等[7]认为18F-NaF在体内的摄取机制类似于99Tcm-MDP,但具有更好的药代动力学特征。Cook[8]则认为99Tcm-MDP显像和NaF显像的不同,主要是由于技术设备的差异而不是显像剂药代动力学的不同。目前,18F-NaF PET/CT用于骨骼病变检查的经验尚且不足,相关诊断标准还不统一[9],价格昂贵;而99Tcm-MDP在临床应用技术较为成熟,且SPECT/CT价格相对低廉,性价比高,更易于推广。尽管SPECT/CT比MRI和CT有更高假阳性率,但有可能比MRI及CT更早发现骨质破坏[10],尤其在枕骨斜坡一带区域,影响SPECT/CT检测结果因素少,且是肿瘤最常见累及部位,和Zhang等[10]报道一致,可信度高。临床实际工作中,因鼻咽癌对射线敏感,初次放疗范围充分勾画及肿瘤靶区足够剂量对预后最为关键,对于鼻咽癌颅底骨侵犯而言,漏诊(假阴性) 往往比误诊(假阳性) 的危害性更大。因此,对于SPECT/CT阳性而MRI阴性病例,如阳性灶位于斜坡、岩尖区域,考虑到该区域合并炎症、骨坏死等良性干扰因素机会较少,可靠性较强。本研究全部8例SPECT/CT阳性而MRI阴性病例,在脑干评估安全前提下给予异常骨质部位更高照射剂量,随访时间为6~24个月,中位时间15个月。有一例患者治疗结束后8个月MRI复查发现颅底骨质破坏,分析其原因,一是SPECT/CT能够较MRI或CT更早发现骨质病灶;二是尽管提高该患者斜坡照射剂量,但仍未达到骨质阳性病灶所需要照射根治性剂量,不足于杀灭所有肿瘤细胞,残留癌细胞短时间再次增殖复发,提示MRI联合SPECT/CT检测基础上个体化放疗有可能改善部分MRI阴性病例预后。
由于放疗后SPECT/CT随访价值有限[10],目前病例治疗后未常规行SPECT/CT复查随访,缺乏放疗前后SPECT/CT检测自身变化对比资料。SPECT/CT出现假阳性的可能原因:99Tcm-MDP并非肿瘤特异性显像剂,99Tcm-MDP骨显像反映骨盐代谢等变化[11],非肿瘤因素导致的骨组织代谢活跃也会引起99Tcm-MDP的异常浓聚,这是假阳性产生的主要原因。假阴性可能原因在于骨代谢活动减低[4],99Tcm-MDP的异常浓聚与成骨细胞活性和血流有关[10],如破骨细胞活性显著超过成骨细胞活性以及其他因素影响导致血流降低,就可能出现漏诊和误诊。
本研究还探讨一些临床常见因素是否影响SBBI阳性检出率。①头痛症状。颅底骨转移患者常会出现头痛症状,典型症状为固定、持续性头痛,可以合并有或无颅神经症状,本研究发现,头痛是SPECT/CT结果阳性的高危因素,和报道一致[4]。②病理类型。恶性程度不同的肿瘤其浸润局部组织的能力可能有所不同,本组病例为均为非角化性癌中未分化型和分化型两种病理亚型,两者阳性检出率差异无统计学意义。可能因它们都属恶性程度较高的病理类型,发生颅底骨的浸润和对骨代谢的影响程度相似,或由于病例数较少而未得出差异有统计学意义的结果。
SPECT骨显像的主要价值在于能够早期发现骨侵犯部位,而且较为直观,但难以对肿瘤侵犯的边界精确定位;MRI目前是临床上NPC患者最重要的影像学检查[12],通过MRI对NPC颅底受侵进行分期还具有一定的预后价值[13],鉴于鼻咽癌容易蔓延侵犯颅底骨和高全身骨转移率,建议将SPECT/CT全身加颅底断层骨显像列为鼻咽癌的备选检查。本研究结果表明,SPECT结合定位CT骨显像为评价NPC颅底骨侵犯较可靠的方法。
利益冲突 无作者贡献声明 朱海生负责执行此研究并撰写文章;王仁生负责此研究的设计;严浩林、黄俊华、陈明东、伍纶庆负责采集病例;阙丽琳、梁雷锋负责数据统计分析
| [1] |
龚唯, 周菊英, 吴琼, 等. MRI成像对鼻咽癌的分期、诊断及治疗优势的探讨[J].
肿瘤防治研究, 2012, 39 (4): 455-459. Gong W, Zhou JY, Wu Q, et al. Investigation of MRI imaging in nasopharyngeal carcinoma staging, diagnosis and treatment advantages[J]. Cancer Res Prev Treat, 2012, 39 (4): 455-459. DOI:10.3971/j.issn.1000-8578.2012.04.023. |
| [2] | Jadvar H, Desai B, Ji L, et al. Prospective evaluation of 18F-NaF and 18F-FDG PET/CT in detection of occult metastatic disease in biochemical recurrence of prostate cancer[J]. Clin Nucl Med, 2012, 37 (7): 637-643. DOI:10.1097/RLU.0b013e318252d829. |
| [3] |
刘德军, 冯彦林, 余丰文, 等. ROC曲线评价18F-FDG PET/CT、99Tcm-MDP骨显像及二者联合对骨转移的检出效能[J].
中华核医学杂志, 2011, 31 (1): 25-28. Liu DJ, Feng YL, Yu FW, et al. The efficacy of 18F-FDG PETCT, 99Tcm-MDP bone scintigraphy, and combination of the two techniques for detecting malignant bone metastasis[J]. Chin J Nucl Med, 2011, 31 (1): 25-28. DOI:10.3760/cma.j.issn.0253-9780.2011.01.007. |
| [4] |
姚红霞, 刘生, 蒋宁一, 等. 99Tcm-MDP SPECT结合定位CT评价鼻咽癌颅底骨侵犯[J].
中华核医学杂志, 2009, 29 (5): 303-305. Yao HX, Liu S, Jiang NY, et al. A study on evaluation of skull base bone involvement of nasopharyngeal cancer with 99Tcm-MDP SPECT combined localizable CT[J]. Chin J Nucl Med, 2009, 29 (5): 303-305. DOI:10.3760/cma.j.issn.0253-9780.2009.05.005. |
| [5] |
乐亚丽, 陈雨, 陈跃, 等. 18F-NaF PET/CT与MRI在鼻咽癌颅底骨质受侵中的对比研究[J].
中华核医学与分子影像杂志, 2016, 36 (1): 34-38. Le YL, Chen Y, Chen Y, et al. Diagnostic value of 18F-NaF PET/CT and MRI in detecting skull-base bone invasion of nasopharyngeal carcinoma[J]. Chin J Nucl Med Mol Imaging, 2016, 36 (1): 34-38. DOI:10.3760/cma.j.issn.2095-2848.2016.01.009. |
| [6] | Iagaru A, Mittra E, Dick DW, et al. Prospective evaluation of 99mTc MDP scintigraphy, 18F NaF PET/CT, and 18F FDG PET/CT for detection of skeletal metastases[J]. Mol Imaging Biol, 2012, 14 (2): 252-259. DOI:10.1007/s11307-011-0486-2. |
| [7] |
陈跃, 赵军, 吴湖炳, 等. 18F-NaF PET/CT骨显像操作指南[J].
中华核医学与分子影像杂志, 2016, 36 (1): 76-78. Chen Y, Zhao J, Wu HB, et al. Operation guide of 18F-NaF PET/CT bone imaging[J]. Chin J Nucl Med Mol Imaging, 2016, 36 (1): 76-78. DOI:10.3760/cma.j.issn.2095-2848.2016.01.018. |
| [8] | Cook GJR. PET and PET/CT imaging of skeletal metastases[J]. Cancer Imaging, 2010, 10 (1): 1-8. DOI:10.1102/1470-7330.2010.0022. |
| [9] | Tarnawska-Pierścińska M, Hołody Ł, Braziewicz J, et al. Bone metastases diagnosis possibilities in studies with the use of 18F-NaF and 18F-FDG[J]. Nucl Med Rev Cent East Eur, 2011, 14 (2): 105-108. DOI:10.5603/NMR. |
| [10] | Zhang SX, Han PH, Zhang GQ, et al. Comparison of SPECT/CT, MRI and CT in diagnosis of skull base bone invasion in nasopharyngeal carcinoma[J]. Biomed Mater Eng, 2014, 24 (1): 1117-1124. DOI:10.3233/BME-130911. |
| [11] |
汪建强, 曹春晓, 杨琦, 等. 18F-FDG SPECT/CT符合线路显像、99Tcm-MDP骨显像及MRI对脊柱转移瘤诊断效能的对比[J].
中华核医学与分子影像杂志, 2015, 35 (5): 403-404. Wang JQ, Cao CX, Yang Q, et al. 18F-FDG SPECT/CT coincidence imaging, 99Tcm-MDP bone imaging and MRI diagnosis of metastatic spinal tumors comparative effectiveness[J]. Chin J Nucl Med Mol Imaging, 2015, 35 (5): 403-404. DOI:10.3760/cma.j.issn.2095-2848.2015.05.015. |
| [12] |
罗树春, 兰海涛, 吴琦. 18F-FDG PET/CT与MRT检测鼻咽癌颅底骨质浸润和靶区勾画的临床研究[J].
重庆医学, 2013, 42 (17): 1957-1959. Luo SC, Lan HT, Wu Q. Clinical research of MRI and 18F-FDG PET/CT in detecting and delineating target volume of skull base invasion in nasopharyngeal carcinoma[J]. Chongqing Med, 2013, 42 (17): 1957-1959. DOI:10.3969/j.issn.1671-8348.2013.17.011. |
| [13] | Cheng YK, Liu LZ, Jiang N, et al. MRI-detected skull-base invasion:Prognostic value and therapeutic implication in intensity-modulated radiotherapy treatment for nasopharyngeal carcinoma[J]. Strahlenther Onkol, 2014, 190 (10): 905-911. DOI:10.1007/s00066-014-0656-7. |
 2017, Vol. 37
2017, Vol. 37


