儿童及青少年鼻咽癌比较少见,在英国1~14岁的鼻咽癌发病率为0.25×10-6,15~19岁上升至(1~2)×10-6,而在我国南方其发病率约2×10-6[1]。对于成人局部晚期鼻咽癌,目前标准治疗是同步放化疗,其3年总生存时间(OS) 约78%,无进展生存时间(PFS) 约69%[2]。同步放化疗基础上的辅助化疗未能进一步延长患者的OS和PFS[3-4],但最近研究显示,在同步放化疗的基础上,诱导化疗可能提高局部晚期鼻咽癌患者的PFS[5]。目前针对儿童及青少年鼻咽癌缺少大型随机对照研究,并且调强放射治疗(IMRT) 早已应用到鼻咽癌的治疗,但是放疗计划及化疗方案都是参考成人鼻咽癌治疗方式[6]。本研究对近6年来采用IMRT联合化疗治疗的 < 19岁鼻咽癌患者,进行了回顾性分析,总结其临床特征、疗效及治疗不良反应。
资料与方法1.临床资料及入组标准:收集2010年4月至2016年4月在山东省肿瘤医院接受治疗的19岁以下鼻咽癌患者58例,经入组标准筛选共43例纳入本研究。入组标准:①经鼻咽镜活检病理证实的。②首次发病年龄≤18岁,且初次治疗,无其他伴随的恶性肿瘤,无远处转移。③有完整的病历和随访资料。④接受IMRT治疗和全身化疗,放疗总剂量>60 Gy,颈部预防剂量≥50 Gy。⑤常规检查包括体格检查、血常规、血生化、胸腹部CT、骨ECT等。⑥头颈部影像学检查采用增强CT和(或) MRI、PET-CT,临床分期采用美国癌症分期联合委员会(AJCC) 第7版标准。所有患者签署放化疗知情同意书。
2.治疗方法:患者采用飞利浦BrillianceTM大孔径CT增强扫描定位,头颈肩热塑形膜固定体位。放疗计划采用逆向IMRT,直线加速器6 MV X射线照射。靶区勾画、剂量处方及计划评估参考《2010年鼻咽调强放疗靶区及剂量设计指引专家共识》[7]。肿瘤靶区总放疗剂量61.2~76 Gy,上颈部预防照射剂量55.8~60 Gy,下颈部预防照射剂量50.4~56 Gy,采用常规分割,1.8~2 Gy/次,5次/周。41例(95.3%) 患者采用分段2~3次计划,通常50.4~56 Gy后行大孔径CT复位扫描,逐步缩野照射;2例(4.7%) 患者采用瘤床同步加量调强放疗(SIB-IMRT),1例采用螺旋断层放射治疗(Tomotherapy)。
入组患者中有33例(76.7%) IMRT前接受1~2个周期的诱导化疗,20例(46.5%) 采用了同步放化疗,36例(83.7%) IMRT后接受了辅助化疗。诱导和辅助化疗方案中27例(62.8%) 患者采用铂类联合5-FU (PF),12例(27.9%) 采用铂类联合多西紫杉醇(TP),化疗周期数为1~6个周期,其中3例患者化疗周期数≤2。20例同步放化疗的患者中有16例(80.0%) 采用单药顺铂每周或每3周方案,2例同步PF方案,1例同步TP方案,1例同步尼妥珠单抗。1例患者放疗后2个月残留直径1.2 cm淋巴结行颈部淋巴结清扫术。
3.不良反应及随访:根据美国肿瘤放射治疗协作组(RTOG) 和美国癌症研究所不良反应评价标准(CTCAE)3.0标准[8],记录放化疗相关的不良反应。随访采用入院检查和电话随访。患者放疗结束前2年每3个月入院复查,包括头颈部CT或MR,胸腹部影像学检查,血常规、血生化,脑垂体及甲状腺功能,必要时行骨ECT和鼻咽镜检查;3年后每半年复查1次。全组患者失访1例,最长随访时间76个月,中位随访时间24个月,5例(11.6%) 患者达到或接近5年随访时间,27例(62.8%) 患者达到或接近2年随访时间。
4.统计学处理:采用SPSS 20.0软件进行分析,Kaplan-Meier计算OS和PFS,采用Log-rank检验做单因素分析,分析临床分期、放疗剂量、化疗、年龄对总生存时间的影响。P < 0.05为差异有统计学意义。
结果1.入组患者临床特征:入组患者临床特征列于表 1。由表 1可知,入组患者中位年龄14岁(6~18岁),男性29例(67.4%),女性14例(32.6%);30例(69.8%) 为非角化性未分化型癌,12例(27.9%) 为非角化性分化型癌,1例(2.3%) 为非角化性癌未进一步分类,Ki-67+中位数60%(3%~90%)。根据AJCC第7版,首发诊断Ⅱ期2例(4.6%),Ⅲ期26例(60.5%),ⅣA期7例(16.3%),ⅣB期8例(18.6%)。治疗前EB病毒依壳抗原IgA抗体阳性率53.8%(7/13),Rta-IgG抗体阳性率60.0%(6/10)。
|
|
表 1 43例儿童及青少年鼻咽癌患者临床特征 Table 1 Patient characteristics for 43 children and adolescents with nasopharyngeal carcinoma |
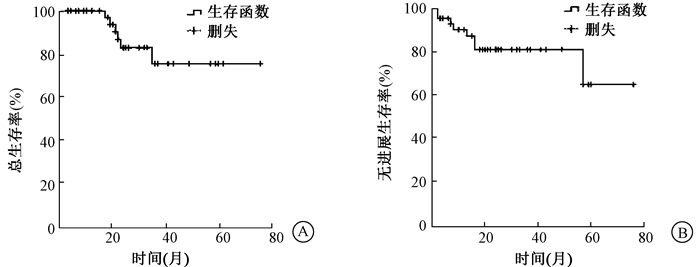
2.治疗效果:所有入组患者均完成既定的放射治疗,IMRT中位剂量70 Gy (61.2~76 Gy),有38例患者放疗后做了疗效评估,其中30例(78.9%) 达到完全缓解,8例(21.1%) 部分缓解。2例(4.7%) T4N2-3患者治疗结束半年出现肿瘤复发,5例(11.6%) 患者治疗后两年内出现骨转移,其中,1例(2.3%) 同时出现颈部和锁骨上淋巴结转移,另1例出现肺门、纵隔淋巴结转移;1例(2.3%) 患者治疗结束3年出现颞叶转移。43例患者中位随访24个月(3~76个月),2年和5年OS分别为82.8%和75.3%,2年和5年PFS分别80.9%和64.7%。图 1显示43例儿童及青少年鼻咽癌患者放化疗后5年的累积OS和PFS曲线。
|
图 1 43例儿童及青少年患者Kaplan-Meier总生存曲线(A) 和无进展生存曲线(B) Figure 1 The Kaplan-Meier overall survival (OS)(A) and progression-free survival (PFS)(B) curves in 43 children and adolescents with nasopharyngeal carcinoma |
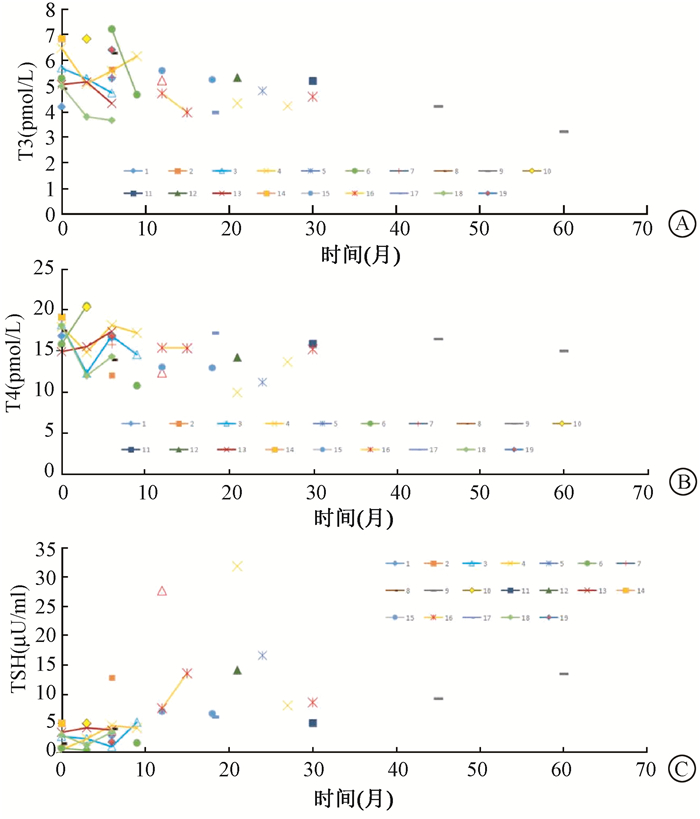
3.不良反应:所有入组患者均接受了化疗,仅有1例患者未能完成1个周期的化疗,其原因非治疗相关反应所导致,另有2例患者化疗周期数≤2。有31例患者评估了治疗相关不良反应,治疗期间常见的不良反应包括1~2级胃肠道反应、骨髓抑制、放射性黏膜炎症及皮肤损伤,严重的不良反应如表 2所示,无4级及以上不良反应。记录的常见晚期不良反应有口干、颈部肌肉纤维化、听力下降,以上均为1~2级反应,无3级及以上晚期不良反应,其他不良反应列于表 3,其中1例长期生存患者出现1级生长发育障碍,1例患者放疗后4年出现放射性颞叶坏死并失明,1例患者放疗后2年鼻咽出血死亡。另有47.4%(9/19) 患者IMRT后出现促甲状腺素(TSH) 的增高或伴有游离三碘甲状腺原氨酸(T3)、甲状腺素(T4) 的降低。图 2为19例患者在治疗前及随访期间T3、T4和TSH的变化折线图,其中9例患者TSH在随访期间出现显著增高(中位数13.41 μU/ml,范围5.12~31.70 μU/ml),各有3例患者伴随T3(中位数3.3 pmol/L,范围3.23~3.87 pmol/L)、T4(中位数10.72 pmol/L,范围3.23~3.87 pmol/L) 的轻微降低;有4例患者(21.1%) 出现乏力等症状,诊断为2级甲状腺功能减退,给予了甲状腺激素替代治疗,其余5例患者无显著临床症状。
|
|
表 2 31例儿童及青少年鼻咽癌患者放化疗相关急性不良反应结果 Table 2 Results of acute side-effects associated with radiochemotherapy in 31 children and adolescents with nasopharyngeal carcinoma |
|
|
表 3 31例儿童及青少年鼻咽癌患者放化疗远期不良反应结果 Table 3 Results of long-term side-effects associated with radiochemotherapy in 31 children and adolescents with nasopharyngeal carcinoma |
|
图 2 19例儿童及青少年患者放疗后游离三碘甲状腺原氨酸(T3) (A)、甲状腺素(T4)(B) 和促甲状腺素(TSH)(C) 变化折线图 Figure 2 Line chart for changes of free triiodothyronine (T3)(A), thyroxine (T4)(B), and thyroid-stimulating hormone (TSH)(C) after completing radiotherapy in 19 children and adolescents with nasopharyngeal carcinoma |
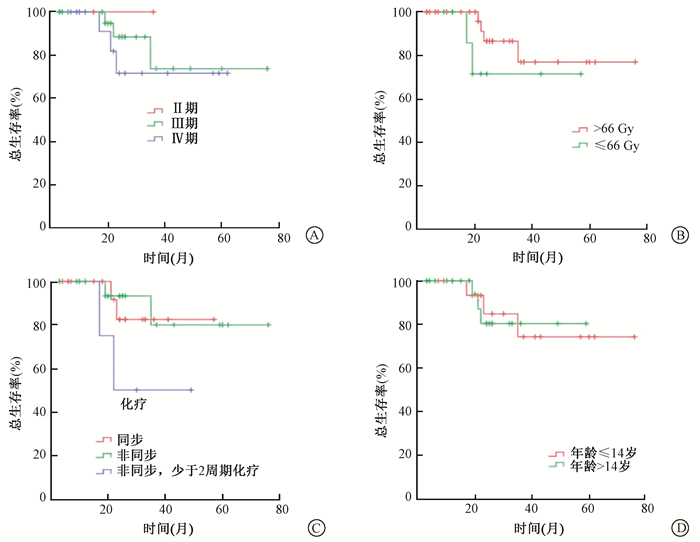
4.预后因素分析:临床分期、放疗总剂量、化疗因素及年龄对总生存的影响,示于图 3。由图 3可见,不同临床分期的患者之间OS差异无统计学意义(P>0.05);同步放化疗与非同步放化疗及化疗周期数≤2周期患者OS差异也无统计学意义(P>0.05),但是化疗周期数≤2周期患者OS曲线与其他两组曲线明显分离;放疗总剂量(≤66 Gy对比>66 Gy) 和患者年龄(14岁对比14~18岁) 对OS的影响也无统计学意义(P>0.05)。
|
图 3 临床分期(A)、放疗总剂量(B)、化疗因素(C) 及年龄(D) 对儿童及青少年鼻咽癌总生存率的影响 Figure 3 Influence of clinical stage (A), radiation dose (B), chemotherapy (C), and age (D) on overall survival for children and adolescents with nasopharyngeal carcinoma |
讨论
本研究结果显示,儿童及青少年鼻咽癌肿瘤分化差,恶性程度高,100%的肿瘤为非角化型癌[世界卫生组织(WHO)Ⅱ、Ⅲ型],其中未分化癌(WHO Ⅲ型) 最多见,占有69.8%;初诊时临床分期也通常比较晚,95.3%的患者为Ⅲ~ⅣB期。EB病毒相关抗体阳性表达率在50%以上。这一特点与我国南方儿童及青少年鼻咽患者基本一致[9-10]。另一项来自北京的回顾性研究,分析了148例儿童及青少年鼻咽癌患者,93.9%的患者为Ⅲ~Ⅳ期,低分化癌143例(96.6%),但未分化癌仅有1例[11]。研究显示EB病毒感染与鼻咽癌发病原因、预后相关[12],EB病毒阳性的患者预后相对更差[12-13]。
目前,儿童及青少年鼻咽癌治疗参照成人鼻咽癌的治疗方式,采用放化疗综合治疗。本研究入组患者治疗后2年和5年OS分别达到82.8%和75.3%,2年和5年PFS分别达到80.9%和64.7%;治疗失败模式主要包括:多发骨转移(11.6%) 和脑转移(2.3%),区域或远处淋巴结转移(4.7%) 和肿瘤未控复发(4.7%)。刘菊英等[9]和曹卡加等[10]的研究采用二维放疗技术,共有8例患者放疗总剂量≤60 Gy,仅有20%~30%的患者给予了化疗,5年OS约56.4%~76.5%;但曹卡加等[10]的研究纳入相对更多早期患者,生存期反而低于刘菊英等[9]的研究。另有3项回顾性研究,大部分患者采用二维放射治疗, < 40%的患者采用IMRT,放疗总剂量均大于60 Gy,30~80%患者接受化疗,5年OS达到79.3~82.9%[11, 14-15]。Guo等[16]的研究纳入的患者均采用IMRT,放疗总剂量60.2~79.75 Gy,所有患者接受化疗,4年OS达到90.8%,并且该研究纳入的均为Ⅲ~Ⅳ期患者。
从上述研究数据发现,采用IMRT联合化疗取得了较好的远期生存,其局部区域失败和远处转移率均比前5项研究有所减低,但远处转移仍为治疗失败的主要模式,最常见的转移部位为骨,其次为肺[9-11, 14-15]。
本研究记录了治疗期间出现较严重(CTCAE 3级) 的急性不良反应主要有:骨髓抑制(29.0%),黏膜炎症(14.0%) 和胃肠道反应(4.7%)。本研究入组患者中多数为1~2级反应,能够耐受放化综合治疗,无4级及以上的不良反应。Chen等[4]的研究也发现,儿童及青少年鼻咽癌患者出现严重急性黏膜反应和胃肠道反应的发生率要较成人患者低。但是,对于儿童及青少年鼻咽癌患者,晚期反应更应该给予足够重视。既往研究报道的晚期反应数据显示,口干(24.8%~51.3%)、颈部纤维化(25.7%~42.8%)、听力下降(11.7%~28.4%)、张口困难(3.8%~22.7%)、牙齿损害(2.0%~35.2%) 及颅神经损伤(3.2%~19.3%) 比较常见[9-11, 14-16]。可能由于各研究的随访时间及放疗技术的不同,部分晚期反应发生率存在较大差异。裴苏等[11]研究发现,采用IMRT技术能较二维放疗技术减低上述常见晚期反应的发生率。[JP3]另外,放射性脊髓炎(0.6%~2.1%)、脑和脑干损伤(3.4%~5.4%) 以及放疗后出现视力下降(2.5%~5.5%)、生长发育障碍(8.3%~12.0%)、鼻咽出血(5.5%)、脊髓炎(0.6%~2.1%)、第二原发肿瘤(0.7%~3.4%) 在多个临床治疗中心均可观察到,但上述严重的远期反应发生率报道的比较少[9-11, 14-16]。另外,本研究发现,有47.4%的入组患者IMRT后出现1~2级的甲状腺功能减退,放疗结束半年后部分患者即可出现TSH的增高,随着时间的延长,其发生率会逐渐增高,约1/3的患者会伴有T3和T4的轻度减低,约不到1/2的患者会出现甲状腺功能减退的非特异性临床症状。既往研究认为低龄、女性、甲状腺接受≥40 Gy相对体积>80%是出现甲状腺功能减退的高风险因素[17]。另外,因放疗后垂体机能减退导致甲状腺功能减低也不容忽视[18]。
目前儿童及青少年的标准治疗仍未确定,缺少多中心随机对照研究的证实。Peng等[19]的一项前瞻性随机对照研究证实了IMRT较二维放疗提高肿瘤控制率和鼻咽癌患者的生存率,同时减低放疗不良反应发生率。对于放疗剂量国内外也存在一定争议,NPC-91-GPOH研究采用放化疗联合IFN-β治疗儿童鼻咽癌,放疗总剂量59.4 Gy,治疗结果显示3年OS为95%,PFS为91%[20]。另一项国外的研究同样给予Ⅳ期鼻咽癌原发灶59.4 Gy,5年OS 73%,DFS为75%[21]。而国内应用IMRT给予了更高的放疗剂量,提高放疗剂量能否转变为生存获益目前尚未确定,但国内大部分回顾性研究显示5年OS均超过73%[11, 14-16]。由于该患者群体的特点(肿瘤分化差,病期晚),在保证局部控制率不降低的前提下减低放疗总剂量仍需要进一步探索,可能需要联合其他有效的治疗方法[22]。儿童和青少年鼻咽癌IMRT联合化疗治疗失败的主要模式仍是远处转移,是影响患者总生存的最主要原因,有多个研究探索寻找预后因素,期望指导治疗方案的决策,但各回顾性研究结果不尽完全一致[9-11]。本研究也分析了临床分期、放疗剂量和年龄因素对生存的影响,但没有得到具有统计学意义的结果。对于没有采用同步放化疗,并且全身化疗少于2个周期的3例患者,其生存率低,生存曲线明显与其他两组分离,但可能由于入组样本小,差异也无统计学意义。Ozyar等[23]分析了165例年龄 < 18岁的鼻咽癌患者,中位随访48个月(5~249个月),5年OS和DFS分别为77.4%和68.8%。研究认为,T分期是无局部复发生存的预后因素,T3-4患者出现局部复发风险增高;N分期是OS和DFS的预后因素,N3患者5年OS和DFS分别为69%和56%,显著低于淋巴结分期更早的患者;年龄>14岁的患者更容易出现局部区域失败,而男性患者出现远处转移的风险较女性更高;放疗剂量 < 66 Gy的患者出现局部区域失败风险增高,不联合化疗则局部区域失败以及远处转移均会增加。目前,化疗是降低远处转移的重要治疗手段,但最佳的化疗方案也未确定。一项Ⅱ期随机对照研究对比了PF方案和TPF方案对儿童及青年鼻咽癌患者的治疗效果,但两组之间生存差异无统计学意义[24]。因此,针对儿童及青少年鼻咽癌全身治疗方案,如何联合放疗来提高远期生存、减低远处转移,仍需要长期不断探索。
最后,需要指出的是本研究为单中心小样本回顾性研究,随访时间相对较短,因此,对长期生存时间的统计及远期并发症的观察产生一定影响。可能由于样本例数少,也未观察到临床分期、放疗剂量、化疗和年龄对长期生存的影响。总之,本研究初步结论认为,儿童及青少年鼻咽癌特点为肿瘤分化差,初诊时临床分期晚。患者能够耐受放化综合治疗,预后相对较好,骨转移是最常见的治疗失败模式,放疗后甲状腺功能减退较为常见。
利益冲突 无作者贡献声明 朱海生负责执行此研究并撰写文章;王仁生负责此研究的设计;严浩林、 黄俊华、 陈明东、 伍纶庆负责采集病例;阙丽琳、 梁雷锋负责数据统计分析
| [1] | Brennan B. Nasopharyngeal carcinoma[J]. Orphanet J Rare Dis, 2006, 1 : 23 DOI:10.1186/1750-1172-1-23. |
| [2] | Al-Sarraf M, LeBlanc M, Giri PG, et al. Chemoradiotherapy versus radiotherapy in patients with advanced nasopharyngeal cancer:phase Ⅲ randomized Intergroup study 0099[J]. J Clin Oncol, 1998, 16 (4): 1310-1317. DOI:10.1200/jco.1998.16.4.1310. |
| [3] | Dong YY, Xiang C, Lu JX, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy in locoregionally advanced nasopharyngeal carcinoma:A matched-pair multicenter analysis of outcomes[J]. Strahlenther Onkol, 2016, 192 (6): 394-402. DOI:10.1007/s00066-016-0970-3. |
| [4] | Chen L, Hu CS, Chen XZ, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma:a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol, 2012, 13 (2): 163-171. DOI:10.1016/S1470-2045(11)70320-5. |
| [5] | Sun Y, Li WF, Chen NY, et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma:a phase 3, multicentre, randomised controlled trial[J]. Lancet Oncol, 2016, 17 (11): 1509-1520. DOI:10.1016/S1470-2045(16)30410-7. |
| [6] | Ayan I, Kaytan E, Ayan N. Childhood nasopharyngeal carcinoma:from biology to treatment[J]. Lancet Oncol, 2003, 4 (1): 13-21. DOI:10.1016/S1470-2045(03)00956-2. |
| [7] | 中国鼻咽癌临床分期工作委员会. 2010鼻咽调强放疗靶区及剂量设计指引专家共识[J]. 中华放射肿瘤学杂志, 2011, 20 (4): 267-269. |
| [8] | Ghosh S, Rao PB, Kumar PR, et al. Concurrent chemoradiation with weekly cisplatin for the treatment of head and neck cancers:an institutional study on acute toxicity and response to treatment[J]. Asian Pac J Cancer Prev, 2015, 16 (16): 7331-7335. DOI:10.7314/APJCP.2015.16.16.7331. |
| [9] |
刘菊英, 魏宝清, 陆进成, 等. 145例儿童及青少年鼻咽癌临床与疗效分析[J].
中华放射肿瘤学杂志, 2003, 12 (4): 234-238. Liu JY, Wei BQ, Lu JC, et al. Clinical analysis of radiotherapy for nasopharyngeal carcinoma in 145 children and adolescents[J]. Chin J Radiat Oncol, 2003, 12 (4): 234-238. DOI:10.3760/j.issn:1004-4221.2003.04.006. |
| [10] |
曹卡加, 李茵, 谢国丰, 等. 儿童与青少年鼻咽癌的预后因素分析[J].
中华肿瘤杂志, 2006, 28 (2): 134-137. Cao KJ, Li Y, Xie GF, et al. Prognostic factors in nasopharyngeal carcinoma in childhood and adolescence[J]. Chin J Radiat Oncol, 2006, 28 (2): 134-137. DOI:10.3760/j.issn:0253-3766.2006.02.015. |
| [11] |
裴苏, 高黎, 易俊林, 等. 148例儿童及青少年鼻咽癌疗效及预后因素分析[J].
中华放射肿瘤学杂志, 2011, 20 (3): 175-180. Pei S, Gao L, Yi JL, et al. The outcome and prognosis factors of adolescent nasopharyngeal carcinoma treated in a single institute-analysis of 148 patients[J]. Chin J Radiat Oncol, 2011, 20 (3): 175-180. DOI:10.3760/cma.j.issn.1004-4221.2011.03.001. |
| [12] | Peng H, Chen L, Zhang Y, et al. Survival analysis of patients with advanced-stage nasopharyngeal carcinoma according to the Epstein-Barr virus status[J]. Oncotarget, 2016, 7 (17): 24208-24216. DOI:10.18632/oncotarget.8144. |
| [13] | Chen WH, Tang LQ, Guo SS, et al. Prognostic value of plasma Epstein-Barr virus DNA for local and regionally advanced nasopharyngeal carcinoma treated with cisplatin-based concurrent chemoradiotherapy in intensity-modulated radiotherapy era[J]. Medicine (Baltimore), 2016, 95 (5): e2642 DOI:10.1097/MD.0000000000002642. |
| [14] | Lu S, Chang H, Sun X, et al. Long-term outcomes of nasopharyngeal carcinoma in 148 children and adolescents[J]. Medicine (Baltimore), 2016, 95 (17): e3445 DOI:10.1097/MD.0000000000003445. |
| [15] | Liu W, Tang Y, Gao L, et al. Nasopharyngeal carcinoma in children and adolescents-a single institution experience of 158 patients[J]. Radiat Oncol, 2014, 9 : 274 DOI:10.1186/s13014-014-0274-7. |
| [16] | Guo Q, Cui X, Lin S, et al. Locoregionally advanced nasopharyngeal carcinoma in childhood and adolescence:Analysis of 95 patients treated with combined chemotherapy and intensity-modulated radiotherapy[J]. Head Neck, 2016, 38 (Suppl 1): E665-E672. DOI:10.1002/hed.24066. |
| [17] |
王冬青, 翟利民, 高敏, 等. 头颈部肿瘤调强放射治疗后甲状腺功能减退的临床参数和剂量影响因素[J].
中华放射医学与防护杂志, 2014, 34 (3): 201-205. Wang DQ, Zhai LM, Gao M, et al. Clinical and dosimetric factors for radiation-induced hypothyroidism following intensity-modulated radiotherapy in patients with head-and-neck cancer[J]. Chin J Radiol Med Prot, 2014, 34 (3): 201-205. DOI:10.3760/cma.j.issn.0254-5098.2014.03.011. |
| [18] | Ipekci SH, Cakir M, Kiyici A, et al. Radiotherapy-induced hypopituitarism in nasopharyngeal carcinoma:the tip of an iceberg[J]. Exp Clin Endocrinol Diabetes, 2015, 123 (7): 411-418. DOI:10.1055/s-0035-1549963. |
| [19] | Peng G, Wang T, Yang KY, et al. A prospective, randomized study comparing outcomes and toxicities of intensity-modulated radiotherapy vs. conventional two-dimensional radiotherapy for the treatment of nasopharyngeal carcinoma[J]. Radiother Oncol, 2012, 104 (3): 286-293. DOI:10.1016/j.radonc.2012.08.013. |
| [20] | Mertens R, Granzen B, Lassay L, et al. Treatment of nasopharyngeal carcinoma in children and adolescents:definitive results of a multicenter study (NPC-91-GPOH)[J]. Cancer, 2005, 104 (5): 1083-1089. DOI:10.1002/cncr.21258. |
| [21] | Orbach D, Brisse H, Helfre S, et al. Radiation and chemotherapy combination for nasopharyngeal carcinoma in children:Radiotherapy dose adaptation after chemotherapy response to minimize late effects[J]. Pediatr Blood Cancer, 2008, 50 (4): 849-853. DOI:10.1002/pbc.21372. |
| [22] | Kontny U, Franzen S, Behrends U, et al. Diagnosis and treatment of nasopharyngeal carcinoma in children and adolescents-recommendations of the GPOH-NPC study group[J]. Klin Padiatr, 2016, 228 (3): 105-112. DOI:10.1055/s-0041-111180. |
| [23] | Ozyar E, Selek U, Laskar S, et al. Treatment results of 165 pediatric patients with non-metastatic nasopharyngeal carcinoma:a rare cancer network study[J]. Radiother Oncol, 2006, 81 (1): 39-46. DOI:10.1016/j.radonc.2006.08.019. |
| [24] | Casanova M, Özyar E, Patte C, et al. International randomized phase 2 study on the addition of docetaxel to the combination of cisplatin and 5-fluorouracil in the induction treatment for nasopharyngeal carcinoma in children and adolescents[J]. Cancer Chemother Pharmacol, 2016, 77 (2): 289-298. DOI:10.1007/s00280-015-2933-2. |
 2017, Vol. 37
2017, Vol. 37


