2. 550004 贵阳, 贵州医科大学附属肿瘤医院 贵州省肿瘤医院物理技术室
2. Physical Technical Room, Guizhou Medical University Affiliated Cancer Hospital and Guizhou Cancer Hospital, Guiyang 550004, China
近年来,多中心大样本研究的长期随访结果表明,术前新辅助治疗是局部进展期直肠癌标准治疗手段,并得到美国国家综合癌症网络(NCCN)指南和我国2010年卫生部、2015年卫计委颁发的《结直肠癌诊治规范》推荐。虽然多项Ⅲ期研究的结果显示术前同步放化疗可获得良好的降期率和局部控制率,但5年远处转移率高达25%~40%,总生存率并无明显获益[1-3]。其中一个重要原因是,目前标准治疗模式下,完成全部的术前放化疗和手术后4~5个月后才接受全身化疗,同时因术前辅助治疗不良反应、手术并发症等原因患者常延迟、中断或拒绝行术后辅助化疗,并在接受术后辅助化疗患者中,也仅有50%的患者能如期完成全部化疗剂量[4-5]。目前,国内外专家提出了加强同步化疗强度、优化术前放化疗顺序等新辅助治疗策略以增加新辅助强度,期望可以提高疗效。
优化术前放化疗顺序包括术前同步放化疗后等待手术期间加入全身化疗这一模式,Garcia-Aguilar等[6]、Zampino等[7]和Bujko等[8]研究结果均表明,该新辅助治疗策略可以获得良好的病理完全缓解(pCR)率,但国内少有报道。本研究对比同步放化疗后加入全身化疗与单纯同步放化疗治疗局部进展期直肠癌的疗效及安全性,比较两组的近期疗效和长期生存率,以及放化疗中和术后并发症发生率。
资料与方法1.研究对象:2012年1月-2015年12月本院收治的85例Ⅱ~Ⅲ期中下段局部进展期直肠癌患者进行前瞻性Ⅱ期随机对照研究。纳入标准:年龄≥18岁,男女不限;卡氏评分(KPS)均≥70;纤维结肠镜及组织病理活检诊断为直肠腺癌;纤维肠镜检查证实肿瘤下缘距肛缘12 cm以内,排除双原发癌;直肠腔内超声检查或盆腔磁共振明确肿瘤浸润深度为T3~T4B和(或)区域淋巴结转移为阳性;胸部CT、中上腹部CT增强检查未发现远处转移;血常规、肝肾功能、电解质及心肺功能检查均正常,无放化疗及手术禁忌证;无氟尿嘧啶类药物过敏史,无铂类药物过敏史;患者为初次治疗,诊断疾病至入组前无化疗或其他抗肿瘤治疗,无盆腔放疗病史;入组患者均签订知情同意书。
采用抽签法将85例患者随机分为试验组:同步放化疗加全身化疗43例;对照组:同步放化疗42例。本研究试验组有3例患者入组后被剔除,其中2例拒绝按流程完成治疗,1例因突发严重心绞痛未能开始治疗。对照组有2例患者被剔除,其中1例尚未开始治疗因个人原因主动退组,另1例因不配合检查故无法获得治疗资料。试验组及对照组可供分析的患者均40例。
2.术前同步放化疗:根据Roels等[9]的研究结果,肿瘤靶区(GTV)定义为肠镜、影像学及触诊确定的直肠肿瘤;将临床靶区(CTV)定义为原发灶高危区和区域淋巴结引流区,包括骶前区、坐骨直肠窝、盆腔侧壁、髂内淋巴结、部分髂总或髂外血管周围淋巴结、直肠系膜区域、闭孔区域。CTV上界通常为L5椎体下缘,下界为肛管下缘,侧界为真骨盆内缘,前界包括充盈膀胱后壁1/4~1/3,后界包括骶骨皮质一半(S3上缘以上)和骶骨皮质后缘(S3上缘以下)。CTV包括了S3水平以上的髂内外淋巴引流区,未包括S3水平以下的髂外淋巴结引流区。PTV由CTV外扩而成(左右、头脚及背方均向外扩1 cm,腹方向外扩0.5 cm)。危及器官包括照射范围内的小肠、结肠(从L3上缘以下全部勾画)、膀胱(充盈、不充盈状态)、双侧股骨头。均采用6 MV X射线,调强放疗技术(IMRT)常规分割,计划靶区(PTV)处方剂量为45 Gy,GTV同步加量至50 Gy,1.8 Gy/次,1次/d,5次/周,共25次。100%的处方剂量包括95%PTV,危及器官剂量的限定:小肠、结肠V40<30%,V50<10%,V20 < 50%;膀胱V45<50%;股骨头V50<5%。
盆腔放疗同步化疗方案:单药5-FU225 mg·m-2·d-1,与放疗同步每周第1~5天,持续静脉滴注120 h。
3.术前新辅助化疗:试验组患者完成同步放化疗后休息1~2周进行新辅助化疗:FOLFOX4方案(奥沙利铂,85 mg/m2,静脉滴注,第1天;氟尿嘧啶,400 mg/m2,静脉推注,第1、2天,氟尿嘧啶,600 mg/m2,持续静脉滴注22 h,第1、2天;亚叶酸钙,200 mg/m2,静脉滴注,第1、2天,14 d为一周期),共4周期。70~75岁患者减量20%,75~80岁患者减量30~40%,80岁以上的减量50%。
4.根治性手术:要求全直肠系膜切除术(total mesorectal excision,TME),试验组在新辅助化疗结束后立即手术。对照组在同步放化疗结束后休息6~8周,再行根治性手术。
5.术后辅助化疗:两组患者在术后4周均需行FOLFOX4方案辅助化疗(化疗药物使用剂量、用法及减量原则同前述新辅助化疗)。试验组需完成4周期,对照组需完成8周期。
6.疗效及不良反应评价:首要研究终点为病理完全缓解率(pCR率)、降期率,次要研究终点为局部复发率、远处转移率及总生存率。两组新辅助放化疗后均予复查并行多学科会诊(MDT)以决定是否手术及选择何种术式。术后病理报告行ypTNM分期,与新辅助治疗前分期对比评价降期情况,并评价pCR情况。
按照美国国立癌症研究所通用不良反应标准3.0版(National Cancer Institute Common Toxicity Criteria Version 3.0,NCICTC 3.0),评价放化疗期间的不良反应。
7.统计学处理:应用SPSS 17.0软件进行数据处理。入组患者年龄、化疗完成周期数采用中位数;两组患者男女比例、肿瘤部位、术前分期、KPS评分情况、降期率、pCR率、R0切除率、不良反应发生、术中及术后并发症发生采用构成比或率表示。两组率的比较运用χ2检验;采用Kaplan-Meier法对生存率进行生存分析,两组生存率比较采用Log-rank检验。P < 0.05为差异有统计学意义。
结果1.两组患者一般资料对比:两组患者在年龄、性别、肿瘤距肛缘距离以及术前分期等方面差异均无统计学意义,具体患者基本临床资料见表 1。
|
|
表 1 试验组与对照组一般资料对比 Table 1 Comparison of the patients′ characterists between the experience group and the control group |
2.近期疗效
(1) 两组患者术前与术后TNM分期的降期情况、pCR率:试验组及对照组分别有9名和13名cT4B患者新辅助治疗后未能明显降期,经外科医师评估无法行根治性手术,故未能获取ypTNM分期情况,而对照组1名患者则因出现远处转移病灶无法行根治性切除,无法获取ypTNM分期。两组患者降期率分别为试验组77.4%(24/31),对照组55.6%(15/27),试验组明显高于对照组,但差异无统计学意义(P>0.05)。试验组pCR率为20.0%(8/40),对照组pCR率为5.0%(2/40),差异有统计学意义(χ2=4.114,P < 0.05),见表 2。
|
|
表 2 两组患者新辅助治疗前与术后肿瘤TNM分期的变化及降期率 Table 2 Postoperative TNM staging and tumor downstaging rate of patients after neoadjuvant therapy in two groups |
试验组新辅助治疗前25例(62.5%)患者有淋巴结转移,术后病理证实有2名患者淋巴结阳性,不能手术患者中有7名cT4N+新辅助治疗后评估仍有淋巴结转移阳性,试验组淋巴结阳性率从62.5%下降至22.5%。对照组新辅助治疗前29例(72.5%)患者有淋巴结转移,手术后病理证实7例患者淋巴结阳性,不能手术13名患者中有13名cT4N+患者经新辅助治疗后评估仍有淋巴结转移阳性,故对照组淋巴结阳性率从72.5%下降至50.0%。
(2) 根治性切除率(R0切除率):试验组R0切除率为77.5%(31/40)与对照组65.0%(26/40)差异无统计学意义(P>0.05)。
3.远期疗效
(1) 3年局部复发率、远处转移率及总生存率:本研究中位随访时间30个月(6~48个月),随访率100%。试验组局部复发率9.6%(3/31)与对照组11.5%(3/26)差异无统计学意义(P>0.05)。其中,试验组远处转移率25.0%(10/40)较对照组37.5%(15/40)低(P>0.05)。试验组3年总生存率为72.5%,对照组65.5%,但差异无统计学意义(P>0.05),见图 1。
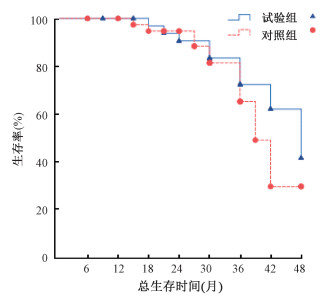
|
图 1 两组患者的3年总生存率生存曲线 Figure 1 The survival curves of the 3-year survival rate in two groups |
(2) 获得R0切除术后患者3年远处转移率及总生存率:试验组获得R0切除术患者3年远处转移率为19.4%(6/31),低于对照组的30.7%(8/26),但差异无统计学意义(P>0.05);试验组3年总生存率为83.9%,高于对照组的79.6%,但差异无统计学意义(P>0.05),见图 2。
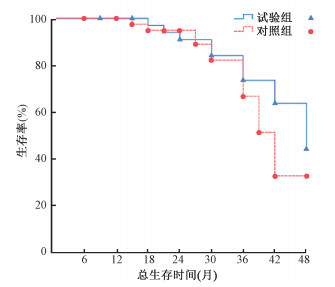
|
图 2 获得R0切除术后两组患者3年总生存率生存曲线 Figure 2 The survival curves of the 3-year survival rate in two groups after the curative resection |
4.术前同步放化疗及全身化疗完成情况及不良反应:两组中接受R0切除术后的共57名患者均行术前同步放化疗。在同步放化疗中,两组患者没有出现4级不良反应,试验组与对照组中分别有6名及4名患者因同步放化疗中不良反应而中断氟尿嘧啶同步化疗。
试验组31名手术患者均完成术前4周期新辅助全身化疗;完成辅助化疗中位周期数为3(2~4);全身化疗完成中位周期数为7(5~9);对照组26名手术患者中辅助化疗完成中位周期数为7(4~8)。试验组接受8周期全身化疗完成率为87.1%,明显高于对照组的61.5%(χ2=4.985,P < 0.05)。两组患者的不良反应发生情况:试验组发生白细胞下降、血小板下降、腹泻、恶心呕吐、神经系统不良反应的患者均低于对照组,但差异均无统计学意义(P>0.05),不良反应发生率见表 3。
|
|
表 3 两组R0切除术后患者围手术期放化疗不良反应比较 Table 3 toxicities in two groups of patients with curative resections after the neoadjuvant chemoradiotherapy and systemic chemotherapy |
5.术中及术后并发症:接受R0切除术的57例患者无因术中及术后并发症死亡者。术中及术后并发症主要包括:术中出血、切口延期愈合、吻合口瘘。试验组与对照组中,术中出血发生率分别为9.7%(3/31)和7.7%(2/26),伤口延期愈合发生率分别为19.4%(6/31)和15.4%(4/26),吻合口瘘发生率分别为6.5%(2/31)和3.8%(1/26),两组术中及术后并发症差异均无统计学意义(P>0.05)。
讨论目前对于局部进展期直肠癌术前同步放化疗作为其标准治疗模式,局部复发率可降至10%以下;但术前新辅助同步放化疗不能进一步降低远处转移率,进而提高总生存率、无瘤生存率。因此,如何降低远处转移率从而提高总生存率成为局部进展期直肠癌治疗的主要目标。
pCR率可在手术后立即获得,是近期疗效主要判断指标,也是观察和预测远期预后的重要指标。Martin等[10]Meta分析显示新辅助后获得pCR患者与非pCR相比5年的局部复发率、远处转移率较低,并获得更佳的生存。pCR率与术前治疗强度和术前同步放化疗结束至手术治疗的间隔时间相关;因此若想提高pCR率,最主要的方法为改变术前新辅助治疗策略,这也是最有可能改善局部进展期直肠癌后预后的方式。
加强术前治疗强度,方法之一即加强与放疗同步化疗强度。将奥沙利铂用于同步化疗中也成为研究热点,但研究结果表明,对获得pCR率的提高并无统一结论[11-12]。方法之二是优化术前放疗、化疗的顺序。其主要包括两种模式:诱导化疗+长程同步放化疗、诱导化疗+短程放疗;长程同步放化疗+新辅助化疗、短程放疗+新辅助化疗。越来越多的研究对后一种模式提出了探索,较标准术前同步放化疗相比明显提高了pCR率;这不仅因为术前增加全身化疗强度,还因为随着全身化疗增加而延长同步放化疗结束至手术时间间隔;同时早期介入全身化疗可以尽早治疗体内的微转移病变,有望低远处转移率,从而提高总生存率[9-11]。
本研究以pCR率为主要主要终点,试验组较对照组提高了的pCR率(20.0%和5.0%),且两组差异有统计学意义。Lyon R-90试验发现,放疗结束至手术时间的长间隔组较短间隔组在降低肿瘤总反应率、病理降期率均有优势,这是因为肿瘤细胞在照射之后坏死需要经过一定的时间,放疗结束至手术间隔时间较长,可以让肿瘤组织有充分的退缩时间[13]。本研究试验组与对照组同步放化疗结束至手术中位间隔时间分别为9.8和7.4周,试验组较对照组pCR率的提高可能与加入全身化疗增加术前治疗强度相关,同时可能与加入化疗延长放化疗结束至手术的时间间隔相关。但本研究试验组获得的pCR率仍明显低于Garcia-Aguilar等[6]的研究结果,同样对照组的pCR率也显著低于多项Ⅲ期临床研究报告结果[11-12]。这可能与T4患者入组比例相关。试验组cT4B患者比例为67.5%,明显高于Garcia-Aguilar等[6]研究比例(仅4%)。对照组中cT4B期患者比例为67.5%, 也高于多项研究中T4入组患者比例(5%~17%)[14-15]。因此,cT4患者比例高成为本研究试验组与对照组pCR率均较低的重要原因。
本研究两组患者3年局部复发率在10%左右(9.6%及11.5%,P=0.820)。试验组的3年的远处转移率及总生存率均优于对照组,但差异均无统计学意义。这可能是两组患者中均有经新辅助治疗后有不能手术患者,该患者肿瘤负荷较大,更容易发生远处转移导致死亡,因而影响生存分析。将不能手术的23例患者排除再次进行分析,虽然试验组较对照组患者3年远处转移率更低,3年总生存率优于对照组,但差异无统计学意义。这可能与随访时间不够长有一定关系,亦可能与本临床研究样本量较小,经统计学处理后数据可能有偏差有关。
通过比较手术患者在新辅助同步放化疗及围手术期全身化疗不良反应发生情况,试验组中发生1~4级白细胞下降、血小板下降、腹泻、恶心呕吐及发生1~2级肝功能损害、神经系统不良反应较对照组低。这可能由于本研究中将8周期全身化疗在试验组中分割为术前完成4周期及术后完成4周期,而对照组均为术后进行,试验组减少了术后化疗周期数从而降低了因手术并发症或手术恢复不良等原因造成术后全身化疗不良反应增加的影响,并使得全身化疗耐受性更好,从而拒绝或中断全身化疗较少,更易接受计划量全身化疗,试验组接受8周期全身化疗完成率明显高对照组(87.1%vs. 61.5%,P=0.034)。
在本研究中的两组患者手术并发症中术中出血率都高于单纯手术的术中出血率(4.4%)[14],但发生率均低于10%(9.7%和7.7%);伤口延期愈合发生率 < 20%(19.4%和15.4%);两组吻合口瘘发生率分别6.5%及3.8%;上述手术并发症两组差异均无统计学意义。Petrelli等[15]Meta分析研究和Huntington等[16]荟萃研究显示,术前放化疗结束至手术的最佳时间间隔为6~12周,本研究中同步放化疗结束至手术时间间隔试验组为8.1~11.5周,对照组为6.0~8.8周,均在最佳手术时间间隔内。虽然试验组间隔时间较对照组长,但试验组无患者出现新辅助治疗后肿瘤进展,且两组获得手术患者中均无手术切缘阳性。
综上所述,直肠癌术前同步放化疗后加全身化疗与术前同步放化疗均可作为直肠癌术前新辅助治疗方案。术前同步放化疗后加入全身化疗,增加术前治疗强度,适度延长了同步放化疗结束到手术的间隔时间,使得肿瘤的治疗反应性增加,提高pCR率及肿瘤降期率,同时这一新辅助治疗方案并未增加手术难度、风险及手术并发症。尽管术前获得pCR率并不是治疗最终目的,但随着pCR率的提高,期待R0切除率、总生存率的提高,远处转移率下降。本临床研究的结果值得扩大病例数以及长期随访观察进一步证明。
利益冲突 本人、本人家属及其他研究人员在进行该研究时,未因本人执行此研究而获得职务、金钱及其他不正当的财务利益作者贡献声明 李雷蕾负责进行试验、整理数据、数据分析、论文撰写;王文玲负责研究思路、设计研究方案和论文修改;董洪敏负责进行试验、整理数据;王刚负责进行实验、整理数据;罗妍负责整理数据、数据分析;胡银祥、王志勇负责进行试验、收集数据
| [1] | Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. N Engl J Med, 2004, 351 (17): 1731-1740. DOI:10.1056/NEJMoa040694. |
| [2] | Sauer R, Liersch T, Merkel S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer:results of the German CAO/ARO/AIO-94 randomized phase Ⅲ trial after a median follow-up of 11 years[J]. J Clin Oncol, 2012, 30 (16): 1926-1933. DOI:10.1200/JCO.2011.40.1836. |
| [3] | van Gijn W, Marijnen CA, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer:12-year follow-up of the multicentre, randomised controlled TME trial[J]. Lancet Oncol, 2011, 12 (6): 575-582. DOI:10.1016/S1470-2045(11)70097-3. |
| [4] | Rödel C, Liersch T, Hermann RM, et al. Multicenter phase Ⅱ trial of chemoradiation with oxaliplatin for rectal cancer[J]. J Clin Oncol, 2007, 25 (1): 110-117. DOI:10.1200/JCO.2006.08.3675. |
| [5] | Sebagmontefiore D, Rutten H, Rullier E, et al. Three-year survival result of CORE (capecitabine, oxaliplatin, radiotherapy and excision) study after post-operative chemotherapy in patients with locally advanced rectal adenocarcinoma[C/OL]//2009 Gastrointestinal Cancers Symposium, San Francisco, 2009[2016-08-02]. https://biblio.ugent.be/publication/687321. |
| [6] | Garcia-Aguilar J, Chow OS, Smith DD, et al. Effect of adding mFOLFOX6 after neoadjuvant chemoradiation in locally advanced rectal cancer:a multicentre, phase 2 trial[J]. Lancet Oncol, 2015, 16 (8): 957-966. DOI:10.1016/S1470-2045(15)00004-2. |
| [7] | Zampino MG, Magni E, Leonardi MC, et al. Capecitabine initially concomitant to radiotherapy then perioperatively administered in locally advanced rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 75 (2): 421-427. DOI:10.1016/j.ijrobp.2008.11.002. |
| [8] | Bujko K, Nasierowska-Guttmejer A, Wyrwicz L, et al. Neoadjuvant treatment for unresectable rectal cancer:an interim analysis of a multicentre randomized study[J]. Radiother Oncol, 2013, 107 (2): 171-177. DOI:10.1016/j.radonc.2013.03.001. |
| [9] | Roels S, Duthoy W, Haustermans K, et al. Definition and delineation of the clinical target volume for rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2006, 65 (4): 1129-1142. DOI:10.1016/j.ijrobp.2006.02.050. |
| [10] | Martin ST, Heneghan HM, Winter DC. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer[J]. Br J Surg, 2012, 99 (7): 918-928. DOI:10.1002/bjs.8702. |
| [11] | Rödel C, Liersch T, Becker H, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer:initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial[J]. Lancet Oncol, 2012, 13 (7): 679-687. DOI:10.1016/S1470-2045(12)70187-0. |
| [12] | Fernández-Martos C, Pericay C, Aparicio J, et al. Phase Ⅱ, randomized study of concomitant chemoradiotherapy followed by surgery and adjuvant capecitabine plus oxaliplatin (CAPOX) compared with induction CAPOX followed by concomitant chemoradiotherapy and surgery in magnetic resonance imaging-defined, locally advanced rectal cancer:Grupo cancer de recto 3 study[J]. J Clin Oncol, 2010, 28 (5): 859-865. DOI:10.1200/JCO.2009.25.8541. |
| [13] | Gerard JP, Francois Y, Nemoz C, et al. 55 Influence of the interval between pre-operative radiotherapy (preop-XRT) and surgery on the downstaging and sphincter preservation forthe rectal cancer, the lyon R9001 randomized trial[J]. J Thorac Cardiovasc Surg, 1999, 45 (3): 2396 DOI:10.1016/S0360-3016(99)90073-1. |
| [14] | Vermeulen J, Lange JF, van der Harst E. Impaired anastomotic healing after preoperative radiotherapy followed by anterior resection for treatment of rectal carcinoma[J]. S Afr J Surg, 2006, 44 (1): 12, 14-16. |
| [15] | Petrelli F, Sgroi G, Sarti E, et al. Increasing the interval between neoadjuvant chemoradiotherapy and surgery in rectal cancer:a meta-analysis of published studies[J]. Ann Surg, 2016, 263 (3): 458 DOI:10.1097/SLA.00000000000000368. |
| [16] | Huntington CR, Boselli D, Symanowski J, et al. Optimal timing of surgical resection after radiation in locally advanced rectal adenocarcinoma:analysis of the national cancer database[J]. Ann Surg Oncol, 2016, 23 (3): 877-887. DOI:10.1245/s10434-015-4927-z. |
 2017, Vol. 37
2017, Vol. 37


