2. 450052 郑州大学第一附属医院放疗科
2. Department of Radiotherapy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
宫颈癌是常见的妇科恶性肿瘤。在严重威胁妇女健康的各种恶性肿瘤中,宫颈癌的发病率仅次于乳腺癌,位居第2位[1]。放疗是我国宫颈癌治疗的主要手段之一,肿瘤细胞对放射治疗不敏感是导致野内复发的主要原因之一[2]。
细胞周期检测点激酶1(checkpoint kinase 1,Chk1)是生物进化过程中非常保守的一种蛋白激酶。研究表明,Chk1在包括宫颈癌在内的多种恶性肿瘤中的表达水平明显增高,如乳腺癌、前列腺癌、肝癌、食管癌等,且和这些肿瘤的进展和不良临床结局相关[3-4]。有研究发现,沉默Chk1能明显增加宫颈癌HeLa细胞的凋亡,抑制该细胞的增殖,削弱其G2/M期阻滞,但其机制尚不清楚[5]。本研究观察敲除Chk1基因对肿瘤细胞放射敏感性的影响,并初步探讨其可能的机制。
材料与方法1.细胞系和主要试剂:HeLa细胞购自中国科学院(上海)细胞库。细胞培养在含10%胎牛血清(浙江省湖州市天杭生物科技有限公司)的DMEM培养液(美国GIBCO公司)中。Chk1 siRNA (si-Chk1)和阴性对照siRNA (siRNA negative control, si-NC)由上海博亚生物技术公司设计并合成。0.02%EDTA+0.25%胰蛋白酶消化液购自北京索莱宝生物科技有限公司。细胞总RNA提取试剂盒和反转录试剂盒购自宝生物工程(大连)有限公司。Chk1和β-肌动蛋白PCR引物由上海博亚生物技术公司设计并合成。Chk1抗体、P21抗体、Bcl-2抗体、β-肌动蛋白内参抗体和二抗购自美国Cell Signaling Technology公司。ECL显色试剂盒购自美国Pierce公司。BCA蛋白定量试剂盒购自美国Cell Signaling Tec公司。噻唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司。AnnexinV-FITC/PI双染凋亡试剂盒购自美国BD公司。
2.细胞培养和照射条件:使用含10%胎牛血清的完全培养液,培养条件为37℃、5% CO2。采用德国西门子直线加速器6 MV X射线照射,剂量率600 cGy/min,源皮距为100 cm。
3.细胞转染:将处于对数生长期的宫颈癌HeLa细胞用胰蛋白酶消化液消化,稀释成密度约为2.5×105/ml单细胞悬液,然后接种于6孔细胞培养板,每孔加2 ml单细胞悬液。待细胞生长密度达到80%时,按转染试剂说明书进行转染。将si-Chk1片段1、2、3分别转染到HeLa细胞,48 h后,RT-qPCR检测Chk1 mRNA表达水平,Western blot检测Chk1蛋白表达情况,比较3条si-Chk1对Chk1基因的表达抑制效果。
4. RT-qPCR检测转染后Chk1基因mRNA表达水平:在转染48 h后,按总RNA提取试剂盒说明书提细胞总RNA,反转录生成cDNA,在Fast 7500荧光定量扩增仪上进行PCR扩增反应。Chk1 mRNA以β-肌动蛋白为内参基因。引物序列如下:Chk1上游引物5′ CCTTTGTGGAAGACTGGGACT 3′;下游引物5′ GAGGTTATCCCTTTCATCCAAC 3′;β-肌动蛋白上游引物5′ TTGCCGACAGGATGCAGAAG 3′;下游引物5′ GCGCTCAGGAGGAGCAATGA 3′。按照宝生物公司Premix Ex TaqTM(Perfect Real Time) TaqMan试剂盒及ABI Fast 7500荧光定量PCR仪说明书进行扩增。
5. Western blot检测Chk1蛋白表达:分别收集3组细胞,加入RIPA蛋白裂解液裂解细胞,-20℃放置20 min,离心半径15 cm,13 000 r/min离心5 min,收集上清,Bradford法检测蛋白浓度。将等量蛋白样品加入SDS-PAGE胶点样孔内,电泳分离蛋白样品。0.5 g/L脱脂奶粉(TBS溶解)室温封闭1 h后加入稀释的一抗(anti-Chk1按1:500稀释,β-肌动蛋白抗体按1:5 000稀释),4℃孵育过夜,用TBST洗涤3次后加入稀释的二抗,室温孵育2 h。暗室内浸入电化学发光(ECL)液显色,并使胶片曝光。结果采用Quantity One扫描软件分析相对灰度值。
6.细胞活性分析:转染前将细胞接种于6孔板内常规培养。当细胞汇合度达到70%左右时,分别转染si-Chk1和si-NC,孵育24 h。然后将转染的细胞以1×104/孔的浓度接种于96孔板内。12 h后,对细胞进行X射线照射,剂量分别为0、2、4、6、8、10 Gy。继续培养24 h,MTT法检测细胞活性,在多功能酶标仪上测量各孔吸光度(A)值。生长抑制率(IR)=[对照组A值-实验组A值]/对照组A值×100%。
7.流式细胞术检测细胞凋亡率:将si-NC或者si-Chk1转染进HeLa细胞12 h后,分别使用0、2、4、6、8、10 Gy剂量的X射线照射,然后48 h后收集细胞,按AnnexinV-FITC/PI双染凋亡试剂盒说明书操作,利用流式细胞仪检测细胞凋亡情况。
8.克隆形成实验:为了进一步研究Chk1在宫颈癌放射敏感性的作用,将选取的转染效率最高的si-Chk1和si-NC分别转染到宫颈癌HeLa细胞中,然后使用X射线照射,进行克隆形成实验,检测沉默Chk1对宫颈癌细胞放射敏感性的影响。取处于对数生长期的HeLa细胞,消化计数后稀释成一定浓度,向6孔板中种入200个细胞/孔,置于37℃、5% CO2的细胞培养箱中继续培养,24 h后在室温下使用剂量为0、2、4、6、8、10 Gy的X射线照射。继续培养8~14 d,当有细胞集落形成时,使用95%的甲醇固定细胞20 min,结晶紫染色液染色20 min,然后在显微镜下计数超过细胞数为50的克隆个数。接种效率(未照射细胞克隆形成率)=未照射细胞形成的克隆数/接种细胞数。存活分数(SF)=照射后细胞形成克隆数/(细胞接种数×接种效率)。每组分别进行3次独立重复实验。运用GmphPad Prism 5.0软件进行单击多靶模型[SF=1-(1-e-D/D0)N]曲线拟合,求出D0、Dq、SF2、SER。
9.统计学处理:采用SPSS 13.0软件进行分析,符合正态分布的计量资料以x±s表示。两组间比较经正态性检验符合正态分布后采用独立样本t检验。P < 0.05为差异有统计学意义。
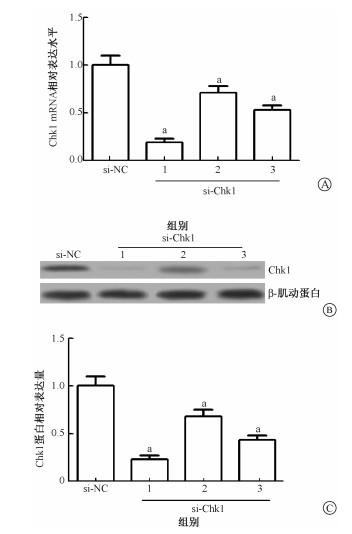
结果1.转染si-Chk1抑制HeLa细胞Chk1 mRNA和蛋白的表达:结果列于图 1。相对于si-NC对照组,si-Chk1组Chk1在mRNA水平和蛋白水平的表达均受抑制(t=2.12~5.86, P < 0.05),但抑制效率不同。后续研究选用抑制效率最高的第1组si-Chk1进行转染。
|
图 1 si-Chk1转染HeLa细胞后Chk1 mRNA和蛋白的表达水平A.转染后Chk1 mRNA相对表达水平;B.转染后Chk1蛋白的相对表达水平;C.转染后Chk1蛋白表达量化图 注:a与si-NC组比较,t=2.12~5.86, P < 0.05 Figure 1 The levels of Chk1 mRNA and protein in HeLa cells transfected with si-Chk1 A. The mRNA expression level of Chk1; B. The protein expression level of Chk1; C. The semi-quantitative analysis of protein level of Chk1 |
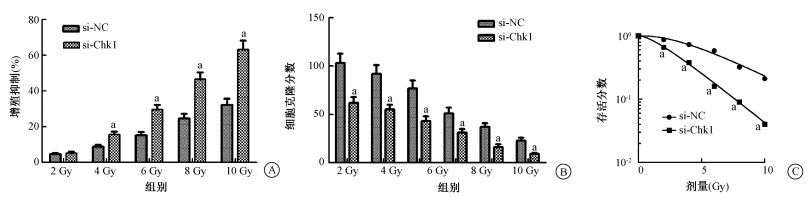
2.沉默Chk1对宫颈癌HeLa细胞放射敏感性的影响:结果列于图 2。与si-NC组比较,4、6、8、10 Gy剂量的X射线照射后,si-Chk1组细胞增殖抑制率明显升高(t=3.15~6.57,P < 0.05)。克隆形成数目显著减少(t=1.58~6.36,P < 0.05),各组间差异有统计学意义。同时,si-Chk1组细胞存活曲线明显下降(t=5.52,P < 0.05)。放射生物学参数见表 1。放射增敏比为1.838(SER, D0值比)。结果表明沉默Chk1能够增强HeLa细胞的放射敏感性。
|
图 2 si-Chk1对HeLa细胞放射敏感性的影响A.不同剂量X射线照射后细胞增殖抑制率;B.不同剂量X射线照射后细胞克隆分数;C.不同剂量X射线照射后细胞存活曲线 注:a与si-NC组比较,t=1.58~6.36,P < 0.05 Figure 2 The effects of si-Chk1 on radiosensitivity of HeLa cells irradiated with different doses of X-rays A. Effect of si-Chk1 on the proliferation; B.Effect of Chk1 on cell clone formation; C. Effect of Chk1 on cell survival |
|
|
表 1 单击多靶模型相关参数 Table 1 The parameters of cell survival curve stimulated with the multi-targets model |
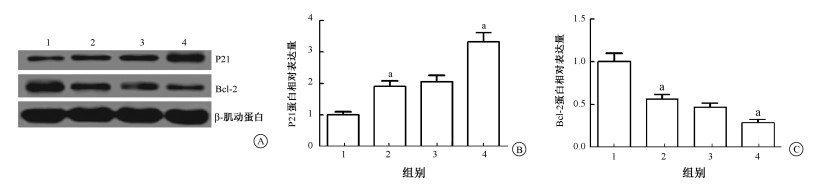
3.沉默Chk1对放疗中P21和Bcl-2蛋白表达的影响:结果列于图 3。与射线联合si-NC相比,射线联合si-Chk1处理组上调P21(t=4.35, P < 0.05)、下调Bcl-2蛋白(t=2.37, P < 0.05)的表达水平。结果表明,沉默Chk1促进放射诱导的宫颈癌细胞凋亡的相关机制可能与上调HeLa细胞中P21、下调Bcl-2蛋白的表达水平有关。
|
图 3 HeLa细胞转染si-Chk1后P21和Bcl-2蛋白的表达A.敲除Chk1和联合射线照射前后P21、Bcl-2蛋白Western blot条带图;B.敲除Chk1和联合射线照射前后P21蛋白表达量化图;C. Bcl-2蛋白表达量化图 注:1.si-NC; 2.si-Chk1; 3.6 Gy+si-NC;4.6 Gy+si-Chk1。a与si-NC组比较,t=2.37~4.35,P < 0.05 Figure 3 The levels of P21 and Bcl-2 protein in HeLa cells transfected with si-Chk1 and its control after 6 Gy irradiation A. The protein bands of P21 and Bcl-2 of Western blot assay; B. The semi-quantitative analysis of protein level of P21; C. The semi-quantitative analysis of protein level of Bcl-2 |
讨论
目前手术和放射治疗是宫颈癌的两大主要治疗手段,放射治疗几乎运用于所有病期的宫颈癌患者。虽然包括手术在内的多种治疗手段提高了早期宫颈癌的治愈率,但局部晚期的患者生存率仍低,中晚期患者的治疗主要是以放射治疗为主的综合治疗,放射治疗已成为治疗宫颈癌的主要治疗手段之一。宫颈癌发生发展的确切机制尚未完全阐明,其治疗效果也有待提高。因此,寻找与宫颈癌发生发展相关的分子生物学指标以及提高化疗和放疗疗效的特异性靶分子,探讨宫颈癌放疗抗拒性的机制,提高宫颈癌放射敏感性具有很重要的现实意义。
Chkl是一种丝氨酸/苏氨酸蛋白激酶,在结构和功能上都很保守[6],其编码的蛋白产物是由476个氨基酸组成的复合物,相对分子质量为54×103,在胚胎的生长发育中起着关键作用[7-8]。Zachos等[9]对敲除Chkl的细胞研究表明,Chkl在DNA损伤所致的G2期和S期阻滞中起到重要作用。而肿瘤细胞逃避凋亡的机制与细胞周期检测点有关。细胞周期检测点在放化疗作用下被激活,导致细胞周期阻滞和细胞的损伤修复,从而使细胞避免凋亡。在各种恶性肿瘤中,癌组织与其周围及正常组织相比,Chkl表达水平明显增高[10-11]。另外有研究发现,Chkl在子宫颈癌患者中的阳性率明显高于在慢性子宫颈炎患者中的阳性率(分别为76.7%和30.0%),表明Chk1在子宫颈癌的表达显著高于慢性子宫颈炎或正常组织,提示Chk1可能在宫颈癌的发生发展中发挥重要的功能[10, 12]。但Chk1通过何种途径诱导凋亡及其在体内的作用,仍需进一步的研究[13]。
本研究结果显示,在转染si-Chk1的宫颈癌HeLa细胞中,Chk1的表达水平明显降低,宫颈癌细胞对X射线的放射敏感性增强,细胞增殖受到抑制且凋亡率增加,细胞克隆能力显著降低。说明沉默Chk1能够增强HeLa细胞对放射治疗的敏感性,提高放射治疗杀伤HeLa细胞的能力。通过siRNA技术沉默Chk1的表达,能够增强宫颈癌HeLa细胞放射敏感性,其机制可能与沉默Chk1而降低Chk1表达水平之后的P21和Bcl-2等蛋白表达变化相关,而Chk1发挥其抗拒宫颈癌HeLa细胞放射敏感性可能是通过降低细胞自我进行DNA损伤修复的能力。由此可见,Chk1可以作为肿瘤放疗增敏的有效靶点。但Chk1在宫颈癌放射抗拒的具体分子机制仍不清楚,需要更进一步的探讨。因此,研究增强宫颈癌放疗敏感性的调节机制,对于改善临床放疗效果以及宫颈癌的个体化治疗,具有重要指导意义。
利益冲突 无作者贡献声明 刘艳杰进行数据统计、文章撰写和修改;顾浩、乔玉环、史惠蓉、张梦真负责实验设计和实施;边爱平、纪妹负责提供试剂和实验材料;郭红军、常青、郭瑞霞负责对文章进行审校
| [1] | Bosch FX, Manos MM, Muñoz N, et al. Prevalence of human papillomavirus in cervical cancer:a worldwide perspective[J]. J Natl Cancer Instit, 1995, 87 (11): 796-802. DOI:10.1093/jnci/87.11.796. |
| [2] | Milosevic MF, Pintilie M, Hedley DW, et al. High tumor interstitial fluid pressure identifies cervical cancer patients with improved survival from radiotherapy plus cisplatin versus radiotherapy alone[J]. Int J Cancer, 2014, 135 (7): 1692-1699. DOI:10.1002/ijc.28403. |
| [3] | Bartek J, Lukas J. Chk1 and Chk2 kinases in checkpoint control and cancer[J]. Cancer Cell, 2003, 3 (5): 421-429. DOI:10.1016/S1535-6108(03)00110-7. |
| [4] | Khanna KK, Jackson SP. DNA double-strand breaks:signaling, repair and the cancer connection[J]. Nat Genet, 2001, 27 (3): 247-254. DOI:10.1038/85798. |
| [5] |
张敏, 王海艳, 黎纬明, 等. CHK1 shRNA对HeLa细胞凋亡和细胞周期的影响[J].
华中科技大学学报医学版, 2008, 37 (3): 351-353. Zhang M, Wang HY, Li WM, et al. The effects of CHK1 shRNA on cell apoptosis and cycle in Hela cells[J]. Acta Med Univ Sci Technol Huazhong, 2008, 37 (3): 351-353. |
| [6] | O'Connell MJ, Raleigh JM, Verkade HM, et al. Chk1 is a wee1 kinase in the G2 DNA damage checkpoint inhibiting cdc2 by Y15 phosphorylation[J]. EMBO J, 1997, 16 (3): 545-554. DOI:10.1093/emboj/16.3.545. |
| [7] | Liu Q, Guntuku S, Cui XS, et al. Chk1 is an essential kinase that is regulated by Atr and required for the G2/M DNA damage checkpoint[J]. Genes Dev, 2000, 14 (12): 1448-1459. DOI:10.1101/gad.14.12.1448. |
| [8] | Bartek J, Lukas J. Chk1 and Chk2 kinases in checkpoint control and cancer[J]. Cancer Cell, 2003, 3 (5): 421-429. DOI:10.1016/S1535-6108(03)00110-7. |
| [9] | Zachos G, Black EJ, Walker M, et al. Chk1 is required for spindle checkpoint function[J]. Dev Cell, 2007, 12 (2): 247-260. DOI:10.1016/j.devcel.2007.01.003. |
| [10] | Xu J, Li Y, Wang F, et al. Suppressed miR-424 expression via upregulation of target gene Chk1 contributes to the progression of cervical cancer[J]. Oncogene, 2013, 32 (8): 976-987. DOI:10.1038/onc.2012.121. |
| [11] | McNeely S, Beckmann R, Bence Lin AK. CHEK again:revisiting the development of CHK1 inhibitors for cancer therapy[J]. Pharmacol Ther, 2014, 142 (1): 1-10. DOI:10.1016/j.pharmthera. |
| [12] | Zhou C, Li G, Zhou J, et al. MiR-107 activates ATR/Chk1 pathway and suppress cervical cancer invasion by targeting MCL1[J]. PLoS One, 2014, 9 (11): e111860 DOI:10.1371/journal.pone.0111860. |
| [13] | Morgan MA, Parsels LA, Zhao L, et al. Mechanism of radiosensitization by the Chk1/2 inhibitor AZD7762 involves abrogation of the G2 checkpoint and inhibition of homologous recombinational DNA repair[J]. Cancer Res, 2010, 70 (12): 4972-4981. DOI:10.1158/0008-5472.CAN-09-3573. |
 2017, Vol. 37
2017, Vol. 37
