2. 266071 青岛市市立医院综合内科
2. Department of General Medicine, Qingdao Municipal Hospital, 266071 Qingdao, China
目前组织间内照射作为治疗非小细胞肺癌(NSCLC)一种辅助性手段,特别是对于经传统放化疗效果不佳、反复复发或心肺功能较差的患者,该方法更是一种较好的选择[1]。1971年,Folkman[2]首次提出肿瘤生长和转移有赖于新生血管生成,抗血管生成能有效遏制肿瘤生长,逐渐成为肿瘤研究的热点。乏氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)在体内显著增加无氧酵解和促进实体瘤内微血管的生成, 是血管内皮生长因子(vascular endothelial growth factor, VEGF)最重要的调控因素。本研究利用A549人肺腺癌细胞系建立肺癌裸鼠模型,在移植瘤内植入不同活度125Ⅰ粒子,观察125Ⅰ粒子组织间内照射对肿瘤血管生成的影响以及瘤体中VEGF和HIF-1α表达的变化,探讨125Ⅰ粒子植入治疗肺癌的生物学机制,为临床更好地使用125Ⅰ粒子植入治疗肿瘤提供理论依据。
材料与方法1.实验动物及材料:雌性BALB/c-nu小鼠24只,无特殊病原体(SPF)级,4~6周龄,体重16~18 g,购自北京华阜康生物科技股份有限公司[合格证号:SCXK (京)2014-0004],饲养于青岛大学医学院动物实验中心SPF级动物房,适应实验室环境1周后用于实验;A549人肺腺癌细胞系购自美国菌种保藏中心(美国ATCC公司);放射性125Ⅰ粒子及空源粒子由北京智博高科生物技术有限公司提供,放射性活度为22.2、29.6和0 MBq (空源粒子)3种,半衰期59.43 d。
2.裸鼠皮下移植瘤模型的建立及处理:A549细胞系,加入含10%胎牛血清、RPMI 1640培养基(美国GIBCO公司),置于37℃、5%CO2培养箱(美国Forma公司)中培养,待细胞铺满80%~90%即传代。取对数生长期细胞,用RPMI 1640培养液调节细胞浓度至1×107/ml,用注射器取0.2 ml细胞悬液接种到裸鼠右背部近头侧皮下。隔日观察移植瘤生长情况,记录成瘤时间。每4 d用游标卡尺测量移植瘤大小,按公式V=L×W2/2(L为最长径,W为与L相垂直的横径)计算移植瘤体积。接种24 d后,当移植瘤平均体积为(300±50) mm3时,采用随机数字表法将24只荷瘤裸鼠分为4组,每组6只,0、22.2、29.6 MBq组和对照组(0 MBq组植入放射活度为0的空源粒子,对照组未作处理)。75%乙醇消毒移植瘤部位皮肤后,用18 G植入针和粒子枪在移植瘤边缘5 mm处将粒子植入瘤体中心部位,每个移植瘤植入粒子1枚。对照组不做任何处理。植入30 d后处死裸鼠,剥取瘤体做后续检测。绘制肿瘤生长曲线,比较各照射组抑瘤情况。
3.免疫组织化学染色检测瘤组织中微血管密度(microvascular density, MVD):取0.5 cm×0.5 cm×0.1 cm大小的瘤组织用4%多聚甲醛(北京碧云天生物技术有限公司)固定,24 h后石蜡包埋,4 μm切片。CD34淋巴细胞抗原(lymphocyte antigen CD34, CD34)是标记血管内皮细胞的抗体,它的表达可以反映瘤组织MVD情况。按免疫组织化学SP法对CD34进行免疫化学分析。一抗为抗CD34的兔抗鼠单克隆抗体(1:100,英国Abcam公司)。脱蜡入水,修复抗原,滴加一抗,4℃过夜,PBS替代一抗为阴性对照。滴加生物素化二抗,DAB显色。采用Image-pro plus 6.0图像分析软件(美国Media Cybernetics公司),在400高倍视野计数。
4. RT-PCR法检测瘤组织中VEGF和HIF-1α的mRNA表达:TRIzol法(美国Invitrogen公司)提取瘤组织RNA;按反转录试剂盒(日本TaKaRa公司)说明书进行cDNA合成。经GenBank查询基因序列,运用Primer Premier 3.0软件(加拿大Premier公司)设计引物:VEGF,上游引物:GGAGCGTTCACTGTGAGC,下游引物:GCGAGTCTGTGTTTTTGC;HIF-1α,上游引物:CTGGAAACGAGTGAAAGG,下游引物:ATGCTAAATCGGAGGGTA;内参:β-肌动蛋白,上游引物:GGCACCACACCTTCTAC,下游引物:CTGGGTCATCTTTTCAC。PCR反应体系为:2×SuperReal PreMix Plus 10 μl,上游引物0.6 μl,下游引物0.6 μl,cDNA 100 ng,50×ROX Reference Dye 0.4 μl,RNase-Free ddH2O至20 μl;反应条件:95℃预变性15 min;95℃、30 s,58℃、30 s,72℃、30 s,共40个循环;PCR产物用1.5%琼脂糖凝胶电泳检测。
5. Western blot法检测瘤组织中VEGF和HIF-1α的蛋白表达:将瘤组织加入裂解液超声粉碎,12 000×g,20 min离心。按BCA试剂盒说明书的方法测定蛋白浓度(北京碧云天生物技术有限公司)。等量蛋白经10%聚丙烯酰胺凝胶电泳转到PVDF膜上,5%脱脂奶粉室温封闭1 h,经兔抗鼠VEGF抗体、HIF-1α抗体(1:1 000,英国Abcam公司)4℃孵育过夜,再与辣根过氧化物酶标记的羊抗兔抗体(1:10 000,天津康为世纪生物技术有限公司)室温孵育1 h,ECL化学发光试剂(北京碧云天生物技术有限公司)显影检测VEGF和HIF-1α抗原。
6.结果判定:瘤组织的MVD检测参照Maeda等[3]标准,低倍镜(×40)下全面观察CD34染色的阳性血管,除外微血管稀少地硬化区、邻近良性组织的区域,选取肿瘤MVD最高及热点区域。随后在高倍视野(×400)下随机选取5个高MVD区域,计数MVC,求其平均值计算MVD (MVD=MVC/面积,每400倍视野面积为0.188 5 mm2,单位个微血管/mm2)。统计微血管的标准:单个的可与周围血管、肿瘤细胞和其他结缔组织区分的棕染内皮细胞或内皮细胞团,均可计数为一个微血管,无论是否形成管腔;肌层较厚或管腔直径>8个红细胞直径的血管均不计数。mRNA相对表达量运用ABI7500软件(美国应用生物系统公司)进行分析,采用2-ΔΔCt法。蛋白表达的半定量分析选用Image J软件(美国国立卫生研究院)。
7.统计学处理:数据用x±s表示。采用SPSS 22.0软件进行分析。方差齐性检验后,组间均数比较采用单因素方差分析,两两比较采用Student-Newman-Keuls检验,相关性采用Spearman直线相关分析。P < 0.05为差异有统计学意义。
结果1.裸鼠肺腺癌移植瘤动物模型:共计接种24只,全部顺利成瘤,成瘤率100%。裸鼠自荷瘤开始至取瘤,均存活,没有发现明显放射诱导损伤。植入粒子全部成功回收,储存在铅盒中进行安全处理。
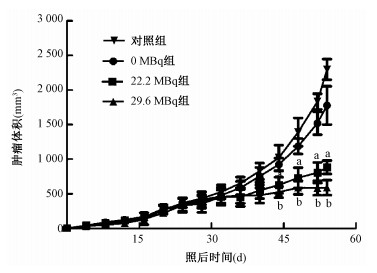
2.粒子植入后的抑瘤效应:裸鼠接种细胞悬液后的移植瘤生长曲线见图 1。粒子植入后3周各组移植瘤体积比较,差异无统计学意义(P>0.05),此后至治疗结束4个时间点,即第44、48、52和54天,各组移植瘤体积间比较差异均有统计学意义(F=10.720、20.083、56.081、62.297,P < 0.05)。治疗结束后粒子植入组瘤体积22.2 MBq组为(886±97) mm3、29.6 MBq组为(590±107) mm3,小于对照组的(2 297±149) mm3,差异有统计学意义(q=14.117、17.075,P<0.05);0 MBq组瘤体积为(1 779±276) mm3,与对照组差异均无统计学意义(P>0.05),22.2 MBq组与29.6 MBq组瘤体积相比,差异均无统计学意义(P>0.05)。表明22.2、29.6 MBq粒子植入组在治疗的第4~5周能有效抑制肿瘤生长。
|
图 1 24只裸鼠移植瘤生长曲线 注:与对照组比较,aq=5.462、7.842、13.067、14.117,P<0.05;bq=6.875、9.536、15.906、17.075,P<0.05 Figure 1 Growth curves of transplanted human lung adenocarcinoma in 24 nude mice |
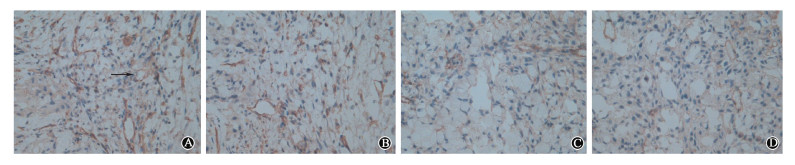
3.免疫组织化学SP法检测瘤组织的MVD:各组之间MVD差异有统计学意义(F=7.607,P < 0.05),22.2 MBq组CD34阳性染色的MVD为522±119,29.6 MBq组为491±121,比对照组的922±260明显降低(q=4.826、5.197,P < 0.05),而0 MBq组与对照组、22.2 MBq组与29.6 MBq组之间差异均无统计学意义(P>0.05,图 2)
|
图 2 24只裸鼠移植瘤免疫组织化学CD34染色结果SP染色×400 A.对照组;B. 0 MBq组;C. 22.2 MBq组;D. 29.6 MBq组 注:箭头所示为CD34染色阳性血管 Figure 2 Immunohistochemical CD34-positive staining of tumor tissue slices SP×400 A. Control group; B. 0 MBq group; C. 22.2 MBq group; D. 22.2 MBq group |
4.移植瘤中VEGF和HIF-1α的mRNA表达情况:RT-PCR检测表明,各组间VEGF和HIF-1α的mRNA的表达差异有统计学意义(F=101.058、59.014,P < 0.05)。22.2 MBq组和29.6 MBq组VEGF和HIF-1α的mRNA表达均明显下降,与对照组比较,差异有统计学意义(qVEGF=18.881、17.211,qHIF-1α=15.376、14.733,P<0.05)。0 MBq组与对照组的VEGF和HIF-1α的mRNA表达差异均无统计学意义(P>0.05),22.2 MBq组与29.6 MBq组的VEGF和HIF-1α的mRNA表达差异均无统计学意义(P>0.05,表 1)。
|
|
表 1 24只裸鼠移植瘤VEGF和HIF-1α的mRNA相对表达量(x±s) Table 1 Relative expression levels of HIF-1α and VEGF mRNA in the transplanted tumors in 24 nude mice (x±s) |
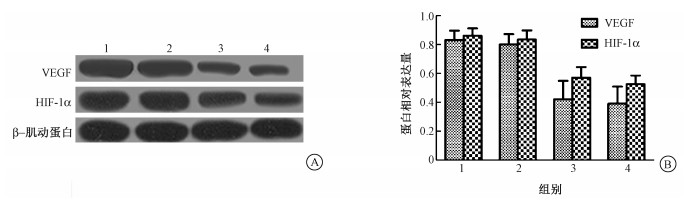
5.移植瘤VEGF和HIF-1α蛋白表达:两种蛋白在各组移植瘤中的表达见图 3,各组之间差异均有统计学意义(F=11.400、15.530,P < 0.05);22.2 MBq组与29.6 MBq组瘤组织VEGF和HIF-1α蛋白表达均明显减少,与对照组比较,差异有统计学意义(qVEGF=5.848、6.263,qHIF-1α=6.560、7.576,P<0.05),但0 MBq组与对照组的VEGF和HIF-1α蛋白表达差异均无统计学意义(P>0.05),22.2 MBq组和29.6 MBq组的VEGF和HIF-1α蛋白表达差异均无统计学意义(P>0.05)。
|
图 3 24只裸鼠移植瘤VEGF和HIF-1α的蛋白检测结果A.蛋白印迹法对各组VEGF和HIF-1α蛋白表达进行检测;B.各组VEGF/β-肌动蛋白、HIF-1α/β-肌动蛋白灰度值比较 注:1.对照组;2.0 MBq组;3.22.2 MBq组;4.29.6 MBq组 Figure 3 Protein expressions of HIF-1α and VEGF in the transplanted tumors in 24 nude mice A. Western blotting images of VEGF and HIF-1α proteins in each group; B. Semi-quantitative analysis of HIF-1α and VEGF protein band optical densities HIF-1α and VEGF level were normalized to corresponding β-actin level |
6.裸鼠瘤组织中VEGF和HIF-1α的mRNA、蛋白表达的相关性:裸鼠瘤组织中VEGF和HIF-1α的mRNA表达均呈正相关关系(r=0.709,P < 0.05);VEGF与HIF-1α蛋白表达正相关(r=1.000,P < 0.05)。这表明VEGF和HIF-1α的表达可能存在某种正相关关系。
讨论早在1940年,放射性粒子植入就被用于治疗无法手术切除的NSCLC[4]。与外放疗相比,125Ⅰ粒子植入治疗持续低剂量照射,使乏氧细胞再氧合从而降低放射拮抗性,还有高度适形、并发症较少等特点。由于125Ⅰ粒子植入突出的生物学优势,已越来越广泛的应用于前列腺癌、肺癌、胰腺癌、宫颈癌和头颈部恶性肿瘤等的治疗,并取得良好的治疗效果[5-6]。目前对125Ⅰ粒子植入治疗肿瘤的研究多集中于对肿瘤细胞凋亡的影响[7-8]。本研究的创新处在于探讨125Ⅰ粒子对肿瘤组织微血管的影响。
临床上应用的125Ⅰ粒子放射活度为22.2~29.6 MBq,初始剂量率为7~8 cGy/h,生物等效剂量约为160 Gy[9]。本研究采用22.2和29.6 MBq两种活度125Ⅰ粒子及空源粒子分别种植于体积(300±50) mm3的人肺腺癌裸鼠移植瘤。结果发现植入治疗后3周各组移植瘤体积差异无统计学意义,但从第21天至第31天治疗结束22.2和29.6 MBq活度125Ⅰ粒子植入均能减缓肿瘤增长,但两者比较差异无统计学意义。推测125Ⅰ粒子初始剂量较低,并不能迅速使肿瘤出现生物效应,肿瘤组织水肿也可抵消部分抑瘤作用,不过125I半衰期长,随着治疗时间延长,粒子植入引起的水肿消退而肿瘤吸收剂量增加,抑瘤效应显现出来。不同放射性粒子混合应用确保放疗效果的持续性,同时又有较高的初始放射剂量,值得后续探讨[10]。
肿瘤微血管生成为肿瘤生长提供了必须的营养物质和氧气,同时也是肿瘤细胞侵袭、转移的必要条件[11]。MVD已成为评估血管生成的“金标准”,既可反映血管生成程度,也可作为反映肺癌预后的独立指标[12]。本研究应用可以反映瘤组织MVD情况的CD34标记血管内皮细胞,显示肿瘤微血管并对其进行定量分析,结果发现22.2和29.6 MBq组治疗后瘤组织的MVD明显降低,且两组瘤组织MVD的差异无统计学意义。表明125Ⅰ粒子能显著抑制肿瘤微血管的形成。与Hu等[13]实验结果一致。VEGF是目前已知最强、特异性最高的促血管生成因子,与肺癌的发生、转移和预后紧密相关;缺氧是促使肿瘤细胞生长、凋亡、转移等的关键因素,HIF-1α是肿瘤细胞适应缺氧微环境的中心环节,可上调多种靶基因的表达,促使肿瘤对相对缺氧的肿瘤微环境产生适应性改变[14]。Koshikawa等[15]研究显示,在转移性肺癌细胞中,HIF-1α还可上调其靶基因VEGF,诱导VEGF表达而促进肿瘤血管生成,成为肿瘤血管生成潜在的促进剂。倪嘉延等[16]研究显示,在缺氧条件下,用构建的HIF-1α siRNA表达载体转染肝癌细胞,细胞中缺氧状态下诱导的VEGF表达显著减少。为探讨125Ⅰ粒子抑制肺腺癌移植瘤微血管生成的机制,本研究结果显示,22.2和29.6MBq组VEGF与HIF-1α均较对照组降低,且呈正相关关系,初步证实125Ⅰ粒子植入是通过抑制VEGF与HIF-1α的表达阻断微血管生成,两者发挥协同作用。有关VEGF与HIF-1α参与肿瘤微血管生成的机制可能为随着瘤体不断增大,血供不足而缺氧坏死,HIF-1α被诱导过度表达,进而HIF-1α下游重要的靶基因VEGF表达增强,从而激活一系列信号通路刺激血管生成;125Ⅰ粒子放射治疗可阻断这一过程。
本实验通过构建人肺腺癌移植瘤动物模型,成功模拟了125Ⅰ粒子对肺癌的治疗作用,初步证实125Ⅰ粒子可以抑制肺腺癌移植瘤微血管生成,进而抑制肿瘤生长,具体机制与瘤组织VEGF和HIF-1α表达减少有关;对于具体信号通路的作用,将进一步研究,为125Ⅰ粒子临床应用提供更坚实的理论依据。
利益冲突 本人与其他作者以及基金无任何利益冲突作者贡献声明 向桂玲、林存智负责论文的设计、撰写;朱新红、修麓璐、孙勇负责论文实验的操作、数据的统计和分析;丁晓倩、王芳芳负责论文的修改
| [1] | Wang ZM, Lu J, Liu T, et al. CT-guided interstitial brachytherapy of inoperable non-small cell lung cancer[J]. Lung Cancer, 2011, 74 (2): 253-257. DOI:10.1016/j.lungcan.2011.03.00610.1016/j.lungcan.2011.03.006. |
| [2] | Folkman J. Tumor angiogenesis:therapeutic implications[J]. N Engl J Med, 1971, 285 (21): 1182-1186. DOI:10.1056/NEJM197111182852108. |
| [3] | Maeda K, Chung YS, Takatsuka S, et al. Tumour angiogenesis and tumour cell proliferation as prognostic indicators in gastric carcinoma[J]. Br J Cancer, 1995, 72 (2): 319-323. DOI:10.1038/bjc.1995.331. |
| [4] | Peretz T, Nori D, Hilaris B, et al. Treatment of primary unresectable carcinoma of the pancreas with I-125 implantation[J]. Int J Radiat Oncol Biol Phys, 1989, 17 (5): 931-935. DOI:10.1016/0360-3016(89)90138-7. |
| [5] | Wang Z, Zhao Z, Lu J, et al. A comparison of the biological effects of 125I seeds continuous low-dose-rate radiation and 60Co high-dose-rate gamma radiation on non-small cell lung cancer cells[J]. PLoS One, 2015, 10 (8): e0133728 DOI:10.1371/journal.pone.013372810.1371/journal.pone.0133728. |
| [6] | Li HX, Zhao J, Shen K, et al. Comparison of Iodine-125 seeds implantation and afterloading radiotherapy in murine models of human cervical cancer[J]. Arch Gynecol Obstet, 2014, 289 (5): 1101-1106. DOI:10.1007/s00404-013-3107-2. |
| [7] | Takabayashi K, Kashiwagi K, Kawata T, et al. Continuous low-dose irradiation by I-125 seeds induces apoptosis of gastric cancer cells regardless of histological origin[J]. Cancer Biol Ther, 2014, 15 (1): 81-88. DOI:10.4161/cbt.2661010.4161/cbt.26610. |
| [8] | Ma JX, Jin ZD, Si PR, et al. Continuous and low-energy 125I seed irradiation changes DNA methyltransferases expression patterns and inhibits pancreatic cancer tumor growth[J]. J Exper Clin Cancer Res, 2011, 4 (2): 30-35. DOI:10.1186/1756-9966-30-35. |
| [9] | Raben A, Mychalczak B. Brachytherapy for non-small cell lung cancer and selected neoplasms of the chest[J]. Chest, 1997, 112 (4 Suppl): 276S-286S. DOI:10.1378/chest.112.4_Supplement.276S. |
| [10] | Chen Z, Nath R. Biologically effective dose (BED) for interstitial seed implants containing a mixture of radionuclides with different half-lives[J]. Int J Radiat Oncol Biol Phys, 2003, 55 (3): 825-834. DOI:10.1016/S0360-3016(02)04282-7. |
| [11] | Rafii S, Lyden D, Benezra R, et al. Vascular and haematopoietic stem cells:novel targets for anti-angiogenesis therapy?[J]. Nat Rev Cancer, 2002, 2 (11): 826-835. DOI:10.1038/nrc925. |
| [12] | Erdem O, Erdem M, Erdem A, et al. Expression of vascular endothelial growth factor and assessment of microvascular density with CD 34 and endoglin in proliferative endometrium, endometrial hyperplasia, and endometrial carcinoma[J]. Int J Gynecol Cancer, 2007, 17 (6): 1327-1332. DOI:10.1111/j.1525-1438.2007.00942.x. |
| [13] | Hu S, Huang W, Chen Y, et al. Spectral CT evaluation of interstitial brachytherapy in pancreatic carcinoma xenografts:preliminary animal experience[J]. Eur Radiol, 2014, 24 (9): 2167-2173. DOI:10.1007/s00330-014-3257-z. |
| [14] | Thangarajah H, Yao D, Chang EI, et al. The molecular basis for impaired hypoxia-induced VEGF expression in diabetic tissues[J]. Proc Natl Acad Sci USA, 2009, 106 (32): 13505-13510. DOI:10.1073/pnas.0906670106. |
| [15] | Koshikawa N, Iyozumi A, Gassmann M, et al. Constitutive upregulation of hypoxia-inducible factor-1alpha mRNA occurring in highly metastatic lung carcinoma cells leads to vascular endothelial growth factor overexpression upon hypoxic exposure[J]. Oncogene, 2003, 22 (43): 6717-6724. DOI:10.1038/sj.onc.1206765. |
| [16] |
倪嘉延, 吴裕丹, 黄康华, 等. HIF-1α基因干扰对大鼠CBRH-7919肝癌细胞HIF-1α与VEGF表达影响的研究[J].
中华肿瘤防治杂志, 2012, 19 (22): 1704-1708. Ni JY, Wu YD, Huang KH, et al. Effects of HIF-1α siRNA interference on expressions of HIF-1α and VEGF in rat CBRH-7919 hepatomacells[J]. Chin J Oncol Prev Tre, 2012, 19 (22): 1704-1708. DOI:10.16073/j.cnki.cjcpt.2012.22.015. |
 2017, Vol. 37
2017, Vol. 37


