2. 130041 长春, 吉林大学第二医院放射线科
2. Department of Radiology, The Second Hospital of Jilin University, Changchun 130041, China
肺癌的死亡率居所有癌症死亡率的首位,而放疗是肺部肿瘤治疗的主要手段之一[1]。研究表明,提高局部照射剂量能够增加患者的存活率,但同时照射诱导激活细胞炎性因子网络,引发局部炎症反应,导致放射性肺炎和放射性肺纤维化的发生;而限制放疗剂量,则会降低治疗效果[2]。目前的研究发现,肿瘤微环境通过介导复杂的通路在肿瘤发展的不同阶段均起到决定性的作用[3]。因此,研究肿瘤微环境中各种因子的相互调节机制对今后肿瘤治疗具有重要意义。最近有研究报道,肿瘤细胞表面高表达神经纤维蛋白1(neuropilin 1, NRP1)能与TGF-β、LAP或LAP-TGF-β相结合,使得下游信号分子Smad增强,刺激血管生成,抑制肿瘤免疫,促进细胞外基质的形成,调节肿瘤微环境,促进肿瘤的生长等作用[4]。在辐射抗性方面,NRP1通过与血管内皮生长因子(VEGF)、信号素(Sema)和其他多种因子间相互作用影响肿瘤细胞的辐射抗性。可见NRP1从最初的神经系统方面的研究,至今已发展到与肿瘤发生发展、免疫功能和造血功能等多领域。因此,本实验采用三维细胞培养技术及建立两种细胞的三维共培养体系等手段,观察NRP1对肺癌细胞炎性微环境和迁移微环境的影响,并阐明其辐射抗性中的作用机制。
材料与方法1.细胞与试剂:肺腺癌细胞系A549、急性T细胞白血病细胞系Jurkat及人胚肺成纤维细胞系HLF-1均购自于中国科学院上海细胞库。DMEM高糖型培养基、RPMI 1640、胎牛血清购自美国GIBCO公司,青霉素与链霉素购自美国Invitrogen公司,Matrigel基质胶、流式液相多重蛋白定量检测(CBA)试剂盒购自美国BD Biosciences公司。
2.二维细胞培养:使用含10%胎牛血清的DMEM培养基,将A549细胞、HLF-1细胞分别接种至细胞培养瓶,使用含10%胎牛血清的RPMI 1640培养基,将Jurkat细胞接种至细胞培养瓶,于37℃、5%CO2细胞培养箱中培养。待细胞融合至80%以上时,0.25%胰酶消化细胞,用磷酸盐缓冲液(PBS)洗涤2次用于进行下一步实验。
3. NRP1低表达A549细胞模型(NRP1LowA549)和A549辐射抗性细胞模型(A549-RR)构建及验证:采用反转录病毒方法,构建NRP1干扰的A549细胞株(简称NRP1LowA549细胞)。将pSR-shNRP1-1质粒转染至A549细胞。经药物进行筛选一周,存活的细胞即为转染成功的细胞。通过qRT-PCR检测转染后细胞NRP1 mRNA的表达量,Western blot检测NRP1蛋白的表达量。同时,通过多次大剂量照射构建辐射抗性细胞(A549-RR细胞),即给予6 Gy X射线照射,重复5次,使照射总剂量达30 Gy。最后一次照射后所形成的克隆细胞即为辐射抗性细胞。通过检测10 GyX射线照射后细胞增殖率、集落形成率的变化进一步验证模型是否成功,并检测A549-RR细胞NRP1的表达水平。
4.三维细胞培养:Matrigel母液浓度10.6 mg/ml,置4℃过夜溶解。取处于指数生长期的二维培养细胞,0.25%胰酶消化,调整细胞密度为1×106/ml,在冰浴条件下与Matrigel等体积混匀,快速接种于24孔板内,每孔加入200 μl,37℃孵育30 min后成胶,添加完全培养液1 ml。置于37℃、5%CO2细胞培养箱中培养,第2天换液,备用于下一步实验。
5.照射条件:采用X-RAD320生物辐照仪(美国PXI公司),0.18 MV X射线,源靶距70 cm,吸收剂量率1.0 Gy/min,单次照射剂量为10 Gy。
6.三维共培养体系的建立:按上述方法在24孔板中分别接种人肺腺癌细胞系A549、A549-RR及NRP1LowA549(每孔2×105),按1:5的比例接种Jurkat细胞(每孔1×106),即A549与Jurkat共培养组、A549-RR与Jurkat共培养组和NRP1LowA549与Jurkat共培养组;按1:1的比例接种HLF-1细胞(每孔2×105),即A549与HLF-1共培养组、A549-RR与HLF-1共培养组和NRP1LowA549与HLF-1共培养组。三维共培养48 h后,给予10 Gy照射,继续培养24 h后收集细胞上清液,用于下一步实验。
7.流式液相多重蛋白定量检测(cytometric bead array, CBA):将收集的细胞上清液1 500 r/min,离心半径10 cm,离心5 min后提取上清液。按CBA试剂盒说明书配置细胞因子标准品,并进行梯度稀释,并将细胞因子捕获微球进行预混,每个实验中加入50 μl微球混合液,标准品管中每管加入50 μl标准液,样品管中每管加入50 μl样品,然后于所有实验管中加入50 μl藻红蛋白检测试剂,室温下避光孵育3 h,用1 ml洗涤缓冲液进行洗涤,200×g离心5 min后弃上清,每管加300 μl洗涤缓冲液重悬微球,后用美国BD公司FACS Calibur流式细胞仪进行检测,利用FCAP Array软件进行数据分析。
8.统计学处理:采用SPSS 18.0软件进行数据分析,CBA检测结果以x±s表示。同一细胞因子不同组间比较方差齐性检验后采用方差分析,同一细胞因子两组间比较,经正态性检验后符合正态分布,采用独立样本t检验。P<0.05为差异有统计学意义。
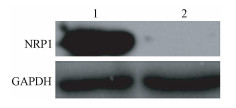
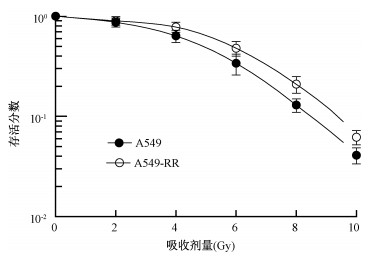
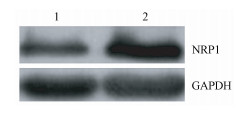
结果1. NRP1干扰的A549细胞模型和A549细胞辐射抗性模型的建立:结果如图 1所示。转染后细胞NRP1在蛋白水平明显降低,提示干扰效果明显,且mRNA水平验证结果同样显示NRP1表达降低80%(t=42.56,P < 0.01),由此可见NRP1LowA549细胞模型的构建成功。同时在A549细胞辐射抗性模型构建成功后,利用电离辐射作用A549-RR和A549细胞后细胞存活均率均有下降,但A549细胞下降更明显约36%(t=30.96,P < 0.05),A549-RR细胞下降约17%(t=10.32,P < 0.05),而A549-RR细胞具有更强的细胞存活能力(图 2),且A549-RR细胞NRP1的表达量高于亲本细胞(图 3)。以上结果初步证实A549-RR模型构建成功。
|
图 1 转染pSR-shNRP1-1质粒后A549细胞NRP1表达的情况 注:1.对照组;2. NRP1LowA549组 Figure 1 Alteration of NRP1 expression in A549 cells after transfection of plasmid pSR-shNRP1-1 |
|
图 2 X射线对A549-RR细胞存活分数的影响 Figure 2 Effect of X-ray irradiation on survival fraction of A549-RR cells |
|
图 3 X射线对A549-RR细胞中NRP1表达水平的影响 注:1.对照组;2. A549-RR组 Figure 3 The effect of X-ray irradiation on the expression of NRP1 in A549-RR cells |
2. NRP1对肺癌炎性微环境中细胞因子分泌量的影响:在三维共培养体系下肿瘤炎性微环境中炎性因子含量变化如表 1。可见,与A549+Jurkat组相比,IL-1β、肿瘤坏死因子(TNF)在A549-RR+Jurkat组中均表达降低(t=3.88、5.34,P<0.05),而经照射后表达明显高于对照组(t=8.49、5.92,P<0.05),且明显高于A549+Jurkat照射组(t=11.23、4.34,P < 0.05)。而IL-6、IL-8在A549-RR+Jurkat组中与A549+Jurkat组相比表达明显升高(t=38.30、30.02,P<0.05),经照射后表达明显降低(t=14.39、9.78,P<0.05),但仍然高于A549+Jurkat照射组(t=24.57、16.16,P < 0.05)。而在A549+Jurkat组及NRP1LowA549+Jurkat组中经照射后与对照组相比却显著升高(t=5.73、5.56、4.87、5.02,P<0.05)。IL-1β和IL-10表达量在各组中经照射后与对照组相比均有不同程度的降低,且差异有统计学意义(t=9.78、4.38、2.80、11.22、3.47,P<0.05)。
|
|
表 1 NRP1对肺癌炎性微环境中各种细胞因子分泌量变化的影响(pg/ml, x±s) Table 1 The effect of NRP1 on the secretion of various cytokines in inflammatory microenvironment of lung cancer (pg/ml, x±s) |
3. NRP1对肺癌迁移微环境中趋化因子分泌量的影响:在三维共培养体系下肿瘤迁移微环境中趋化因子含量变化如表 2。发现与A549+HLF-1组相比RANTES、MCP-1在NRP1LowA549+HLF-1组中,均呈现表达升高(t=6.07、4.04,P<0.05),在A549-RR+HLF-1组中表达明显降低(t=15.50、14.62,P<0.05)的趋势。经照射后RANTES、MCP-1在各组中与对照组相比, 均不同程度降低(t=2.23、8.45、16.68,P<0.05),而RANTES在A549+HLF-1组中经照射后表达明显升高(t=18.04,P<0.05)。与其不同的是,IP-10、CXCL8(IL-8)在其他各组中表达量均低于A549+HLF-1组,且在NRP1LowA549+HLF-1组中降幅最大(t=31.86、29.79、6.62、3.85,P<0.05)。经照射后与对照组相比,只有CXCL8在NRP1LowA549+HLF-1组中经照射后明显升高(t=4.47,P<0.05),而在其他各组中IP-10、CXCL8表达量均不同程度下降。
|
|
表 2 NRP1对肺癌迁移微环境中各种细胞因子分泌量变化的影响(pg/ml, x±s) Table 2 The effect of NRP1 on the secretion of various cytokines in migration microenvironment of lung cancer (pg/ml, x±s) |
讨论
随着科学技术的发展,人们逐渐认识到细胞的生长、分化、增殖及凋亡等一系列生命活动均受到细胞外微环境的影响。而肿瘤微环境又是一个复杂系统,它由许多的基质细胞及充斥于其中的细胞因子组成,其通过介导复杂的信号通路,诱导多种促炎症因子、趋化因子和血管生成因子等表达情况,进一步加速肿瘤的发展进程[5-6]。因此,已有多项研究通过将肿瘤细胞与免疫细胞或成纤维细胞等,以共培养的形式来构建肿瘤炎性或迁移微环境,来进一步研究肿瘤微环境对肿瘤发展进程的影响[7-8]。Alonso-Nocelo等[9]通过将A549细胞与Jurkat细胞通过三维共培养的方式,研究肿瘤相关炎症反应及肿瘤炎性微环境对肿瘤进程及药物治疗的影响。如今,三维立体肿瘤细胞培养因能较好地模拟体内肿瘤细胞生长的微环境和三维空间结构,已作为既往研究单层培养系统与整体组织器官间联系的桥梁。
神经纤毛蛋白1作为一种多效性受体可以与多个配体及其受体相互作用,在胚胎、内脏器官及神经系统发育、血管生成、免疫反应和肿瘤发生发展等进程中发挥着重要作用。在辐射抗性方面,Dong等[10]发现,与其他细胞系相比,电离辐射对A549细胞的增殖抑制作用较弱,表明其具有较强的辐射抗性,且在其构建A549-RR模型中发现,NRP1表达水平明显高于A549细胞,即在A549-RR细胞中NRP1呈高表达状态。因此,本实验主要从肿瘤炎性微环境、肿瘤迁移微环境两个方面入手,通过构建相应三维共培养模型,经电离辐射作用后通过CBA技术进行准确检测,进一步研究肿瘤微环境在NRP1诱导辐射抗性中的作用机制。
在肿瘤炎性微环境方面,肿瘤坏死因子TNF作为一个重要的免疫调节因子,它具有直接细胞毒性或抑制肿瘤细胞的作用。夏晖等[11]研究结果表明,TNF可能通过与肿瘤细胞表面特异性受体结合, 影响P53蛋白的表达, 从而影响细胞增殖和凋亡的过程,发挥细胞毒作用,进而杀灭肿瘤细胞起到抗肿瘤的作用。有研究证实,VEGF与其受体NRP1结合可介导细胞存活信号系统;同时发现VEGF165与VEGF121可通过NRP1等受体抑制鳞状细胞癌因照射所致的细胞凋亡,并能促进肿瘤细胞的增殖。以此可见NRP1与TNF生物学作用相反,且与试验结果相似,NRP1高表达状态的A549-RR+Jurkat组中,TNF分泌明显受到抑制,而在NRP1低表达时TNF分泌量明显升高。提示在肿瘤炎性微环境中,NRP1能有效抑制TNF的分泌。也有研究表明,TNF经辐射损伤后在蛋白水平高于对照组,且随着照射剂量的增加,TNF表达逐渐增高[12]。与本研究结果相同,经照射后A549-RR+Jurkat组中表达明显升高且高于A549+Jurkat组,由此可见在NRP1诱导辐射抗性中TNF以高表达的状态,对辐射抗性的产生起协同作用。同样在肿瘤炎性微环境中STAT3可被IL-6等活化,诱导编码大量与炎症相关的基因表达,促进血管形成,进而影响肿瘤细胞的增殖[13]。李峰生等[14]研究结果表明,辐射通过促进A549细胞中IL-6的分泌,激活IL-6/JAK-2/STAT3信号通路,导致MMP-2表达升高,后者最终导致A549细胞的侵袭能力增强。本研究结果显示,IL-6在A549+Jurkat组及NRP1Low A549+Jurkat组中照射后表达量均有所升高,可能是由于在辐射作用下刺激肿瘤微环境的中IL-6分泌,因而对免疫耐受起重要作用。在辐射损伤的修复方面IL-8同样也发挥着重要作用。Tamatani等[15]在对人口腔癌细胞的研究中发现辐射能通过NF-κB的激活上调IL-8的表达。抑制NF-κB的活性,可以减少包括IL-8在内的各种炎性因子的表达,提高肿瘤的放射敏感性。有研究证实,IL-6、IL-8在电离辐射作用后表达明显升高,进而影响肿瘤炎性微环境[16]。同样本实验结果显示,当在A549-RR+Jurkat组与NRP1LowA549+Jurkat组中经照射后与对照组相比IL-6、IL-8表达升高。但当NRP1高表达时,经照射后IL-6、IL-8表达降低。表明在辐射作用下NRP1通过调控IL-6、IL-8和TNF等炎性因子来增强A549细胞的辐射抗性。
在肿瘤迁移微环境方面,MCP-1/CCL2是具有重要生理作用的趋化因子。有研究报道,MCP-1具有促进血管生成的生物学效应。一方面,MCP-1趋化TAM进入肿瘤组织,分泌VEGF、TGF-β等血管生成因子和ELR+CXC类趋化因子,间接刺激新生血管生成;另一方面,MCP-1直接作用于血管内皮细胞膜上的CCR2受体,趋化内皮定向细胞运动[17]。也有研究表明,小鼠在糖尿病状态下, 低剂量电离辐射能有效降低血清中MCP-1的表达水平, 缓解糖尿病肾脏中的炎症反应强度[18]。本研究结果显示,在NRP1高表达状态下,肿瘤微环境中MCP-1明显受到抑制,具体机制可能与NRP1参与抑制相关免疫调节因子有关,且在各组中经电离辐射作用后,分泌量均有所降低,这可能与降低炎症反应强度进而增加辐射抗性有关。CCL5/RANTES作为一种炎症趋化因子是众所周知的,最近研究发现,CCL5表达的增多可以增强人肺癌细胞的迁移能力。其机制可能是通过激活磷脂酰肌醇3-激酶(PI3K)、Akt、IKKα/β、NF-κB等信号通路介导的[19]。也有研究发现,CCL2、CCL5等TAFs分泌的趋化因子通过激活TGF-β和Hedgehog通路促进肿瘤细胞恶性转化[20]。结合本研究结果,发现NRP1对RANTES分泌具有抑制作用,且经过照射后分泌量降低,这可能与NRP1参与调控肿瘤迁移微环境中相关趋化因子表达,进而影响相关信号通路来对肿瘤发展及转移产生重要影响,以此应对辐射产生损伤。有研究表明,IP-10对TME中NK细胞迁移和黏附功能的影响[21]。多项研究显示,CXCL8和IP-10在肿瘤迁移为环境中发挥抗肿瘤作用[22-23]。本研究结果中也印证了这一点,发现两种因子在A549-RR+HLF-1组中明显低于A549+HLF-1组,且经照射后表达降低。因此,提示在高表达NRP1诱导辐射抗性同时,也调控肿瘤迁移微环境中相关趋化因子分泌,如IP-10及CXCL8因子等。
综上所述,NRP1通过对肺癌微环境中炎性因子TNF、IL-10、IL-6和IL-8以及迁移相关趋化因子IP-10、MCP-1/CCL2和RANTES/CCL5分泌的影响,进而影响肿瘤微环境相关组份,因此,在NRP1诱导辐射抗性中产生重要作用。
利益冲突 本研究接受吉林大学研究生创新基金项目(2016220)资助,本人及本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证。本文全体作者声明不存在任何利益冲突作者贡献声明 董卓负责实验操作及论文撰写;宫新扣、吕亚慧负责细胞照射;于多、郭新圆、刘一婷、邵立虹负责细胞培养;魏威、高辉负责数据统计分析;金顺子负责总体实验安排、论文撰写指导
| [1] | Shi JG, Shao HJ, Jiang FE, et al. Role of radiation therapy in lung cancer management-a review[J]. Eur Rev Med Pharmacol Sci, 2016, 20 (15): 3217-3222. |
| [2] | Oehler C, Dickinson DJ, Broggini-Tenzer A, et al. Current concepts for the combined treatment modality of ionizing radiation with anticancer agents[J]. Curr Pharm Des, 2007, 13 (5): 519-535. DOI:10.2174/138161207780162935. |
| [3] | Jayappa KD, Kovi RC, Chatterjee S. Interplay between tumor microenvironment and cancer cells[J]. Biomed Res Int, 2016, 2016 : 4650498 DOI:10.1155/2016/4650498. |
| [4] | Prud'homme GJ, Glinka Y. Neuropilins are multifunctional coreceptors involved in tumor initiation, growth, metastasis and immunity[J]. Oncotarget, 2012, 3 (9): 921-939. DOI:10.18632/oncotarget.626. |
| [5] | Sung SY, Hsieh CL, Wu D, et al. Tumor microenvironment promotes cancer progression, metastasis, and therapeutic resistance[J]. Curr Probl Cancer, 2007, 31 (2): 36-100. DOI:10.1016/j.currproblcancer.2006.12.002. |
| [6] | Maletzki C, Emmrich J. Inflammation and immunity in the tumor environment[J]. Dig Dis, 2010, 28 (4-5): 574-578. DOI:10.1159/000321062. |
| [7] | Jeong SY, Lee JH, Shin Y, et al. Co-culture of tumor spheroids and fibroblasts in a collagen matrix-incorporated microfluidic chip mimics reciprocal activation in solid tumor microenvironment[J]. PLoS One, 2016, 11 (7): e0159013 DOI:10.1371/journal.pone.0159013. |
| [8] | Salvatore V, Teti G, Bolzani S, et al. Simulating tumor microenvironment:changes in protein expression in an in vitro co-culture system[J]. Cancer Cell Int, 2014, 14 (1): 2504-2511. DOI:10.1186/1475-2867-14-40. |
| [9] | Alonso-Nocelo M, Abuín C, López-López R, et al. Development and characterization of a three-dimensional co-culture model of tumor T cell infiltration[J]. Biofabrication, 2016, 8 (2): 025002 DOI:10.1088/1758-5090/8/2/025002. |
| [10] | Dong JC, Gao H, Zuo SY, et al. Neuropilin 1 expression correlates with the radio-resistance of human non-small-cell lung cancer cells[J]. J Cell Mol Med, 2015, 19 (9): 2286-2295. DOI:10.1111/jcmm.12623. |
| [11] |
夏晖, 李捷, 于长海, 等. TNF-α对人肺癌A549细胞凋亡的影响[J].
中国临床药理学与治疗学, 2005, 10 (12): 1381-1383. Xia H, Li J, Yu CH, et al. Effect of TNF-αon the apoptosis of A549 cells[J]. Chin J Clin Pharmacol Ther, 2005, 10 (12): 1381-1383. DOI:10.3969/j.issn.1009-2501.2005.12.014. |
| [12] |
韩京, 冉新泽, 粟永萍, 等. 辐射损伤对巨核细胞造血调控因子IL-6和TNF-α的影响[J].
第三军医大学学报, 2005, 27 (18): 1817-1819. Han J, Ran XZ, Su YP, et al. Effects of irradiation on expression of IL-6 and TNF-αin Dami cells[J]. Acta Acad Med Mil Tert, 2005, 27 (18): 1817-1819. DOI:10.3321/j.issn:1000-5404.2005.18.001. |
| [13] | Hamada S, Masamune A, Yoshida N, et al. IL-6/STAT3 plays a regulatory role in the interaction between pancreatic stellate cells and cancer cells[J]. Dig Dis Sci, 2016, 61 (6): 1561-1571. DOI:10.1007/s10620-015-4001-5. |
| [14] |
李峰生, 高玲, 刘丽卉, 等. γ射线照射对肺腺癌细胞迁移能力的影响及其分子机制[J].
军事医学, 2011, 35 (5): 386-390. Li FS, Gao L, Liu LH, et al. Effect of γ-ray irradiation on migration of pulmonary adenocarcinoma cells and its mechanism[J]. Bull Acad Mil Med Sci, 2011, 35 (5): 386-390. DOI:10.3969/j.issn.1674-9960.2011.05.016. |
| [15] | Tamatani T, Azuma M, Motegi K, et al. Cepharanthin-enhanced radiosensitivity through the inhibition of radiation-induced nuclear factor-kappaB activity in human oral squamous cell carcinoma cells[J]. Int J Oncol, 2007, 31 (4): 761-768. |
| [16] | Pasi F, Facoetti A, Nano R. IL-8 and IL-6 bystander signalling in human glioblastoma cells exposed to gamma radiation[J]. Anticancer Res, 2010, 30 (7): 2769-2772. |
| [17] | McClellan JL, Davis JM, Steiner JL, et al. Linking tumor-associated macrophages, inflammation, and intestinal tumorigenesis:role of MCP-1[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303 (10): G1087-1095. DOI:10.1152/ajpgi.00252.2012. |
| [18] |
张驰, 刘笑菊, 赵雪, 等. 低剂量电离辐射对糖尿病小鼠血清中炎症因子表达的影响[J].
中国生物制品学杂志, 2010, 23 (2): 124-128. Zhang C, Liu XJ, Zhao X, et al. Effect of low dose radiation on expression of inflammatory factors in sera of mice with diabetes mellitus[J]. Chin J Biol, 2010, 23 (2): 124-128. DOI:10.13200/j.cjb.2010.02.18.zhangch.024. |
| [19] | Swamydas M, Ricci K, Rego SL, et al. Mesenchymal stem cell-derived CCL-9 and CCL-5 promote mammary tumor cell invasion and the activation of matrix metalloproteinases[J]. Cell Adh Migr, 2013, 7 (3): 315-324. DOI:10.4161/cam.25138. |
| [20] | Liu J, Chen S, Wang W, et al. Cancer-associated fibroblasts promote hepatocellular carcinoma metastasis through chemokine-activated hedgehog and TGF-beta pathways[J]. Cancer Lett, 2016, 379 (1): 49-59. DOI:10.1016/j.canlet.2016.05.022. |
| [21] | Fu X, Yang B, Lao S, et al. Human memory-like NK cells migrating to tuberculous pleural fluid via IP-10/CXCR3 and SDF-1/CXCR4 axis produce IFN-gamma in response to Bacille Calmette Guerin[J]. Clin Immunol, 2013, 148 (1): 113-123. DOI:10.1016/j.clim.2013.04.003. |
| [22] | Zhang Y, Wang Y, Zhang F, et al. Allyl methyl disulfide inhibits IL-8 and IP-10 secretion in intestinal epithelial cells via the NF-кB signaling pathway[J]. Int Immunopharmacol, 2015, 27 (1): 156-163. DOI:10.1016/j.intimp.2015.05.013. |
| [23] | Yoshio T, Okamoto H, Kurasawa K, et al. IL-6, IL-8, IP-10, MCP-1 and G-CSF are significantly increased in cerebrospinal fluid but not in sera of patients with central neuropsychiatric lupus erythematosus[J]. Lupus, 2016, 25 (9): 997-1003. DOI:10.1177/0961203316629556. |
 2017, Vol. 37
2017, Vol. 37


