计算机断层成像(CT)技术广泛应用于放射诊断学、放射肿瘤学等临床应用中。在现代放射治疗中,医生根据患者CT图像勾画靶区,物理师在放射治疗计划系统(TPS)中根据CT图像计算剂量分布。错误的CT值将导致计算剂量与实际剂量产生偏差[1]。通常使用的12 bit CT图像重建,无法准确读取金属CT值;而16 bit CT图像可以提供金属CT值信息[2]。Coolens等[3]报道16 bit CT成像可以辨别不锈钢、钛合金等材料制成的人工股骨头,并能准确获取金属边界。
金属伪影的存在使CT图像产生较大失真,继而对放疗计算精度带来较大影响。过去几十年中,很多学者提出了大量去除金属伪影的方法[4-8]。Meyer等[9]提出了归一化伪影去除方法(normalized metal artifact reduction, NMAR),通过分割、滤波得到先验图像,将原始图像投影除以先验图像投影进行归一化,然后再进行插值重建。NMAR有效去除了金属伪影且不会引起新的伪影,得到了广泛应用[10-12]。
本研究采用16 bit成像技术获取金属CT值,并用NMAR方法对金属伪影进行校正,对各种情况下CT图像的CT值分布及剂量分布进行比较分析。
材料与方法1.实验材料:采用美国CIRS公司产002H9K调强验证模体,模体中间插入一自制的椭圆形不锈钢金属棒。不锈钢棒材料、密度均为已知,其相对电子密度为6.8(水为1), CT值为11 080 HU。
2.实验方法:将模体置于指定位置后,采用德国西门子公司生产的SOMATOM Definition Flash CT扫描模体,扫描时选择扩展位深功能,分别重建得到12和16 bit原始CT图像。扫描管电压设为120 kV,有效电流选择自动给出,扫描方式选为轴扫,准直器宽度为64 mm×0.6 mm,X射线管旋转时间为0.5 s/圈,扫描层厚为2 mm,CT图像重建矩阵为512×512。同时选取含有不锈钢人工股骨头的患者CT图像作对比分析。
金属的CT成像中由于杯状伪影,其CT值分布有很大落差[13]。金属边缘CT值最高且接近于实际CT值[14],在各图像中均采用金属的最大CT值,将金属区域CT值统一设为金属最大CT值。
采用Meyer等[9]提出的NMAR方法分别对12和16 bit的原始图像进行去伪影处理,得到NMAR修正后的12 bit和16 bit图像。NMAR处理过程中,首先通过图像分割和滤波得到先验图像,对先验图像进行前投影。将原始图像投影除以对应先验图像投影进行归一化,在归一化后的投影上线性插值,得到的插值后投影乘以先验图像投影得到修正后投影,最后通过滤波反投影重建得到修正后图像。
为了比较模体中的CT值分布、剂量分布情况,需要不含金属伪影的模体真实CT图像作为参考。本研究中模体真实CT图像通过如下方法得到:将金属棒抽出模体,CT扫描不含金属的模体,得到不含金属伪影的CT图像;然后将金属棒插入模体,扫描得到含金属棒CT图像,通过阈值分割(3 000 HU)方法[15]分割出金属部分,将金属部分人为地移植到之前的不含金属棒的CT图像中,这样就得到了含有金属植入物时的真实CT图像。
为了比较金属植入物对放疗剂量分布的影响,在美国瓦里安Eclipse(版本号为11.0)治疗计划系统中基于各CT图像制作了相同的放射治疗计划并计算剂量分布。计划以0°的单个照射野分别对模体和患者进行照射,源皮距SSD=100 cm,机器输出量为200 MU;照射采用的射野为10 cm×10 cm,X射线的能量为6 MV。剂量分布通过各向异性分析算法(AAA)计算得到,剂量计算网格设为2 mm×2 mm×2 mm。
结果1.修正前后CT图像比较:图 1所示为CIRS调强验证模体的各CT图像,中间高亮区域为不锈钢金属棒。对于原始CT图像(图 1A和图 1C),12与16 bit图像基本一致,金属棒引起严重的金属伪影;在水平方向产生暗伪影,而竖直方向则有较多亮伪影。NMAR修正后,金属伪影大幅减少,靠近金属区域仍存在部分伪影。NMAR修正后12与16 bit图像没有明显区别。真实CT图像(图 1E)中不含金属伪影。

|
图 1 模体CT图像比较A.12 bit原始CT图像; B.12 bit图像经NMAR修正后图像; C.16 bit原始CT图像; D.16 bit图像经NMAR修正后图像; E.模体真实CT图像 Figure 1 Comparison of phantom CT images A. 12 bit original CT image; B.12 bit NMAR corrected image; C. 16 bit original CT image; D.16 bit NMAR corrected image; E. real CT image of phantom |
图 2所示为含人工股骨头的真实患者CT图像在NMAR修正前后的图像对比。由于人工股骨头由高密度的金属制成,它在CT图像中引起了严重的金属伪影,在水平方向产生了一片类似于空气的暗伪影,在竖直方向则产生高亮度伪影。与图 1中类似,无论是在CT图像修正前还是修正后,12与16 bit图像没有明显区别。NMAR修正后图像去除了大部分的金属伪影。
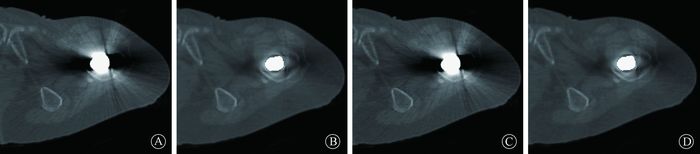
|
图 2 人工股骨头患者CT图像比较A.12 bit原始CT图像;B.12 bit图像经NMAR修正后图像;C.16 bit原始CT图像;D.16 bit图像经NMAR修正后图像 Figure 2 Comparison of CT images for a patient with artificial femur A.12 bit original CT image; B.12 bit NMAR corrected image; C.16 bit original CT image; D.16 bit NMAR corrected image |
2.修正前后图像CT值分布比较:为了比较两种图像及NMAR修正后图像的CT值差异,分别取穿过金属中心的一条水平直线和垂直竖线,比较各CT图像在两直线上的CT值分布。
图 3所示为模体中过金属中心的垂直方向上CT值分布,其中参考图像为图 1中的模体真实CT图像。图 3A中,真实图像的金属CT值为11 080 HU,12 bit图像的金属CT值为3 071 HU,远低于真实值。在金属两边,原始图像的CT值明显高于真实图像CT值,这对应于金属周围垂直方向的亮伪影。经NMAR修正后,金属周围CT值与真实图像很接近,NMAR大幅减少了金属周围的亮伪影。图 3B中,16 bit图像的金属CT值为11 098 HU,与真实CT值非常接近。与图 3 A中类似,16 bit原始图像中金属周围的CT值明显高于真实图像,而NMAR修正后其CT值分布与真实图像基本一致。
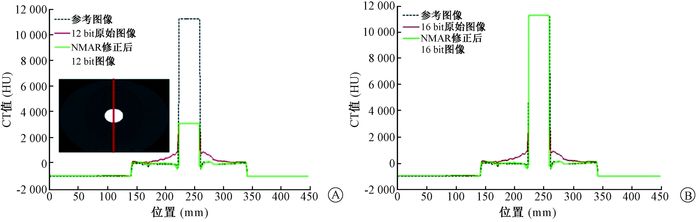
|
图 3 模体中过金属中心的垂直方向上CT值分布A.基于12 bit CT图像修正前后的CT值分布,B.基于16 bit CT图像修正前后的CT值分布 Figure 3 The CT value distribution in the vertical direction through metal center in the phantom A.CT value distribution before and after image correction based on 12 bit CT; B.CT value distribution before and after image correction based on 16 bit CT |
图 4所示为模体中过金属中心的水平方向上CT值分布。金属CT值分布与图 3中一样,12 bit为3 071 HU,16 bit为11 098 HU,16 bit图像金属CT值与真实值基本一致。图 4中,在金属周围,原始图像的CT值最低达到-1 000 HU,与真实CT值(0 HU左右)相差很大,这对应于金属周围水平方向的暗伪影。经NMAR修正后,金属周围CT值仍然低于真实CT值,但与真实CT值差距大幅减小。综合图 3,4得到,经NMAR修正后的16 bit图像与真实图像的CT值分布最接近。
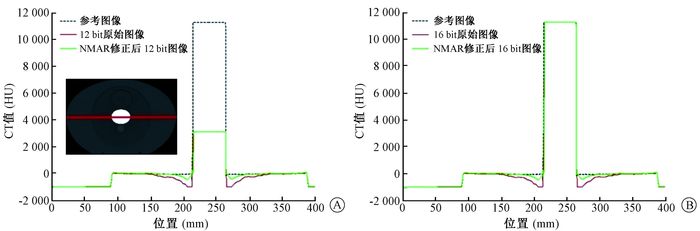
|
图 4 模体中过金属中心的水平方向上CT值分布A.基于12 bit CT图像修正前后的CT值分布;B.基于16 bit CT图像修正前后的CT值分布 Figure 4 The CT value distribution in the horizontal direction through metal center in the phantom A.CT value distribution before and after image correction based on 12 bit CT; B.CT value distribution before and after image correction based on 16 bit CT |
图 5所示为人工股骨头患者在竖直方向上的CT值分布。与模体中结果类似,12 bit图像中金属CT值为3 071 HU,而该患者的人工股骨头由高密度的不锈钢合金制成,其实际CT值必然远>3 071 HU。16 bit图像中金属CT值为10 865 HU,这与之前模体中的自制不锈钢棒CT值较接近。显然16 bit图像中的金属CT值更加接近于实际值。原始图像中金属周围的CT值明显高于正常组织CT值(0 HU左右),这由金属周围的亮伪影引起;经NMAR修正后,金属周围CT值趋近于正常组织CT值,NMAR有效移除了大部分亮伪影。
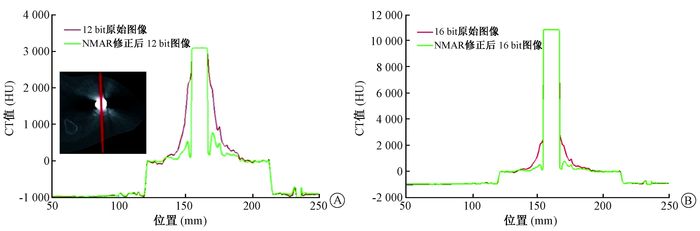
|
图 5 人工股骨头患者在垂直方向上的CT值分布A.基于12 bit CT图像修正前后的CT值分布; B.基于16 bit CT图像修正前后的CT值分布 Figure 5 The CT value distribution in the vertical direction through metal center in the patient with artificial femur A.CT value distribution before and after image correction based on 12 bit CT; B.CT value distribution before and after image correction based on 16 bit CT |
图 6为人工股骨头患者在水平方向上的CT值分布。金属CT值分布与图 5一样,12 bit为3 071 HU,16 bit为10 865 HU。对于未修正的CT图像,金属周围的CT值陡变为-1 000 HU,股骨头周围为肌肉和软组织,其实际CT值接近0 HU。在水平方向上,原始图像中严重的暗伪影导致CT值与实际值出现严重偏差。NMAR修正后,图像CT值分布与原始图像差别很大,特别是在金属周围,其CT值更接近于正常组织。NMAR修正后图像去除了严重的暗伪影和亮伪影,CT值分布更接近实际分布。16 bit图像能准确地获得金属植入物的CT值,NMAR能对金属植入物引起的伪影进行较好地修正。故对于含有金属植入物的CT成像时,NMAR修正后的16 bit图像能获得较准确的CT值分布。
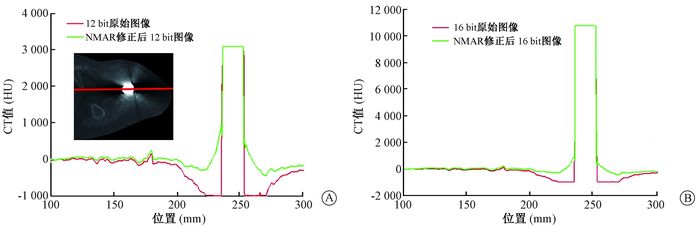
|
图 6 人工股骨头患者在水平方向上的CT值分布A.基于12 bit CT图像修正前后的CT值分布;B.基于16 bit CT图像修正前后的CT值分布 Figure 6 The CT value distribution in the horizontal direction through metal center in the patient with artificial femur A.CT value distribution before and after image correction based on 12 bit CT; B.CT value distribution before and after image correction based on 16 bit CT |
3.CT图像剂量分布比较:在设计放射治疗计划时,基于患者的CT图像计算其吸收剂量分布。图像CT值与实际值的严重偏差必然会引起计算剂量错误。为详细比较基于上述各种图像计算的剂量分布差异,本研究采用一条过金属中心的垂直线(平行于入射线方向)和距离金属后方3 cm处的水平线(垂直于入射线方向),得到各图像在这两条直线上的剂量分布差异。
图 7所示为模体中垂直方向上的剂量分布。在金属前方,各图像上的剂量分布保持一致,金属区域剂量下降变陡且图像间剂量差异变大。在金属后方,剂量差异明显;12 bit原始图像剂量略低于NMAR修正后12 bit图像,两者剂量较接近且远高于参考图像剂量;参考图像、16 bit原始图像及NMAR修正后16 bit图像三者的剂量分布差异很小。12 bit原始图像、16 bit原始图像、NMAR修正后12 bit图像、NMAR修正后16 bit图像与参考图像剂量的最大相对偏差分别为76.5%、3.3%、81.6%、1.8%。
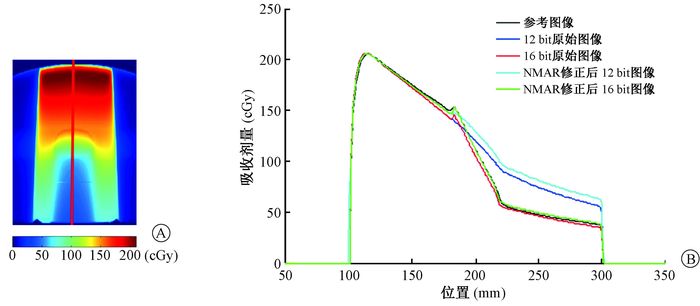
|
图 7 模体中垂直方向(沿射线入射方向)上的剂量分布A.剂量分布截面图; B.直线上的剂量分布 Figure 7 Dose distribution in the vertical direction (along the incident direction of ray) in the phantom A. Sectional view of dose distribution; B. Dose distribution on the straight line |
图 8为模体中水平方向上的剂量分布,所选水平线位于金属下方,距离金属边缘3 cm。各图像在射野内剂量分布呈现左右对称的情况,且图像间剂量差异较大。在射野中心区域,曲线明显下凹,剂量明显低于边缘剂量。由于金属植入物位于水平线上方且位于射野中心处,X射线在高密度的金属中快速衰减,而射野内边缘的X射线不穿过金属,故金属后方射野中心区域剂量显著低于边缘剂量。16 bit原始图像、NMAR修正后16 bit图像与参考图像剂量分布基本一致;而12 bit原始图像、NMAR修正后的12 bit图像与参考图像剂量差异很大,其最大偏差分别达到62.5%、72.9%。在射野内边缘区域,各图像剂量差异明显,其中NMAR修正后16 bit图像与参考图像最接近,其最大偏差为3.6%;其次是NMAR修正后12 bit图像,最大偏差为11.2%。12 bit原始图像、16 bit原始图像在射野边缘区域与参考图像最大偏差分别为21.6%、13.2%。综合图 7,8得到,在模体中NMAR修正后16 bit图像的剂量分布与参考图像最为接近。
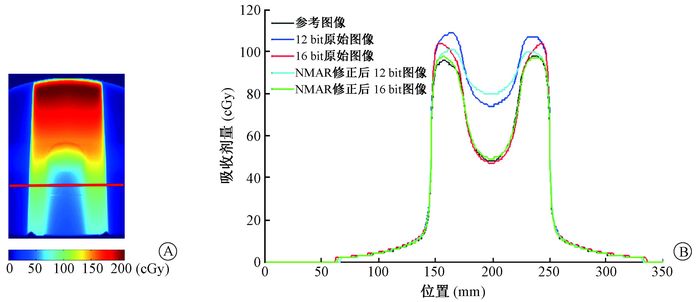
|
图 8 模体中水平方向(垂直于射线入射方向)上的剂量分布A.剂量分布截面图; B.直线上的剂量分布 Figure 8 Dose distribution in the horizontal direction (perpendicular to the incident direction of ray) in the phantom A. Sectional view of dose distribution; B. Dose distribution on the straight line |
图 9所示为基于人工股骨头患者图像计算的剂量在垂直方向的分布。与上述模体中结果类似,在射线进入金属前各图像的剂量分布基本重合,在金属区域剂量差异变大,而射线穿过金属后剂量差异很大。射线穿过金属后,12 bit原始图像剂量与NMAR修正后12 bit图像较接近,前者略小于后者;16 bit原始图像剂量略低于NMAR修正后16 bit图像,两者差距很小;16 bit图像剂量显著低于12 bit图像剂量。以NMAR修正后16 bit图像作为基准图像,12 bit原始图像、NMAR修正后12 bit图像、16 bit原始图像与基准图像的最大剂量偏差分别为27.3%、31.8%、3.2%。
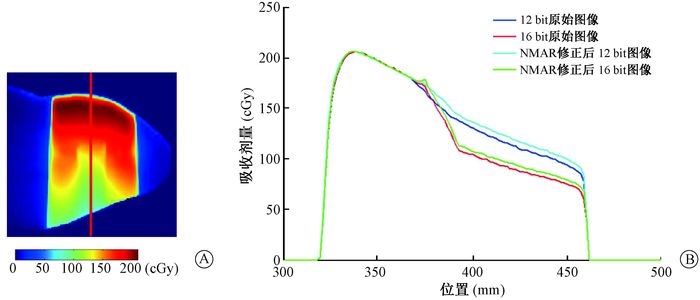
|
图 9 人工股骨头患者在垂直方向(沿射线入射方向)的剂量分布A.剂量分布截面图; B.直线上的剂量分布 Figure 9 Dose distribution in the vertical direction (along the incident direction of ray) in the patient with artificial femur A. Sectional view of dose distribution; B. Dose distribution on the straight line |
图 10为人工股骨头患者各图像在水平方向的剂量分布。与模体中结果相似,X射线在高密度金属的较强衰减导致射野中心区域的剂量明显低于两边缘的剂量。在射野中心区域,16 bit原始图像剂量最低,NMAR修正后16 bit图像略高于16 bit原始图像;12 bit原始图像和NMAR修正后12 bit图像剂量显著大于16 bit图像剂量。以NMAR修正后16 bit图像作为基准图像,12 bit原始图像、NMAR修正后12 bit图像、16 bit原始图像与基准图像的最大剂量偏差分别为29.2%、33.6%、5.2%。在射野内边缘区域,12 bit原始图像与16 bit原始图像差异很小,两者都含有严重的金属伪影;NMAR修正后12 bit图像与NMAR修正后16 bit图像剂量分布基本一致,NMAR修正后伪影都显著减少;NMAR修正后图像与原始图像剂量有较明显差异。
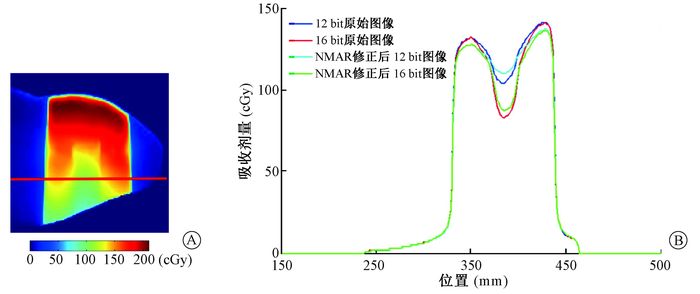
|
图 10 人工股骨头患者在水平方向(垂直于射线入射方向)的剂量分布A.剂量分布截面图; B.直线上的剂量分布 Figure 10 Dose distribution in the horizontal direction (perpendicular to the incident direction of ray) in the patient with artificial femur A. Sectional view of dose distribution; B. Dose distribution on the straight line |
讨论
患者体内的金属植入物会产生较大的CT值偏差,主要表现在两方面:金属植入物的CT值偏差及金属周围正常组织的CT值偏差。常规扫描使用的12 bit CT,其显示CT值范围为-1 024~3 071 HU。高密度的金属植入物实际CT值远>3 071 HU,故12 bit CT图像无法给出金属CT值。扩展后的16 bit CT能给出准确的金属CT值。
在12 bit图像中,金属植入物CT值仅为3 071 HU,远低于实际CT值。较低的CT值在计划系统中对应较低的电子密度,其对X射线的衰减作用也降低了,故射线穿过金属后12 bit图像的剂量显著大于参考图像。16 bit图像获取了较准确的金属CT值,在射线穿过金属后的区域其剂量分布与参考图像基本一致。
金属伪影对剂量分布产生较大影响,射野内边缘剂量的差异由金属伪影导致。在射野边缘区域,X射线没有穿过金属植入物,射线穿过了金属引起的暗伪影区域。暗伪影区域CT值远低于实际CT值,对射线的衰减作用减弱,故含有严重伪影的原始CT图像的剂量高于参考图像剂量。经NMAR修正后,伪影大幅减少,剂量分布更接近于参考图像。综合模体中实验结果,经NMAR修正后的16 bit图像与参考图像的CT值分布和剂量分布最为接近,可以准确评估实际剂量分布。在模体和人工股骨头患者NMAR修正后的16 bit图像中,金属伪影和所得到的剂量分布的实验结果表现为较好的一致性,故对于含金属植入物的患者,采用NMAR修正后的16 bit图像可以准确计算患者体内的剂量分布。
在放射治疗中,基于含金属植入物的患者CT图像计算剂量分布时,有两个关键问题会对计算剂量的准确度产生较大影响,即金属植入物的CT值与实际值的偏差,金属伪影导致周围正常组织CT值与实际值的偏差。16 bit成像技术可以较准确的获取金属植入物的CT值,NMAR去伪影技术则可以对金属伪影进行有效校正,故在16 bit图像上进行NMAR校正可以获取较准确的CT图像,从而得到正确的剂量分布。
利益冲突 本研究还接受常州市社会发展项目(CJ20160029)、常州市卫生高层次人才资助项目(2016CZLJ004)和南京医科大学科技发展基金项目(2016NJMU136)的资助,本研究过程和结果均未受到相关设备、材料企业的影响。全体作者未因进行该研究而接受任何不正当的职务或财务利益,在研究的独立性和科学性予以保证作者贡献声明 高留刚负责金属伪影校正、论文撰写;孙鸿飞负责数据收集整理;谢凯负责数据分析与绘图;林涛负责剂量计算;眭建锋负责剂量分析;倪昕晔负责论文撰写指导与修改
| [1] |
Giantsoudi D, De Man B, Verburg J, et al. Metal artifacts in computed tomography for radiation therapy planning:dosimetric effects andimpact of metal artifact reduction[J]. Phys Med Biol, 2017, 62(8): R49-R80. DOI:10.1088/1361-6560/aa5293 |
| [2] |
Glide-Hurst C, Chen D, Zhong H, et al. Changes realized from extended bit-depth and metal artifact reduction in CT[J]. Med Phys, 2013, 40(6): 061711. DOI:10.1118/1.4805102 |
| [3] |
Coolens C, Childs PJ. Calibration of CT Hounsfield units for radiotherapy treatment planning of patients with metallic hip prostheses:the use of the extended CT-scale[J]. Phys Med Biol, 2003, 48(11): 1591-1603. DOI:10.1088/0031-9155/48/11/308 |
| [4] |
Zhang X, Xing L. Sequentially reweighted TV minimization for CT metal artifact reduction[J]. Med Phys, 2013, 40(7): 071907. DOI:10.1118/1.4811129 |
| [5] |
Heußer T, Brehm M, Ritschl L, et al. Prior-based artifact correction (PBAC) in computed tomography[J]. Med Phys, 2014, 41(2): 021906. DOI:10.1118/1.4851536 |
| [6] |
Wu M, Keil A, Constantin D, et al. Metal artifact correction for X-ray computed tomography using kV and selective MV imaging[J]. Med Phys, 2014, 41(12): 121910. DOI:10.1118/1.4901551 |
| [7] |
Kalender WA, Hebel R, Ebersberger J. Reduction of CT artifacts caused by metallic implants[J]. Radiology, 1987, 164(2): 576-577. DOI:10.1148/radiology.164.2.3602406 |
| [8] |
Wang J, Wang S, Chen Y, et al. Metal artifact reduction in CT using fusion based prior image[J]. Med Phys, 2013, 40(8): 081903. DOI:10.1118/1.4812424 |
| [9] |
Meyer E, Raupach R, Lell M, et al. Normalized metal artifact reduction (NMAR) in computed tomography[J]. Med Phys, 2010, 37(10): 5482-5493. DOI:10.1118/1.3484090 |
| [10] |
Paudel MR, Mackenzie M, Fallone BG, et al. Clinical evaluation of normalized metal artifact reduction in kVCT using MVCT prior images (MVCT-NMAR) for radiation therapy treatment planning[J]. Int J Radiat Oncol Biol Phys, 2014, 89(3): 682-689. DOI:10.1016/j.ijrobp.2014.02.040 |
| [11] |
Abdoli M, Mehranian A, Ailianou A, et al. Assessment of metal artifact reduction methods in pelvic CT[J]. Med Phys, 2016, 43(4): 1588. DOI:10.1118/1.4942810 |
| [12] |
Meyer E, Raupach R, Lell M, et al. Frequency split metal artifact reduction (FSMAR) in computed tomography[J]. Med Phys, 2012, 39(4): 1904-1916. DOI:10.1118/1.3691902 |
| [13] |
高留刚, 倪昕晔, 林涛, 等. 金属植入物16-bit CT成像对放疗剂量分布的影响[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1248-1254. Gao LG, Ni XY, Lin T, et al. Effect of 16-bit computed tomography imaging of metallic implants on dose distribution in radiotherapy[J]. Chin J Radiat Oncol, 2016, 25(11): 1248-1254. DOI:10.3760/cma.j.issn.1004-4221.2016.11.023 |
| [14] |
Paudel MR, Mackenzie M, Fallone BG, et al. Evaluation of normalized metal artifact reduction (NMAR) in kVCT using MVCT prior images for radiotherapy treatment planning[J]. Med Phys, 2013, 40(8): 081701. DOI:10.1118/1.4812416 |
| [15] |
Zhang Y, Yan H, Jia X, et al. A hybrid metal artifact reduction algorithm for x-ray CT[J]. Med Phys, 2013, 40(4): 041910. DOI:10.1118/1.4794474 |
 2017, Vol. 37
2017, Vol. 37


