2. 300211 天津医科大学第二医院肿瘤科;
3. 100191 北京大学第三医院肿瘤放疗科
2. Department of Oncology, Second Hospital of Tianjin Medical University, Tianjin 300211, China;
3. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China
肺上沟癌的是一种特殊类型的肺癌,占肺癌病例的3%~5%[1],是生长于肺尖,在临床上或影像学上有侵犯第一肋、臂丛、锁骨下动静脉、交感神经节和(或)胸椎等胸廓入口结构证据的非小细胞肺癌[2]。由于肺上沟癌临床表现不明显,极易忽略或误诊,严重延误患者的确诊,往往发现已属于中晚期,5年生存率30%~40%。本研究对36例肺上沟癌患者应用化疗联合放射性125Ⅰ粒子植入治疗,取得了良好的效果,现将结果报道如下。
资料与方法1.患者资料:回顾性分析了2002年12月至2010年12月天津医科大学第二医院收治的确诊肺上沟癌的患者36例,其确诊包括临床表现、影像学检查及病理诊断[3]:出现肩背部疼痛、上肢尺神经分布区麻痹和Horner征其中之一或一种以上;影像学检查发现肺尖部肿块,并已侵犯胸壁;取得肿块组织行病检确定为恶性肿瘤。其中,男22例,女14例;年龄58~87岁,中位年龄74.6岁。鳞癌20例,腺癌16例。肿瘤直径中位值3.9 cm(2.7~6.0 cm),中位体积61.5 cm3(19.7~216 cm3)。均为患有严重心脑血管疾病、肺功能不全、重症糖尿病等疾病,不能或不愿意接受外科手术及化疗的患者。
2.设备与仪器:治疗计划系统(TPS)由北航科霖公司生产,国产粒子植入器械(天津赛德生物制药有限公司),及粒子植入校准仪(天津同仁和医用科技有限公司)。美国GE公司生产64排螺旋CT。密封的放射性125Ⅰ粒子源由中国原子能科学院生产,半衰期60.2 d,中位活度0.7 mCi(2.59×107 Bq),0.68~0.82 mCi (2.52×107~3.03×107 Bq),γ射线能量27~35 keV,半价层0.025 mmPb。
3.治疗方法:采用处方剂量(prescribed dose, PD)120 Gy,根据TPS,按CT成像的瘤灶大小,做出术前计划,包括植入通道、植入的粒子数量等。植入完成后即刻CT逐层扫描,输入TPS行粒子重建,术后进行质量验证。根据进针方向确定患者体位,CT层厚0.5 cm扫描肿瘤部位,安装模板,从肿瘤中心平面开始,每间隔1 cm布植入针,深度为穿过肿瘤中心距边缘0.5 cm。CT再次扫描确定针尖准确位置后,每1~1.5 cm植入1个颗粒子,每层间隔1 cm,逐层植入后CT扫描确认。化疗方案为第1、8天静脉给予1 000 mg/m2吉西他滨,第1天静脉给予顺铂75 mg/m2,连续4个周期,同时给予中药等辅助治疗。
4.随访:术后1~2个月、6个月、1年复查胸部CT,随访时间截至2014月12月。失访1例,失访率2.8%。
5.疗效判定:近期疗效评价125Ⅰ放射性粒子植入后6个月内参照实体瘤评价标准(response evaluation criteria in solid tumors, RECIST)[4]评价,分为完全缓解(CR)、部分缓解(PR)、病灶稳定(SD)和疾病进展(PD)。CR指所有已知病灶完全消失,PR指肿瘤最大单径之和减少30%以上,PD指肿瘤最大单径之和增加20%或出现新病灶,其余为SD。疼痛缓解评价标准:根据国际上通用的疼痛数字评估法(numerical rating scales, NRS)评价疼痛减轻程度,疼痛减轻程度及百分数=(A-B)/A×100%(A=用药前评分,B=用药后评分),分为0度:未缓解(疼痛未减轻,≤24%);1度:轻度缓解(疼痛减轻1/4以上,25%~49%);2度:中度缓解(疼痛减轻1/2以上,50%~74%);3度:明显缓解(疼痛减轻3/4以上,75%~99%);4度:完全缓解(疼痛消失,即100%)。
6.统计学处理:采用SPSS 16.0软件包,Kaplan-Meier法计算生存率。
结果1.临床疗效:术后TPS验证,靶区瘤体mPD(118.7±7.2)Gy,D90(126±4.7)Gy,D90> mPD,中位植入粒子42颗。术后6个月胸部CT显示,CR 11例,占30.6%;PR 19例,占52.8%;SD 5例,占13.9%;PD 1例,占2.8%。总有效率(CR+PR)为83.4%,共30例。1年局部控制率为92%。1、3、5年累计生存率分别为84.1%、56.7%和36.8%。中位生存期38个月。疼痛缓解率86.11%(31/36),疼痛缓解中位时间8个月。图 1显示某患者右肺上沟癌125Ⅰ植入术后6个月病灶达到PR。
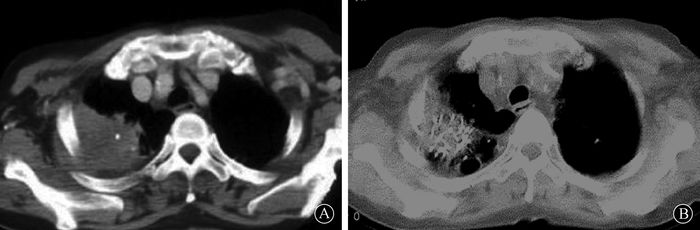
|
图 1 1例术前(A)和术后6个月(B)的胸部CT影像 Figure 1 The chest CT of 1 case before treatment (A) and 6 months after treatment (B) |
2.不良反应:3级以上骨髓抑制发生率5%(2例),放射性肺不良反应5%(2例);操作相关并发症:气胸22.5%(9例),其中肺压缩30%以上3例,术中行胸腔穿刺,术后行胸腔闭式引流;咯血10.0%(4例),量约30 ml,未行特殊处理3日内咯血停止;胸壁气肿5.0%(2例)。
讨论Pancoast认为本病发生在肺上沟部位,故在他首次报告本病时称之为肺上沟瘤,医学界也称之为Pancoast瘤,以后由于认识到本病是周围型肺癌的一种特殊类型,又称为肺上沟癌[5]。肺上沟癌是一种特殊类型的肺癌,由于生长位置非常特殊,发病早期几乎都没有肺部症状,而表现为肩背剧痛、上肢麻痹和Horner征,极易被忽略或误诊。与其他类型的肺癌相反,肺上沟癌同侧锁骨上淋巴结转移代表局部淋巴结转移,而纵隔淋巴结转移则代表远处转移[6]。故肺上沟癌的手术禁忌证为臂丛神经、锁骨下动脉、椎体及椎根广泛受累,广泛的纵隔淋巴结转移和远处转移。近十年来,随着医疗技术的进步,同期放化疗逐渐为人们所接受。事实上,这两种方法联合应用已经在多种肿瘤的治疗中显示出良好的局部控制率和生存率,如局部晚期非小细胞肺癌、宫颈癌等。目前,125Ⅰ粒子植入已被广泛用于多种恶性肿瘤的治疗,包括脑瘤、鼻咽癌、胰腺癌、直肠癌、肺癌及前列腺癌等,并取得较佳的临床效果[7]。
国外的一些研究显示,肺上沟瘤单纯放疗后症状缓解率为70%~86%,5年生存率为0~23%,中位生存期为6~17个月[8-9]。根据TPS计算布源或遵照Halarism的125Ⅰ经验公式进行操作,所用125Ⅰ的处方剂量为120 Gy[10],这样既能达到杀灭肿瘤的作用,又避免了对周围正常组织的损伤。放射性粒子组织间近距离治疗(interstitial brachytherapy)肿瘤是一种非常有效的治疗手段。其主要优势包括物理学和生物学两方面:局部照射可增加肿瘤与正常组织的剂量分配比;由于治疗时间缩短而使肿瘤细胞增殖进一步减少;由于剂量率的降低使氧增强比减少,即射线对肿瘤细胞杀伤时对氧的依赖性减少,进而部分克服了肿瘤乏氧细胞对放射的抗拒作用。在放疗的过程中同步进行化疗,具有以下优点:化疗药物进一步提高肿瘤细胞对放射线的敏感性,放疗也可以增强化疗药物的细胞毒性,从而产生相互协同作用;在放疗中应用化疗药物有利于杀灭放射性亚致死性损伤的修复。本组患者采用低剂量率125Ⅰ粒子联合化疗治疗不能手术切除的肺上沟癌,主要目的是为了缓解症状,延长生存期。结果显示,中位生存期为28个月,5年生存率为36.8%,疼痛缓解率86.11%,疼痛缓解中位时间8个月。125Ⅰ粒子联合化疗可成为治疗不能手术切除的肺上沟癌一个较好的选择。
总之,化疗联合放射性粒子植入治疗肺上沟癌显示了较好的疗效。如何依据患者的个体差异来结合化疗,是目前临床研究的重点。目前,化疗联合永久性植入125Ⅰ粒子技术在肺上沟癌治疗的临床应用尚处于起始阶段,且主要用于不能手术治疗的晚期病例,但仍有较好的近期疗效和非常理想的局部控制率。随着相关方面研究的逐步深入、定位技术的逐步提高和植入器械的不断改良,特别是与手术治疗相结合,化疗联合125Ⅰ粒子植入将为肺上沟癌的治疗提供新的发展空间。
志谢 本工作得到中国北方放射性粒子多中心协作组(CNRBG)的指导,在此表示感谢利益冲突 本研究还接受天津医科大学第二医院科学基金(2016ydey08)资助。全体研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 阎卫亮负责整理资料、采集数据、起草论文;霍小东、霍彬、王海涛负责审核数据及粒子植入计划;郑广钧指导粒子植入计划;石树远、冯震负责粒子植入操作;柴树德负责共面模板和导航定位架的设计和制作;王俊杰指导论文写作
| [1] |
Lapiński M, Dziadziuszko R, Sawicka W, et al. Early results of a trimodality treatment for superior sulcus tumors[J]. Kardiochir Torakochirurgia Pol, 2014, 11(3): 268-272. DOI:10.5114/kitp.2014.45675 |
| [2] |
McFadden PM, Wiggins LM. Assessment of contemporary aggressive surgical resection for superior sulcus and pancoast lung tumors[J]. Semin Thorac Cardiovasc Surg, 2017, 29(1): 89-90. DOI:10.1053/j.semtcvs.2017.03.002 |
| [3] |
Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J]. J Natl Cancer Inst, 2000, 92(3): 205-216. DOI:10.1093/jnci/92.3.205 |
| [4] |
Bogaerts J, Ford R, Sargent D, et al. Individual patient data analysis to assess modifications to the RECIST criteria[J]. Eur J Cancer, 2009, 45(2): 248-260. DOI:10.1016/j.ejca.2008.10.027 |
| [5] |
Shaw RR. Pancoast's tumor[J]. Ann Thorac Surg, 1984, 37(4): 343-345. DOI:10.1016/S0003-4975(10)60743-6 |
| [6] |
Van Schil PE, Sigal-Cinqualbre A, Dartevelle P, et al. Superior sulcus tumors:do they really exist?[J]. J Thorac Oncol, 2012, 7(5): 777-778. DOI:10.1097/JTO.0b013e318250edb2 |
| [7] |
Wang Z, Lu J, Liu L, et al. Clinical application of CT-guided 125Ⅰ seed interstitial implantation for local recurrent rectal carcinoma[J]. Radiat Oncol, 2011, 6: 138. DOI:10.1186/1748-717X-6-138 |
| [8] |
Xue Z, Wu F, Pierson KE, et al. Survival in surgical and nonsurgical patients with superior sulcus tumors[J]. Ann Thorac Surg, 2017, 104(3): 988-997. DOI:10.1016/j.athoracsur.2017.03.027 |
| [9] |
Solli P, Casiraghi M, Brambilla D, et al. Surgical treatment of superior sulcus tumors:A 15-year single-center experience[J]. Semin Thorac Cardiovasc Surg, 2017, 29(1): 79-88. DOI:10.1053/j.semtcvs.2017.01.010 |
| [10] |
Huo X, Wang H, Yang J, et al. Effectiveness and safety of CT-guided 125Ⅰ seed brachytherapy for postoperative locoregional recurrence in patients with non-small cell lung cancer[J]. Brachytherapy, 2016, 15(3): 370-380. DOI:10.1016/j.brachy.2016.02.001 |
 2017, Vol. 37
2017, Vol. 37


