2. 830011 乌鲁木齐, 新疆医科大学第一附属医院泌尿中心
2. Department of Urology, First Affiliated Hospital of Xinjiang Medical University, Urumqi 830011, China
高达70%肝癌(HCC)患者确诊时已是晚期,丧失手术机会,预后极差,中位生存时间<1年[1-2]。2016年我国《原发性肝癌放疗共识》推荐放射治疗是不可手术肝癌的一种治疗方式[3],但疗效并不理想,因此,如何增加肝癌细胞的放射敏感性,对提高肝癌放疗疗效具有重要意义。
在传统中药中,薏苡仁具有抗肿瘤作用[4]。体外实验已证实,薏苡仁对多种恶性肿瘤细胞的生长具有抑制作用,同时可以促进细胞凋亡[5]。临床研究显示,薏苡仁可单独用于患者的抗肿瘤治疗,或与化疗、放疗、靶向药物联合治疗均有抗肿瘤作用,并能改善肿瘤患者的生活质量。它在肝癌、肺癌、结肠癌、胰腺癌、乳腺癌等的研究中显示出较好的应用前景[6-10],但薏苡仁对肝癌是否具有放射增敏的作用尚不明确。本研究以人肝癌细胞Bel-7402为研究对象,应用薏苡仁注射液联合X射线处理Bel-7402细胞,研究薏苡仁对放射敏感性的影响,为提高肝癌放疗疗效奠定实验基础和提供理论依据。
材料与方法1.材料:肝癌细胞系Bel-7402购自武汉巴菲尔公司。胎牛血清购自美国GIBCO公司,青链霉素混合液(100X)、DMEM高糖培养基、胰酶均购自美国Hyclone公司, 四甲基偶氮唑盐比色(MTT)实验所用试剂购自南京建成公司,碘化丙啶(PI)购自美国BD公司。薏苡仁注射液为浙江康莱特药业公司生产(生产批号1503163-1),Bax、Bcl-2及β-肌动蛋白(鼠抗人)抗体均购于美国CST公司。
2.细胞培养及分组:人肝癌细胞Bel-7402用含10%灭活胎牛血清和1%青链霉素混合液的DMEM培养基,37℃、5%CO2条件下培养,细胞贴壁生长,以0.25%的胰酶消化,2~3 d传代1次,取对数生长期细胞继续进行实验。将所测定的细胞分为空白对照组、薏苡仁组(4和12 μmol/L)、单纯照射组(8 Gy)及联合处理组(12 μmol/L+8 Gy)。
3.照射条件:美国Varian 2300C/D直线加速器6 MV X射线照射,源靶距100 cm,照射野10 cm×10 cm。培养皿面上覆盖1 cm厚铅板于室温下照射,吸收剂量8 Gy, 吸收剂量率300 cGy/min。药物处理后24 h,再进行照射。
4. MTT法测细胞存活率:用0.25%的胰酶消化对数生长期的细胞,制备单细胞悬液。将肝癌细胞Bel-7402以4×104/ml的密度接种到96孔培养板,每孔含培养液100 μl,在37℃含5%CO2饱和湿度条件下培养24 h后,更换培养液,分别加入含浓度为4、8、12、16、20、24和32 μmol/L的薏苡仁注射液的细胞培养液200 μl,每一浓度设6个复孔,加药后的细胞继续培养48 h后,于实验终止前4 h每孔加入5 mg/ml的MTT溶液20 μl, 继续培养4 h,然后吸去上清,加入200 μl的二甲基亚砜(DMSO),室温条件下振荡混匀后,酶联免疫检测分析仪测定495 mm处吸光度(A)值,表示细胞存活率。
5.流式细胞技术检测细胞凋亡:取对数生长期的肝癌细胞Bel-7402按4×104/ml密度接种于6孔板上,分别加入含4和12 μmol/L的薏苡仁注射液的培养液,作用48 h,消化细胞后,离心半径8 cm,2 500 r/min, 离心5 min收集细胞,使用PBS洗1次,用0.5 ml PBS重悬细胞,加入300 Annexin V结合液重悬细胞,加入5 μl Annexin V异硫氢酸荧光素(FITC)和5 μl的PI轻摇混匀,室温避光孵育15 min,即用流式细胞仪定量检测,同时以不加Annexin V和加入Annexin V及PI的各1管作为阴性对照。每组实验重复3次。
6. Real-time PCR实验:将对数期细胞接种于6孔培养板中(1×105/孔),贴壁24 h按照实验分组进行处理48 h后,加入1 ml TRIzol溶液按照操作说明提取总RNA并测定RNA浓度。以1 μg RNA为模板, 按照RT-PCR反转录试剂盒操作说明,经基因组DNA的去除反应和反转录反应合成cDNA;以1 μl cDNA为模板,进行Real-time PCR反应。反应体系为10 μl,包括SYBR®Premix Ex TaqTM Ⅱ (2×) 5.0 μl、引物0.5 μl、cDNA 1.0 μl、ddH2O 3.0 μl;反应条件为:95℃10 s,95℃5 s,60℃15 s,72℃15 s,45个循环。Bax引物:上游为5′ GAGGAAGTCCAGTGTCCAGC 3′;下游为5′ CTGCAGAGGATGATTGCTGA 3′;Bcl-2引物:上游为5′ CGACTTGCAGAGATGTC 3′;下游为5′ CATCCACAGAGCGATGTTGT 3′;β-肌动蛋白引物:上游为5′ GCACCACACTTTCTACACAATGA 3′;下游为5′ GAACCGCTCATTGCCGATAGT 3′。
7. Western blot实验:检测Bax、Bcl-2蛋白表达,将对数期细胞接种于6孔培养板中(1×105/孔),贴壁24 h后按照各实验分组进行处理48 h后,提取总蛋白并定量。对各处理组提取总蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。将蛋白转至聚偏二氟乙烯膜(PVDF膜)上,用5%脱脂牛奶室温封闭2 h,40℃孵育一抗过夜,TBST缓冲液清洗后室温孵育二抗1 h,再次洗膜后加入荧光发光液检测。
8.细胞克隆形成实验:将对数生长期的细胞按照不同照射剂量接种不同细胞数至6孔板上,分为单纯照射组和联合处理组。联合处理组给予含12 μmol/L的薏苡仁注射液的培养液作用24 h后与单纯照射组一起分别接受0、2、4、6、8和10 Gy的6 MV的X射线照射,继续培养2周,用无水甲醇固定15 min,结晶紫染色1 h后,洗净后室温晾干,最后观察和记录含有≥50个细胞的克隆个数,克隆形成率(PE)=照组克隆数/实验组细胞数×100%,存活分数(SF)=克隆数/(实验组细胞数×PE)。按单击多靶模型SF=1-(1-eD/D0)N拟合细胞存活曲线,计算反映细胞敏感性的参数D0、Dq值。基于计算出的单纯照射组和联合处理组D0值,计算放射增敏比(SER),所有实验均重复3次以上。
9.统计学处理:采用SPSS 22.0软件进行分析,实验结果方差齐,多组间比较采用方差分析,符合正态分布的数据用x±s表示,两组间比较采用独立样本t检验,克隆形成实验中细胞存活曲线及回归方程采用Graph Prism 6.0软件进行统计分析。P<0.05为差异有统计学意义。
结果1.薏苡仁注射液及联合X射线对Bel-7402细胞生长的抑制作用:4、8、12、16、20、24和32 μmol/L的薏苡仁注射液处理Bel-7402细胞48 h后,各浓度的细胞抑制率分别为(14.43±2.12)%、(23.64±1.47)%、(28.73±2.36)%、(32.38±2.79)%、(37.68±1.49)%、(41.99±0.78)%和(43.43±3.21)%(F=118.58,P<0.01),提示薏苡仁注射液对Bel-7402细胞生长有明显的抑制作用,并具有浓度依赖性。
空白对照组、薏苡仁注射液组(4和12 μmol/L)、单纯照射组(8 Gy)及联合处理组(12 μmol/L+8 Gy)处理后48 h,联合处理组的细胞抑制率明显高于薏苡仁组(12 μmol/L)、单纯照射组(8 Gy) (t=17.03、11.26,P<0.05)。提示薏苡仁与X射线联合可以提高对肝癌细胞生长的抑制作用(图 1)。
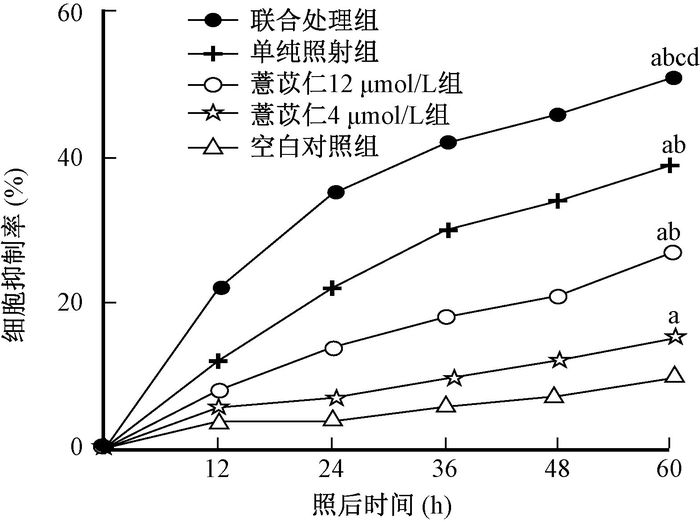
|
图 1 各处理组照射后不同时间对肝癌细胞生长的抑制率 注:a与空白对照组比较,t=-2.14~76.85,P<0.05;b与薏苡仁4 μmol/L组比较,t=-1.58~36.77,P<0.05;c与薏苡仁12 μmol/L组比较,t=17.03,P<0.05;d与单纯照射组比较,t=11.26,P<0.05 Figure 1 The inhibition rate of hepatoma cells in each treatment group at different time after irradiation |
2.薏苡仁注射液对人肝癌细胞Bel-7402凋亡的影响:空白对照组、薏苡仁组(4和12 μmol/L)、单纯照射组、联合处理组细胞凋亡率分别为2.45%、8.36%、14.31%、16.32%、34.21%。与薏苡仁组和单纯照射组相比,联合处理组的凋亡率明显增加(t=24.80、20.19, P<0.05),薏苡仁注射液与X射线两者联合能明显诱导肝癌细胞凋亡,二者具有协同作用。
3.薏苡仁联合X射线对肝癌细胞Bax和Bcl-2 mRNA、蛋白表达水平的影响:RT-PCR结果显示,处理48 h后,与空白对照组相比,薏苡仁组、单纯照射组及联合处理组Bax的mRNA表达水平依次升高(F=437.92, P<0.05),其中联合处理组Bax的mRNA表达最高, 高于薏苡仁组与单纯照射组(t=3.47、5.25, P<0.05),见表 1。同时,Western blot显示Bax蛋白表达与mRNA水平基本一致,亦呈逐渐升高趋势(F=67.91,P<0.05)。薏苡仁组、单纯照射组及联合处理组Bcl-2的mRNA表达水平逐渐降低,呈逐渐下降趋势(F=31.18, P<0.05),但联合处理组Bcl-2的mRNA水平与薏苡仁组、单纯照射组相比,差异无统计学意义(P>0.05)。Western blot结果显示,与薏苡仁组、单纯照射组相比,联合处理组Bcl-2蛋白表达水平最低(t=14.42、8.35,P<0.05,图 2)。
|
|
表 1 各处理组肝癌细胞Bax、Bcl-2 mRNA的相对表达(x±s) Table 1 The relative expression of mRNA in each group(x±s) |
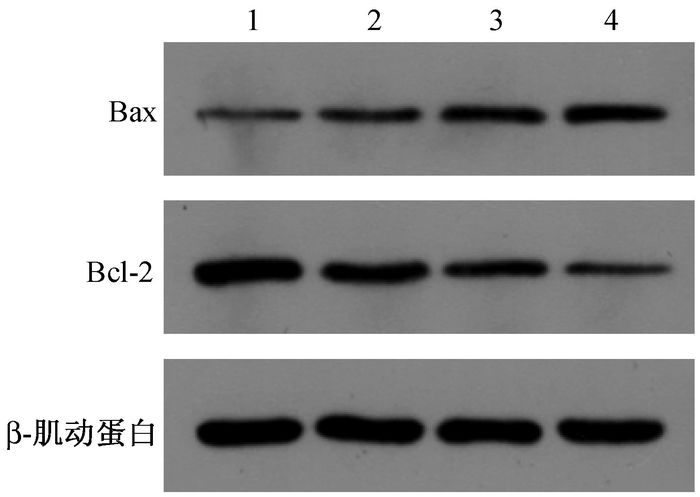
|
图 2 各处理组肝癌细胞Bax、Bcl-2蛋白表达电泳图 注:1.空白对照组;2.薏苡仁组;3.单纯照射组;4.联合处理组 Figure 2 The protein levels electrophorograms of Bax, Bcl-2 of hepatoma cells in different treatment groups |
4.薏苡仁注射液对人肝癌Bel-7402细胞的放射敏感性的影响:细胞克隆形成法观察到,在单纯照射组中,随着X射线剂量逐渐增加(0、2、4、6、8、10和10 Gy),肝癌细胞存活数逐渐下降。在联合处理组中,加入薏苡仁注射液12 μmol/L培养2周后,细胞存活数随着照射剂量的逐步增加,细胞存活数进一步降低,提示X射线照射剂量与细胞存活数存在反向伴随关系,并且薏苡仁与X射线联合可以增强射线对肝癌细胞的杀灭作用。采用单击多靶模型拟合剂量存活曲线(图 3)。单纯照射组和联合处理组D0值分别是4.27和3.34 Gy,放射增敏比SERD0为1.27,提示薏苡仁注射液能提高肝癌Bel-7402细胞对X射线的放射敏感性。
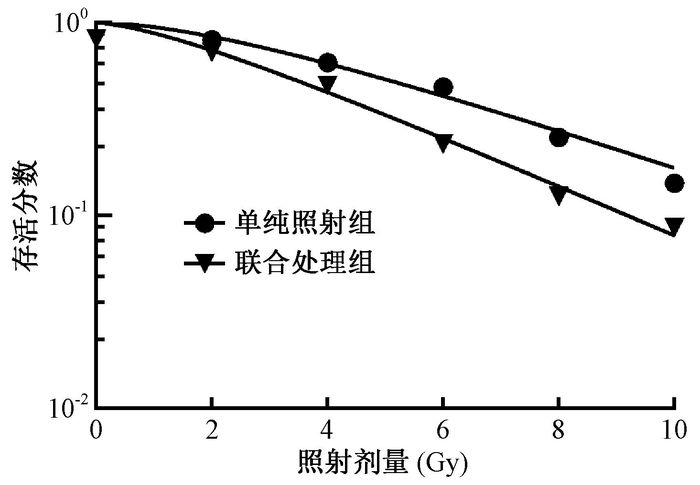
|
图 3 单击多靶模型拟合剂量存活曲线 Figure 3 Survival curved by single-hit multitarget model |
讨论
薏苡仁注射液是中药薏苡仁中提炼的薏苡仁油为主要成分,是禾本科植物薏苡的成熟种仁,具有解热、镇静、镇痛作用[10]。近年来研究表明,薏苡仁可通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡而发挥抗肿瘤作用[11]。但薏苡仁在肝癌细胞中是否能协同射线杀伤肿瘤,具有放射增敏的作用,目前尚无报道。本研究首次报道薏苡仁对X射线照射肝癌细胞具有放射增敏作用,为肝癌放疗的新思路提供理论依据。本研究发现,单纯薏苡仁可以抑制肝癌细胞Bel-7402的生长,随药物浓度增加,抑制率相应增加,呈剂量依赖趋势。当薏苡仁联合X射线照射时,其抑制率进一步下降,表明薏苡仁可以增加X射线对肿瘤细胞的杀灭作用,并且具有协同作用。保学明等[8]报道在结肠癌中薏苡仁也能抑制肿瘤生长,其原因是薏苡仁可以影响细胞周期,减少肿瘤细胞进入G0、G1期细胞比例,导致S期细胞百分比下降,从而减少细胞分裂,抑制细胞增殖活性。
此外,本研究观察薏苡仁对肝癌Bel-7402细胞凋亡的影响,4和12 μmol/L薏苡仁与Bel-7402细胞分别作用48 h后,薏苡仁组的凋亡率高于空白对照组,高浓度组的凋亡率高于低浓度组,提示薏苡仁对肝癌细胞具有诱导凋亡的作用,并且浓度高的促凋亡能力更强。通过薏苡仁联合X射线处理Bel-7402细胞,发现联合处理组的凋亡率最高,提示薏苡仁能增强X射线对肝癌细胞诱导凋亡的作用。
目前有学者认为,细胞凋亡的分子生物学机制与以下有关,端粒酶活化,Caspase蛋白的过表达,凋亡相关信号通路的激活,周期蛋白Cyclin D和P27的表达上调,以及Bax和Bcl-2蛋白的过表达[12]。其中Bcl-2家族与细胞凋亡关系最为密切,它包括Bcl-2、Bcl-xL、Bax和Bad等。Bcl-2是重要的抑制细胞凋亡的基因,而其同源基因Bax则诱导凋亡[13]。那么薏苡仁协同X射线促进凋亡与Bcl-2家族是否有关,值得探讨。为此,本研究检测Bax和Bcl-2的mRNA和蛋白表达,发现薏苡仁可上调肝癌细胞Bax的mRNA表达,下调Bcl-2的mRNA表达。同时联合处理组Bax表达最高,Bcl-2表达最低,与凋亡率结果一致。提示薏苡仁可能通过调节Bax和Bcl-2发挥诱导凋亡的作用,并且可以协同X射线对肝癌细胞的凋亡作用。
本研究通过克隆形成实验发现,联合处理组细胞克隆形成率低于单纯照射组,经过单击多靶模型拟合,联合处理组的放射增敏比为1.37,说明薏苡仁对X射线照射肝癌细胞具有放射增敏作用。这与吕品田等[14]应用薏苡仁联合X射线在肺癌中的研究报道一致。其原因可能是薏苡通过调节细胞周期,阻滞细胞至G2期和M期,使更多肿瘤细胞进入对放射敏感的G2+M期,增强X射线杀伤肿瘤细胞的能力,提高凋亡率,因此薏苡仁具有放射增敏作用。
综上,薏苡仁可以抑制肝癌细胞的生长,诱导凋亡,协同X射线照射杀灭肿瘤细胞,具有放射增敏的作用,可能是通过调节凋亡相关因子Bax和Bcl-2发挥作用,但其深入的分子机制还有待进一步探讨和验证。
利益冲突 本文研究者及家属,未因进行该研究而接受任何不正当的职务或经费利益,在此对研究的独立性和科学性予以保证作者贡献声明 杨颖负责实验操作;李志鹏撰写论文;贾春丽修改论文;刘强、杨志芳负责细胞照射;张瑞丽、毛睿负责数据统计分析;张华、艾斯克尔·吐拉洪指导实验;包永星设计研究方案,分析讨论研究结果
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Hiraoka A, Kawamura T, Aibiki T, et al. Prognosis and therapy for ruptured hepatocellular carcinoma:problems with staging and treatment strategy[J]. Eur J Radiol, 2015, 84(3): 366-371. DOI:10.1016/j.ejrad.2014.11.038 |
| [3] |
中华医学会放射肿瘤学分会, 中国生物医学工程学会精确放疗分会肝癌学组与消化系统肿瘤专家委员会, 中国研究型医院学会放射肿瘤学分会肝癌学组. 2016年原发性肝癌放疗共识[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1141-1150. DOI:10.3760/cma.j.issn.1004-4221.2016.11.001 |
| [4] |
江明万, 王晴雷, 于双, 等. 恩替卡韦联合康莱特注射液治疗乙型肝炎患者晚期肝癌的临床观察[J]. 中华医院感染学杂志, 2016, 26(16): 3628-3630. Jiang MW, Wang QL, Yu S, et al. Clinical observation of entecavir and kanglaite injection combined treatment to hepatitis b patients with advanced hepatocarcinoma[J]. Chin J Nosocomiol, 2016, 26(16): 3628-3630. DOI:10.11816/cn.ni.2016-160040 |
| [5] |
曾红学, 曾春生, 刘联斌, 等. 康莱特联合吉非替尼对晚期非小细胞肺癌患者免疫功能和生活质量的影响[J]. 中华实用诊断与治疗杂志, 2014, 28(9): 930-931. Zeng HX, Zeng CS, Liu LB, et al. Influence of Kanglaite plus Gefitinib on immune function and quality of life in patients with advanced non-small cell lung cancer[J]. J Chin Pract Diagn Ther, 2014, 28(9): 930-931. DOI:10.13507/j.issn.1674-3474.2014.09.041 |
| [6] |
苏莹莹, 刘莹钰, 张扬雨, 等. 9种中药注射剂联合肝动脉插管化疗栓塞术治疗原发性肝癌的网状Meta分析[J]. 吉林大学学报(医学版), 2016, 42(6): 1126-1131. Su YY, Liu YY, Zhang YY, et al. Network Meta-analysis of 9 kinds of Chinese herb inj ections combined with transcatheter arterial chemoembolization in treatment of hepatocellular carcinoma[J]. J Jilin Univ (Med ed), 2016, 42(6): 1126-1131. DOI:10.13481/j.1671-587x.20160615 |
| [7] |
徐晓卫, 林观样, 袁拯忠, 等. 康莱特联合化疗治疗非小细胞肺癌的系统评价[J]. 中华中医药学刊, 2014, 32(4): 733-739. Xu XW, Lin GY, Yuan ZZ, et al. Kanglaite for treating advanced non-small-cell lung cancer:a systematic review[J]. Chin Archives Tradit Chin Med, 2014, 32(4): 733-739. DOI:10.3779/j.issn.1009-3419.2009.03.018 |
| [8] |
保学明, 卢建华, 伍兆锋, 等. 薏苡仁酯对结肠癌SW480增殖和凋亡的影响[J]. 中华实用诊断与治疗杂志, 2012, 26(3): 260-261. Bao XM, Lu JH, Wu ZF, et al. Effect of coixenolide on the proliferation and apoptosis of SW480 cells in patients with colon cancer[J]. J Chin Pract Diagn Ther, 2012, 26(3): 260-261. DOI:10.16466/j.issn1005-5509.2014.06.039 |
| [9] |
李玉升. 康莱特注射液治疗晚期胰腺癌新进展[J]. 中国肿瘤临床, 2012, 39(16): 1158-1160. Li YS. Progress in advanced pancreatic cancer treatment with Kanglaite injection[J]. Chin J Clin Oncol, 2012, 39(16): 1158-1160. DOI:10.3969/j.issn.1000-8179.2012.16.006 |
| [10] |
谢小红, 顾锡冬, 赵虹. 薏苡仁提取物联合新辅助化疗对局部晚期乳腺癌组织Survivin及Ki-67表达的影响[J]. 浙江中医药大学学报, 2014, 38(6): 671-675. Xie XH, Gu XD, Zhao H, et al. The expression of ki-67 and survivin on focally advanced breast cancer after KLT combined neoadjuvant chemotherapy[J]. J Zhejiang Chin Med Univ, 2014, 38(6): 671-675. DOI:10.16466/j.issn1005-5509.2014.06.039 |
| [11] |
华海清, 秦叔逵. 康莱特治疗原发性肝癌的研究进展[J]. 中国肿瘤临床, 2012, 39(16): 1143-1147. Hua HQ, Qin SK. Advancements in Kanglaite treatment of primary liver cancer[J]. Chin J Clin Oncol, 2012, 39(16): 1143-1147. DOI:10.3969/j.issn.1000-8179.2012.16.002 |
| [12] |
Ouyang L, Shi Z, Zhao S, et al. Programmed cell death pathways in cancer:a review of apoptosis, autophagy and programmed necrosis[J]. Cell Prolif, 2012, 45(6): 487-498. DOI:10.1111/j.1365-2184.2012.00845 |
| [13] |
马红兵, 狄政莉, 何娜, 等. 大蒜素提高人胰腺癌BXPC3细胞放射敏感性的机制研究[J]. 中华放射医学与防护杂志, 2014, 34(10): 743-747. Ma HB, Di ZL, He N, et al. Effect of allicin on radiosensitivity of human pancreatic carcinoma BXPC3 cells[J]. Chin J Radiol Med Prot, 2014, 34(10): 743-747. DOI:10.3760/cma.j.issn.0254-5098.2014.10.006 |
| [14] |
吕品田, 周坤, 王亚珍, 等. 薏苡仁注射液联合X线照射对人肺腺癌细胞A549抑制作用的机制研究[J]. 中国全科医学, 2010, 13(23): 2637-2639. Liu PT, Zhou K, Wang YZ, et al. Inhibiting mechanism of coix lacryma-jobi injection combined with radiotherapy in human lung carcinoma cells A549[J]. Chin Gen Prac, 2010, 13(23): 2637-2639. DOI:10.3969/j.issn.1007-9572.2010.23.038 |
 2017, Vol. 37
2017, Vol. 37


