对于肝功能Child-Pugh分级为A或B级的部分早期肝癌患者可通过局部切除、射频消融术等方法治疗,5年生存率达50%~75%[1]。然而,对于因病灶位置、数目、肝功能、心肺功能、患者意愿等原因无法手术的患者,以及经过手术、射频消融术、经动脉化疗栓塞术(TACE)等对复发的小肝癌患者治疗尚无定论[2-3]。射波刀是立体定向放疗的一种,它采用实时图像引导及同步呼吸追踪系统,实现了对肿瘤病灶进行低分割、大剂量、动态实时跟踪的放疗,治疗精度可达亚毫米级[4]。作为一种高度靶区适形、低损伤、耐受性好的新技术,在肿瘤治疗中应用范围越来越广[5-6]。本研究旨在前瞻性观察射波刀治疗小肝癌的安全性和有效性,为临床选择提供依据。
资料与方法1.患者选择及临床资料
(1) 入组标准:①根据欧洲肝病研究学年会(EASL)标准确诊肝细胞癌,满足3个EASL标准之一即证实为肝细胞癌:组织病理学;超声、MRI、CT和动脉造影其中2项确定病变>2 cm且伴有动脉期强化;1项影像技术确定病变>2 cm伴动脉期强化且甲胎蛋白(AFP)>400 ng/ml。②肝癌患者的肝功能Child-Pugh分级为A级时,单个病灶的最大径不超过5 cm;多个病灶数量不超过3个,每个最大径不超过3 cm;若分级为B级,则病灶为单发,且最大径不超过3 cm。③肝脏病变不宜手术切除或患者拒绝行手术治疗。④预计生存期≥6个月。⑤ECOG评分为0、1或2。⑥白蛋白>2.5 g/dl,总胆红素<3 mg/dl,国际标准化比值<1.5,丙氨酸氨基转移酶、天冬氨酸氨基转移酶不超过正常值上限的3倍,肌酐<2.0 mg/dl。
(2) 排除标准:①既往上腹部放射治疗病史。②肿瘤最大径超过5 cm。③肝功能Child-Pugh分级为C级。④位于不同肝叶的多病灶病变(超过3个)或肝外转移灶。⑤门静脉癌栓。⑥既往6个月曾行全身化疗。⑦入组2周内出现活动性胃肠道出血,存在放射治疗禁忌,明显腹水且临床治疗无效者。⑧同时进行其他同步治疗。
(3) 患者资料:根据以上标准,2014年6月至2016年12月期间在上海长海医院行射波刀治疗的小肝癌患者共33例含33个靶点入组,其中,16例为早期肝癌初治患者因病灶位置、心肺功能、患者意愿等原因无法手术或拒绝手术,17例既往曾行肝脏局部切除术、射频消融术、TACE或多种方法联合治疗后复发,选择射波刀治疗。具体临床资料见表 1,详细治疗参数见表 2。
|
|
表 1 患者的基本资料 Table 1 The characteristics of patients |
|
|
表 2 治疗参数 Table 2 Treatment parameters |
2.治疗方法
(1) 治疗前准备:治疗前所有患者都完成相关检查(肝肾功能、凝血功能、血常规、肿瘤标志物等),并对患者的体能状态进行评估。29个病灶行B超或CT引导下穿刺植入金标(长5 mm,直径0.8 mm)1~2个,同一病灶植入2个金标时,金标间距大于2 cm[7]。29例患者穿刺1周后定位。4例患者拒绝行穿刺或穿刺有禁忌且病灶靠近膈顶,采用肺追踪技术直接定位。
(2) 靶区勾画和放疗计划制定:大体肿瘤体积(GTV)定义为影像学上看到的肿瘤体积,GTV勾画参考患者定位前的CT、MR、PET等影像资料。计划治疗体积(PTV)定义为GTV加上肿瘤的运动范围及摆位误差。确定危及器官,包括:肝脏、脊髓、胃、十二指肠、肺、肾脏等。危及器官限量:肝脏V21 Gy<700 cm3;胃V18 Gy<10 cm3,Dmax<32 Gy;十二指肠V18 Gy<5 cm3,V12.5 Gy<10 cm3,Dmax<32 Gy;肾脏V18 Gy<66.7%;脊髓V23 Gy<0.35 cm3,V14.5 Gy<1.2 cm3,Dmax<30 Gy。
(3) 治疗:29个病灶采用植入金标的呼吸同步追踪技术(synchrony),治疗中随时记录患者的呼吸运动频率和深度,分别建议患者的呼吸运动模型和病灶的四维位置模型,获取信号建立病灶位置在呼吸周期中的动态模型,再对病灶进行实时跟踪照射,大幅减少对肿瘤周围的外放范围。4个病灶采用肺追踪技术,无需穿刺行金标植入,适用于靠近膈顶的病灶。
3.随访与评价:33例患者治疗后每3个月随访1次,患者需复查上腹部增强CT、MR或PET-CT来观察肿瘤治疗后反应。采用实体肿瘤疗效评价标准(mRECIST)对行射波刀治疗的肝癌病灶进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。截止患者死亡日期或随访日期,查看靶病灶的局部控制状态。总生存(OS)为从射波刀治疗开始至死亡或随访截止的时间。局部无进展生存(LPFS)为从射波刀治疗开始至目标病灶出现进展或死亡的时间。疾病无进展生存(DFPS)为从射波刀治疗开始至全身任何一处病灶出现进展、新发转移或死亡的时间。不良反应评价采用常见不良反应事件评价标准(CTCAE)4.0分级标准。
4.统计学处理:采用SPSS 18.0软件进行统计分析,用Kaplan-Meier法计算生存率和局部控制率,并绘制生存曲线,Log-rank检验进行分层比较,Cox回归进行多变量分析。
结果1.随访情况:截止2017年2月25日,随访时间2.3~30.8个月,平均19.3个月。29例患者生存,4例患者死亡。
2.局部控制效果:截止随访日期,根据mRECIST标准,18个病灶(54.5%)CR,7个病灶(21.2%)PR,5个病灶(15.2%)SD,3个(9.1%)PD。总有效率为75.8%,局部控制率为90.9%,中位LPFS 18.8个月(2.3~32.4个月),半年局部控制率为100%,1年局部控制率为100%,2年局部控制率为83.6%(图 1 A)。3例局部进展的患者中,局部控制时间分别为14.0、18.7、21.9个月,均从病灶边缘复发。
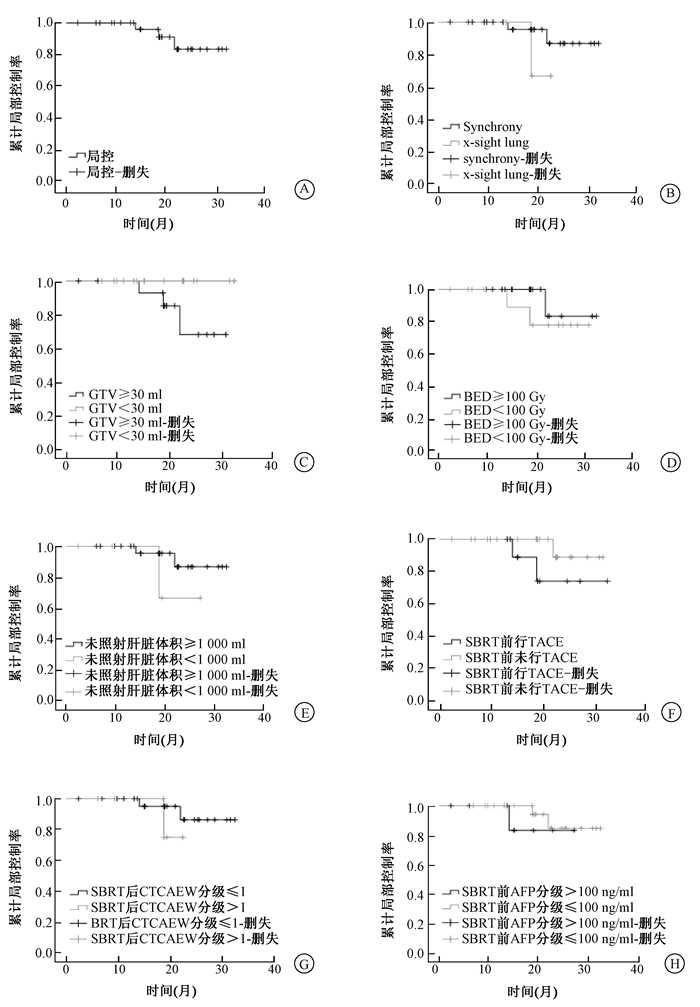
|
图 1 患者的局部控制率分析 A.局部控制率;B.影像引导技术对局部控制率的影响;C.GTV体积对局部控制率的影响;D.BED(按照早反应组织α/β=10计算得出)对局部控制率的影响;E.未照射肝脏体积对局部控制率的影响;F.治疗前行TACE对局部控制率的影响;G.治疗后CTCAE分级对局部控制率的影响;H.治疗前AFP对局部控制率的影响 Figure 1 Local control of patients A. Overall local control; B. Local control depending on image-guided technology; C. Local control depending on GTV; D. Local control depending on biologic equivalent dose (BED10); E. Local control depending on volume of no radiated liver; F. Local control depending on TACE prior SBRT; G. Local control depending on CTCAE after SBRT; H. Local control depending on AFP prior SBRT |
3.生存情况:中位OS为18.9个月(2.3~32.4个月),半年生存率为96.9%,1年生存率为93%,2年生存率为87.2%(图 2 A)。中位DPFS 15个月(2.3~28.5个月),半年DPFS率为93.8%,1年DPFS率为79.2%,2年DPFS率为54.3%。4例死亡的患者中,其中,1例因肺炎死亡,OS为27.1个月;1例因肝硬化导致食管胃底静脉曲张破裂大出血死亡OS为6个月;1例因肝内转移死亡,OS为15个月;1例因肺转移死亡,OS为19.3个月。无一例死于靶病灶局部控制失败或治疗相关不良反应。
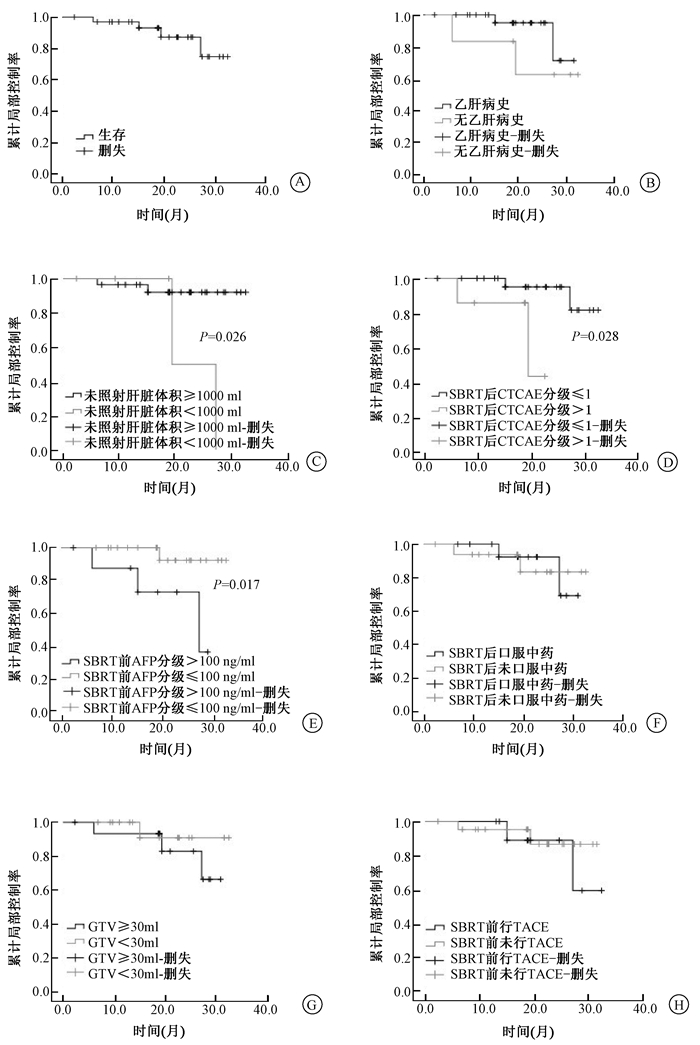
|
图 2 患者的生存率分析 A.生存率;B.乙肝病史对生存率的影响;C.未照射肝脏体积对生存率的影响;D.治疗后CTCAE分级对生存率的影响;E.治疗前的AFP对生存率的影响;F.治疗后口服中药对生存率的影响;G. GTV体积对生存率的影响;H.治疗前行TACE对生存率的影响 Figure 2 Overall survival of patients A. Overall survival in general; B. Overall survival depending on history of hepatitis B; C. Overall survival depending on volume of no radiated liver; D. Overall survival depending on CTCAE after SBRT; E. Overall survival depending on AFP prior SBRT; F. Overall survival depending on traditional chinese medicine after SBRT; G. Overall survival depending on GTV; H. Overall survival depending on TACE prior SBRT |
4.单因素和多因素分析:在单因素分析中,相关因素对局部控制率无明显影响(图 1B-H)。未发现乙肝病史、治疗后口服中药、GTV体积、治疗前行TACE对生存率造成明显影响(图 2B,F~H)。但未照射肝脏体积≥1 000 ml(P=0.026)、治疗前AFP<100 ng/ml(P=0.017)、治疗后CTCAE分级≤1级(P=0.028)均与生存率有关(图 2C-E)。Cox分析未发现相关因素对生存率造成明显影响。
5.不良反应:所有患者均完成治疗,射波刀治疗的不良反应主要为1、2级反应:肝功能损害、乏力、纳差、恶心、呕吐等胃肠道反应和骨髓抑制,1例出现3级肝脏不良反应在治疗半年后缓解,1例出现4级肝脏不良反应在治疗后1年治愈(表 3)。
|
|
表 3 射波刀治疗小肝癌的不良反应 Table 3 Treatment toxicity of CyberKnife in small hepatocellular carcinoma |
6.正常肝受量评估:正常肝脏体积为全肝体积减去PTV体积,平均大小为(1 349.64±348.09)ml。正常肝脏组织受量V5(接受5 Gy以上正常肝脏体积占正常肝组织体积的百分比)、V10、V15、V20、V25及V30分别为(72.92±20.21)%、(46.59±20.85)%、(28.81±16.40)%、(18.53±11.01)%、(13.45±8.23)%及(10.40±6.46)%,单因素分析显示,V5与2级及以上不良反应相关(P=0.015),其中,V5>68.46%可增加2级以上肝脏不良反应发生率[AUC=0.703,P=0.095, 95%CI(0.517~0.890)]。
讨论对于早期原发性肝癌患者首选局部切除术。由于各种临床原因(严重肝硬化、肿瘤位于第一和第二肝门、合并严重并发症、患者拒绝手术等),只有10%~30%的患者选择了手术局部切除[8]。临床上对于未选择手术的小肝癌患者推荐射频消融术,术后肿瘤完全坏死率80%~95%,5年生存率33%~57%[9-10]。但是,射频消融术不适用于肿瘤位置较深、病灶位于肝顶、肿瘤靠近大的血管或胆管、严重肝硬化结节等导致肿瘤在超声下无法显示清楚的情况。对于这些情况,射波刀有其独特优势。此外,射波刀还可用于各种治疗后的残留病灶。
文献报道国内外的多数研究显示了射波刀治疗肝细胞肝癌的良好疗效及安全性[11-13]。Louis等[14]的研究中,25例肝细胞肝癌患者行SBRT治疗,结果,1年局部控制率和总生存率分别达到95%和79%,仅1例患者因十二指肠溃疡发生3级放疗不良反应。本研究中,1年局部控制率为100%,2年局部控制率为83.6%,1年生存率为93%,2年生存率为87.2%,结果与文献报道相仿。Liang等[15]在射波刀治疗肝细胞肝癌不良反应的研究中,共104个肝细胞肝癌患者接受射波刀治疗,平均剂量为(42.81±4.78)Gy(28~55 Gy),单次剂量为8~16 Gy,平均分割次数为(3.31±0.81)Gy(2~6 Gy)。结果,24例患者出现2~3级肝脏不良反应,未出现4级肝脏不良反应。多因素分析显示,V25是发生2~3级肝脏不良反应的独立影响因素(P=0.029)。放疗导致的肝损伤(radiation-induced hepatic toxicity,RIHT)定义为射波刀治疗后3个月内肝功能Child-Pugh评分增加至少2分。该研究中13例(13/104, 12.5%)患者出现RIHT,多因素分析显示正常肝组织是发生RIHT的唯一影响因素(P=0.008)。
本研究主要为1~2级放疗反应,1例(3.0%)出现3级肝脏不良反应在治疗半年后缓解,1例(3.0%)出现4级肝脏不良反应在治疗后1年治愈。然而,单因素分析显示V5与2级及以上不良反应相关,其中,V5>68.46%可增加2级以上肝脏不良反应发生率。未发现V25与发生2~3级肝脏不良反应的相关性。
关于局部控制率的单因素分析,未发现肺追踪技术与植入金标的呼吸同步追踪技术(synchrony)有明显差异。射波刀肺追踪方式,此种追踪方式目前临床上只适用于治疗肺部的肿瘤,无需植入体内金标,基于在建立并跟踪患者呼吸运动的前提下直接跟踪病变部位肿瘤来达到治疗肿瘤的目的。本研究首先尝试将肺追踪应用于肝癌的射波刀治疗中。在病灶位于膈顶的情况下采用该方式追踪,无需金标植入,可大大减少患者金标植入的痛苦,也为有穿刺禁忌的患者另辟蹊径。
本研究中有3个靶病灶出现进展,局部控制时间分别为14.0、18.7、21.9个月,治疗时采用的追踪方式分别为:植入金标的呼吸同步追踪技术、肺追踪技术,均从病灶边缘复发。分析原因可能为:肝细胞肝癌的生长速度较快,靶区边缘存在影像学不可见的亚临床病灶;靶区内剂量分布不均匀;控制14.0个月后复发的病灶处方剂量相对较小:45 Gy/5次,BED(α/β=10)85.5 Gy。因此,建议勾画肝癌的PTV时,在不影响周围危及器官的前提下,在GTV的基础上外扩范围适当增加,且给予足够剂量。
总之,射波刀治疗小肝癌的局部控制率高,局部无进展生存期长,不良反应可耐受,无创伤,可为小肝癌的患者提供治疗选择。本研究属于单中心、单臂研究,样本少,随访时间短,需要进一步随访远期疗效及远期反应,结果有待大样本多中心随机对照研究证实。
利益冲突 本研究在上海长海医院放疗科完成,全体作者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证利益冲突 赵宪芝负责设计研究方案、收集数据后统计和分析,并起草论文;张火俊指导、监督试验进行和修改论文;王晓艳、清水汪协助提供符合入组病例;代智涛、刘永明协助提供物理数据;朱晓斐协助修改论文;居小萍协助提供入组病例及随访工作
| [1] | Bruix J, Sherman M. Management of hepatocellular carcinoma:an update[J]. Hepatology, 2011, 53 (3): 1020-1022. DOI:10.1002/hep.24199. |
| [2] | Willatt JM, Francis IR, Novelli PM, et al. Interventional therapies for hepatocellular carcinoma[J]. Cancer Imaging, 2012, 12 : 79-88. DOI:10.1102/1470-7330.2012.0011. |
| [3] | Graf D, Vallböhmer D, Knoefel WT, et al. Multimodal treatment of hepatocellular carcinoma[J]. Eur J Intern Med, 2014, 25 (5): 430-437. DOI:10.1016/j.ejim.2014.03.001. |
| [4] | Prevost JB, Voet P, Hoogeman M, et al. Four-dimensional stereotactic radiotherapy for early stage non-small cell lung cancer:a comparative planning study[J]. Technol Cancer Res Treat, 2008, 7 (1): 27-33. DOI:10.1177/153303460800700103. |
| [5] | Seisen T, Drouin SJ, Phé V, et al. Current role of image-guided robotic radiosurgery (Cyberknife®) for prostate cancer treatment[J]. BJU Int, 2013, 111 (5): 761-766. DOI:10.1111/bju.12000. |
| [6] | Dieterich S, Gibbs IC. The CyberKnife in clinical use:current roles, future expectations[J]. Front Radiat Ther Oncol, 2011, 43 : 181-194. DOI:10.1159/000322423. |
| [7] |
董洋, 李丰彤, 王境生, 等. 置入软组织金标数目对射波刀系统影像定位精度影响[J].
中华放射肿瘤学杂志, 2010, 19 (5): 465-467. Dong Y, Li FT, Wang JS, et al. Impact of number of implanted fiducials on image target localization accuracy[J]. Chin J Radiat Oncol, 2010, 19 (5): 465-467. DOI:10.3760/cma.j.issn.1004-4221.2010.05.026. |
| [8] | Lau WY, Lai EC. Salvage surgery following downstaging of unresectable hepatocellular carcinoma-a strategy to increase resectability[J]. Ann Surg Oncol, 2007, 14 (12): 3301-3309. DOI:10.1245/s10434-007-9549-7. |
| [9] | Lencioni RA, Allgaier HP, Cioni D, et al. Small hepatocellular carcinoma in cirrhosis:randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection[J]. Radiology, 2003, 228 (1): 235-240. DOI:10.1148/radiol.2281020718. |
| [10] | Dong B, Liang P, Yu X, et al. Percutaneous sonographically guided microwave coagulation therapy for hepatocellular carcinoma:results in 234 patients[J]. AJR Am J Roentgenol, 2003, 180 (6): 1547-1555. DOI:10.2214/ajr.180.6.1801547. |
| [11] | Tao C, Yang LX. Improved radiotherapy for primary and secondary liver cancer:stereotactic body radiation therapy[J]. Anticancer Res, 2012, 32 (2): 649-655. |
| [12] | Meng M, Wang H, Zeng X, et al. Stereotactic body radiation therapy:A novel treatment modality for inoperable hepatocellular carcinoma[J]. Drug Discov Ther, 2015, 9 (5): 372-379. DOI:10.5582/ddt.2015.01056. |
| [13] | O'Connor JK, Trotter J, Davis GL, et al. Long-term outcomes of stereotactic body radiation therapy in the treatment of hepatocellular cancer as a bridge to transplantation[J]. Liver Transpl, 2012, 18 (8): 949-954. DOI:10.1002/lt.23439. |
| [14] | Louis C, Dewas S, Mirabel X, et al. Stereotactic radiotherapy of hepatocellular carcinoma:preliminary results[J]. Technol Cancer Res Treat, 2010, 9 (5): 479-487. DOI:10.1177/153303461000900506. |
| [15] | Liang P, Huang C, Liang SX, et al. Effect of CyberKnife stereotactic body radiation therapy for hepatocellular carcinoma on hepatic toxicity[J]. Onco Targets Ther, 2016, 9 : 7169-7175. DOI:10.2147/OTT.S112290. |
 2017, Vol. 37
2017, Vol. 37


