放射性心脏损伤(radiation-induced heart disease,RIHD)是胸部恶性肿瘤患者严重的放疗不良反应之一,临床表现为心包积液、瓣膜病、充血性心衰等[1]。RIHD的影响因素包括心脏总剂量、受照体积、分割剂量、患者年龄等[2-3]。胸中下段食管癌患者接受胸部放疗时,心脏更易受到高剂量照射,且两侧肺也受到较为均匀的剂量照射,可能引起心肺联合反应[4-8]。
食管癌是中国最常见及主要致死病因之一[9],放化疗综合治疗是不可手术食管癌患者主要治疗方法[10]。随着食管癌患者生存时间的延长,减少放疗对心脏损伤的重要性进一步体现。调强放疗(IMRT)、容积旋转调强放疗(VMAT)及螺旋断层放疗(TOMO)是目前临床主流的放疗技术,这些放疗技术均可在提高肿瘤局部剂量的基础上降低危及器官(organ at risk,OAR)剂量。本研究对胸中下段食管癌患者,分别制作3套放疗计划,分析心脏与肺的剂量分布。
资料与方法1.患者资料:搜集2015年1月至2016年2月在浙江省肿瘤医院接受治疗的15例胸中下段食管癌患者资料,经病理确诊为食管鳞癌,就诊前未接受过放疗或化疗。患者的一般资料见表 1。
|
|
表 1 患者的一般资料 Table 1 The characteristics of patients |
2.模拟定位:所有患者采用胸部热塑膜进行位置固定,在平静呼吸下,患者呈仰卧位,双手高举过头顶,进行增强3D-CT模拟定位扫描。扫描层厚为5 mm,扫描完成后CT图像传输至治疗计划系统。
3.靶区勾画:大体肿瘤体积(gross tumor volume,GTV)和临床靶区(clinical target volume,CTV)由1名肿瘤科医师及1名放射科医师共同确定。GTV定义为CT图像上可见的食管病灶GTV-T及局部增大淋巴结GTV-N(短径>1 cm或气管食管沟淋巴结短径>0.5 cm)。CTV-T在GTV-T基础上上下外扩3 cm,四周外扩0.6 cm,CTV-N包括高危淋巴引流区,当CTV遇到OAR或正常组织结构(如大血管等)可做微小修回。PTV由CTV外扩5 mm形成。OAR包括心脏、心脏亚结构、肺和脊髓。根据Feng等[11]的心脏图谱进行心脏亚结构的勾画。本研究中,勾画的心脏亚结构包括右心房(right atrium,RA)、左心房(left atrium,LA)、右心室(right ventricle,RV)、左心室(left ventricle,LV)、肺动脉(pulmonary artery,PA)、主动脉(aorta,AO)。
4.处方剂量:处方剂量为60 Gy,分割剂量为2 Gy,所有计划剂量限值如下:PTV D95%>95%处方剂量, 肺V20<30%, 平均肺剂量<15 Gy, 平均心脏剂量<20 Gy。
5.治疗计划:IMRT和VMAT计划在RayStation 4.0v系统(RaySearch Laboratories AB)制作,TOMO计划在Tomo HTM Version 2.0.5系统(美国Accuray公司)制作。IMRT计划采用共平面、等中心7野step-and-shot IMRT技术,机架角为210°、300°、320°、0°、40°、60°和150°,7野中每个野平均包括10个子野。VMAT计划采用178°~182°和182°~178°的356°双弧。TOMO计划中每个螺旋包括51个射束。由于本研究为回顾性研究,实际治疗情况为5名患者接受VMAT治疗,10名患者接受IMRT治疗。
6.剂量比较:本研究中需要纳入分析的剂量学参数如下:PTV、心脏、心脏亚结构、肺的最大剂量(maximum dose,Dmax), 平均剂量(mean dose,Dmean);肺的V5、V10、V20、V30、V40、V50, 心脏V5、V10、V20、V30、V40、V50、V60, 脊髓Dmax;适形指数(CI)和均匀性指数(HI)。其中,CI=Vt, ref/Vt×Vt, ref/Vref,Vt, ref为95%处方剂量包括体积,Vt为靶区体积,Vref为参考剂量体积。HI=100×(D2-D98)/Dp,D2和D98为2%和98%的PTV处方剂量,Dp为处方剂量。
7.统计学处理:利用K-S法对数据进行正态分布检验,结果显示均符合正态分布,数据用x±s表示。采用SPSS 23.0软件进行统计学分析,采用独立样本非参数检验的Kruskal-Wallis检查分析PTV及OARs的剂量学参数,H值及P值列出。P<0.05为差异有统计学意义。
结果1.治疗参数:PTV、心脏和肺的体积分别为(399±355)、(671±274)和(3 907±1 717)cm3。
2.PTV剂量:所有的计划均能满足剂量学限制,本研究共统计了IMRT、VMAT和TOMO 3种计划中PTV的Dmax、Dmean、CI和HI,结果见表 2。除Dmax(H= 10.889,P=0.004)外,其他PTV的参数差异均无统计学意义(P>0.05),TOMO计划的Dmax最低,为6 516 (6 352~6 651) cGy。IMRT、VMAT和TOMO在靶区的适形性、均匀性方面差异无统计学意义(P>0.05)。
|
|
表 2 PTV剂量学参数(x±s) Table 2 Dosimetric parameters of PTV(x±s) |
3.心脏剂量:心脏的Dmax、Dmean和V5~V60,心脏亚结构的Dmax和Dmean参数见表 3。在IMRT、VMAT和TOMO中,全心及心脏亚结构剂量学分布相似,仅心脏Dmax(H=7.433,P=0.024)和左心房Dmax (H=12.080, P=0.002)差异有统计学意义,与PTV结果相似,TOMO计划达到最低的全心及左心房的Dmax。如图 1所示,随着受照剂量的增加,受照体积百分比下降的趋势在3套计划中十分相似。
|
|
表 3 心脏及心脏亚单位剂量学参数(cGy,x±s) Table 3 Dosimetric parameters of heart and cardiac units parameters(cGy, x±s) |
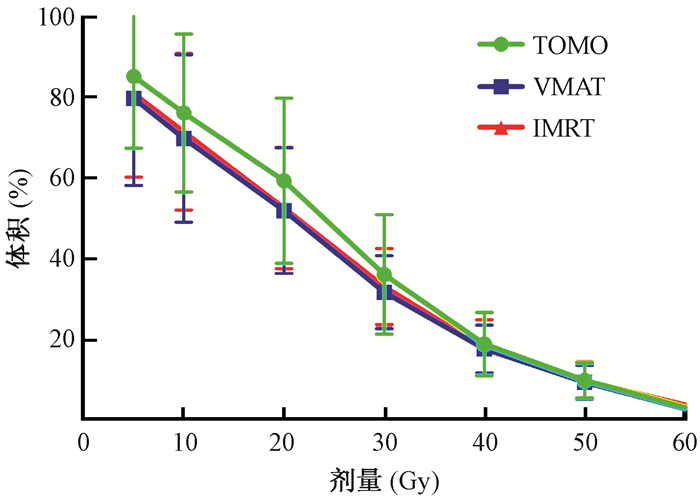
|
图 1 3种治疗计划中心脏的V5、V10、V20、V30、V40、V50、V60 Figure 1 The volume of heart receiving 5, 10, 20, 30, 40, 50 and 60 Gy in 3 kinds of plans |
4.肺剂量:肺的Dmax、Dmean和V5~V50参数见表 4。结果表明,3种计划中,肺的Dmax参数差异有统计学意义(H=11.401, P=0.003),TOMO计划同样得到了最低的剂量学数据。随着肺受照剂量的增高,受照体积百分比下降趋势在3套计划中相似,见图 2。
|
|
表 4 肺剂量学参数(cGy,x±s) Table 4 Dosimetric parameters of lung(cGy, x±s) |
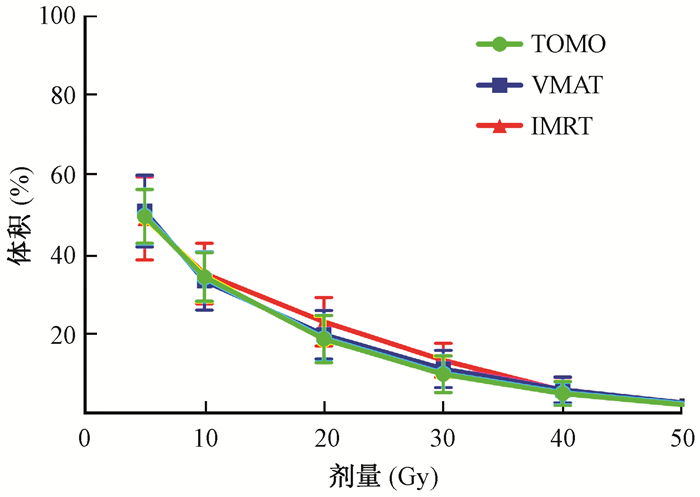
|
图 2 3种治疗计划中肺的V5、V10、V20、V30、V40、V50 Figure 2 The volume of lung receiving 5, 10, 20, 30, 40 and 50 Gy in 3 kinds of plans |
讨论
RIHD概念是在20世纪60年代末提出的,RIHD指电离辐射治疗心脏邻近肿瘤导致的心脏损伤。由于放疗技术、化疗及治疗策略的发展,胸部恶性肿瘤患者的生存有了极大的提高,因而,放疗导致的远期不良反应逐渐体现。目前,RIHD是接受放疗的乳腺癌、霍奇金病和童年肿瘤患者主要致死原因之一。Swerdlow等[13]统计了7 033名于1967—2000年接受治疗的霍奇金病患者,共有166例因心肌缺血导致的死亡,标准死亡比(standardized mortality ratio,SMR)为2.5(95%CI=2.1~2.9),绝对超额风险(absolute excess risk)为125.8/10万人年。在放疗后25年,心肌缺血仍有较高的发生风险。van der Pal等[14]统计了1 362例于1966—1996年确诊的童年时患肿瘤、生存期超过5年的患者,在42例患者中观察到了50例心脏事件。心脏30年特定累积发病率在放化疗后提高至12.6%。在其他胸部恶性肿瘤研究中也可得出类似结论[15-17]。
临床正常组织效应的定量分析(quantitative analyses of normal tissue effects in the clinic,QUANTEC)会议曾总结了RIHD的危险因素,主要包括总剂量、受照体积、分割剂量和其他临床因素,如年龄、心脏病史、蒽环类化疗药物[2]。尽管影响因素复杂,但剂量/体积仍是RIHD的主要影响因素。一些研究发现放射性心脏损伤的剂量反应关系。van Nimwegen等[16]对2 617名于1965—1995年治疗的5年霍奇金病幸存者进行巢式研究,该研究发现,心血管疾病(cardiovascular diseases,CVDs)和心脏平均剂量(mean heart dose,MHD)存在线性关系,相对超额风险为7.4%/Gy (95% CI :3.3%~14.8%)。另一项基于人群的病例对照研究在2 168例乳腺癌患者中开展,研究者发现冠状动脉疾病发生率随着心脏平均剂量呈线性增高,平均增高1 Gy,发生率提高7.4% (95% CI :2.9~14.5,P<0.001)[17]。
自20世纪60年代以来,有关RIHD的研究主要集中于乳腺癌及霍奇金病,原因为这两种疾病生存时间普遍较长。目前,对于不可手术治疗的食管癌患者,同步放化疗为标准治疗模式。由于食管的解剖学特点,放疗可导致食管癌患者的心脏和肺受到较高剂量。Beukema等[18]总结文献发现,有症状的放射性心脏损伤高达10.8%,并且大部分发生在放疗后2年。V40、V45是RIHD的影响因素,在食管癌患者中,RIHD是不可忽视的放射性不良反应,同时,由于食管癌患者3年生存率不高,实际的RIHD发生率及影响可能被低估。一项研究显示,食管癌患者在接受胸部放疗期间,利用99Tcm-甲氧基异丁基异腈单光子发射计算机体层扫描门控心肌灌注成像可以观察到心脏损伤,提示心肌灌注损伤在放疗早期即可发生[19]。
三维适形放疗(3D-CRT)、IMRT、VMAT、TOMO和质子治疗(proton therapy,PT)是现今使用的放疗技术,各种放疗技术有其剂量分布特点。如何能够在保证靶区剂量的同时,降低心脏和肺的剂量仍在研究。Nieder等[20]比较了在两野对穿3D-CRT和4野及7野step-and-shoot IMRT技术,结果发现IMRT可以降低心脏、左心室和降主动脉的剂量。Hoppe等[21]比较11名霍奇金病患者的3D-CRT、IMRT和PT计划,结果表明,PT能够获得心脏及心脏亚结构最低剂量。Bradley等[22]在乳腺癌患者中也得到类似结论。然而,PT在我国应用尚不普遍。Nguyen等[23]比较了远端食管癌患者3D-CRT和TOMO计划,结果显示,TOMO能够降低受照正常组织剂量。在本研究中,比较了胸中下段食管癌IMRT、VMAT和TOMO在心脏与肺的剂量分布。结果显示,这3种放疗技术PTV的CI和HI及OARs的平均剂量差异均无统计学意义,提示对于治疗食管癌患者,这3种放疗技术均为可选方法。
食管癌患者中,OARs主要为心脏、肺和脊髓,有研究表明心脏与肺之间可能存在相互影响。当小鼠受照后,心脏与肺内皮细胞中的ICAM-1和VCAM-1呈持续性增高,提示炎症反应存在[4]。也有研究发现,早期肺功能受损的剂量阈值不仅和肺受照区域有关,也与邻近受照的心脏有关[5]。在本研究中,尽管IMRT、VMAT和TOMO的剂量分布几乎没有差异,但TOMO治疗中PTV、心脏和肺的最大剂量更低,差异有统计学意义。心房、心室各具功能,推测不同心脏亚结构受照会产生不同影响,故分析了心脏亚结构的Dmax和Dmean,结果显示,TOMO仅降低了左心房的Dmax,其他参数差异并无统计学意义。心脏和肺是并联器官,较为普遍接受的观点是,其损伤情况取决于剂量体积参数。但现有的研究表明心肺两者间存在相互影响,其损伤情况是否仅仅取决于剂量体积参数,是否还有其他相关因素,例如,最大剂量,某些特定受照部位等,尚争定论。TOMO技术降低最大剂量,这一点是否会带来后期临床上的优势尚待进一步的研究证实。
本研究为一项回顾性剂量比较研究,比较了食管癌患者的心脏及肺的剂量分布。由于在食管癌患者中,RIHD并未得到重视,纳入的这批食管癌患者并未接受全面的心肺功能检查。本研究纳入患者数量有限,尽管在某些剂量学参数上TOMO技术体现出优势,但趋势并不明显。因此,进一步扩大样本量以及在放疗前后完善患者的心肺功能检查,将会是未来的研究方向。
综上,在胸中下段食管癌患者中,与IMRT和VMAT相比,TOMO技术可以降低PTV、心脏、左心房和肺的最大剂量。由于心脏和肺之间存在潜在的相互反应,TOMO技术可能带来的临床优势尚待进一步研究证实。
利益冲突 全体作者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 孔月负责设计研究方案,收集数据后统计并起草论文;徐裕金、陈梦圆负责数据收集和论文校对;李浦、杨双燕负责放疗计划设计和整理;陈明指导、监督试验进行和修改论文
| [1] | Jaworski C, Mariani JA, Wheeler G, et al. Cardiac complications of thoracic irradiation[J]. J Am Coll Cardiol, 2013, 61 (23): 2319-2328. DOI:10.1016/j.jacc.2013.01.090. |
| [2] | Gagliardi G, Constine LS, Moiseenko V, et al. Radiation dose-volume effects in the heart[J]. Int J Radiat Oncol Biol Phys, 2010, 76 (3 Suppl): S77-85. DOI:10.1016/j.ijrobp.2009.04.093. |
| [3] | Stewart JR, Fajardo LF, Gillette SM, et al. Radiation injury to the heart[J]. Int J Radiat Oncol Biol Phys, 1995, 31 (5): 1205-1211. DOI:10.1016/0360-3016(94)00656-6. |
| [4] | Sievert W, Trott KR, Azimzadeh O, et al. Late proliferating and inflammatory effects on murine microvascular heart and lung endothelial cells after irradiation[J]. Radiother Oncol, 2015, 117 (2): 376-381. DOI:10.1016/j.radonc.2015.07.029. |
| [5] | van Luijk P, Novakova-Jiresova A, Faber H, et al. Radiation damage to the heart enhances early radiation-induced lung function loss[J]. Cancer Res, 2005, 65 (15): 6509-6511. DOI:10.1158/0008-5472.CAN-05-0786. |
| [6] | Ghobadi G, van der Veen S, Bartelds B, et al. Physiological interaction of heart and lung in thoracic irradiation[J]. Int J Radiat Oncol Biol Phys, 2012, 84 (5): e639-646. DOI:10.1016/j.ijrobp.2012.07.2362. |
| [7] | Cella L, Palma G, Deasy JO, et al. Complication probability models for radiation-induced heart valvular dysfunction:do heart-lung interactions play a role?[J]. PLoS One, 2014, 9 (10): e111753 DOI:10.1371/journal.pone.0111753. |
| [8] | Cella L, Liuzzi R, Conson M, et al. Multivariate normal tissue complication probability modeling of heart valve dysfunction in Hodgkin lymphoma survivors[J]. Int J Radiat Oncol Biol Phys, 2013, 87 (2): 304-310. DOI:10.1016/j.ijrobp.2013.05.049. |
| [9] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66 (2): 115-132. DOI:10.3322/caac.21338. |
| [10] | Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer:long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group[J]. JAMA, 1999, 281 (17): 1626-1627. DOI:10.1001/jama.281.17.1623. |
| [11] | Feng M, Moran JM, Koelling T, et al. Development and validation of a heart atlas to study cardiac exposure to radiation following treatment for breast cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79 (1): 10-18. DOI:10.1016/j.ijrobp.2009.10.058. |
| [12] | Cohn KE, Stewart JR, Fajardo LF, et al. Heart disease following radiation[J]. Medicine (Baltimore), 1967, 46 (3): 281-298. DOI:10.1097/00005792-196705000-00003. |
| [13] | Swerdlow AJ, Higgins CD, Smith P, et al. Myocardial infarction mortality risk after treatment for Hodgkin disease:a collaborative British cohort study[J]. J Natl Cancer Inst, 2007, 99 (3): 206-214. DOI:10.1093/jnci/djk029. |
| [14] | van der Pal HJ, van Dalen EC, van Delden E, et al. High risk of symptomatic cardiac events in childhood cancer survivors[J]. J Clin Oncol, 2012, 30 (13): 1429-1437. DOI:10.1200/JCO.2010.33.4730. |
| [15] | Hardy D, Liu CC, Cormier JN, et al. Cardiac toxicity in association with chemotherapy and radiation therapy in a large cohort of older patients with non-small-cell lung cancer[J]. Ann Oncol, 2010, 21 (9): 1825-1833. DOI:10.1093/annonc/mdq042. |
| [16] | van Nimwegen FA, Schaapveld M, Cutter DJ, et al. Radiation dose-response relationship for risk of coronary heart disease in survivors of hodgkin lymphoma[J]. J Clin Oncol, 2016, 34 (3): 235-243. DOI:10.1200/JCO.2015.63.4444. |
| [17] | Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer[J]. N Engl J Med, 2013, 368 (11): 987-998. DOI:10.1056/NEJMoa1209825. |
| [18] | Beukema JC, van Luijk P, Widder J, et al. Is cardiac toxicity a relevant issue in the radiation treatment of esophageal cancer?[J]. Radiother Oncol, 2015, 114 (1): 85-90. DOI:10.1016/j.radonc.2014.11.037. |
| [19] | Zhang P, Hu X, Yue J, et al. Early detection of radiation-induced heart disease using (99m)Tc-MIBI SPECT gated myocardial perfusion imaging in patients with oesophageal cancer during radiotherapy[J]. Radiother Oncol, 2015, 115 (2): 171-178. DOI:10.1016/j.radonc.2015.04.009. |
| [20] | Nieder C, Schill S, Kneschaurek P, et al. Comparison of three different mediastinal radiotherapy techniques in female patients:Impact on heart sparing and dose to the breasts[J]. Radiother Oncol, 2007, 82 (3): 301-307. DOI:10.1016/j.radonc.2006.10.015. |
| [21] | Hoppe BS, Flampouri S, Su Z, et al. Effective dose reduction to cardiac structures using protons compared with 3DCRT and IMRT in mediastinal Hodgkin lymphoma[J]. Int J Radiat Oncol Biol Phys, 2012, 84 (2): 449-455. DOI:10.1016/j.ijrobp.2011.12.034. |
| [22] | Bradley JA, Dagan R, Ho MW, et al. Initial report of a prospective dosimetric and clinical feasibility trial demonstrates the potential of protons to increase the therapeutic ratio in breast cancer compared with photons[J]. Int J Radiat Oncol Biol Phys, 2016, 95 (1): 411-421. DOI:10.1016/j.ijrobp.2015.09.018. |
| [23] | Nguyen NP, Krafft SP, Vinh-Hung V, et al. Feasibility of tomotherapy to reduce normal lung and cardiac toxicity for distal esophageal cancer compared to three-dimensional radiotherapy[J]. Radiother Oncol, 2011, 101 (3): 438-442. DOI:10.1016/j.radonc.2011.07.015. |
 2017, Vol. 37
2017, Vol. 37


