放射治疗是乳腺癌综合治疗的重要组成部分,保乳术后行辅助放射治疗已成为早期乳腺癌的标准治疗方式[1]。辅助放射治疗可以显著提高疾病的局部控制率和总体生存率[2]。然而,由于心脏和肺部分暴露在照射野内,可导致照射靶区周围危及器官如心脏及肺脏等的并发症[3],尤其对于左侧乳腺癌患者。
为减少乳腺癌患者心脏的照射体积和照射剂量,目前国际上常用深吸气屏气技术(deep inspiration breath hold, DIBH),其过程主要可分为:胸式深吸气屏气(thoracic deep inspiration breath hold, T-DIBH),即吸气时主要通过膈肌和胸肌运动而实现的深吸气屏气过程;腹式深吸气屏气(abdominal deep inspiration breath hold, A-DIBH),即吸气时主要通过腹肌运动而实现的深吸气屏气过程[4]。文献报道T-DIBH与A-DIBH导致不同程度的胸廓扩张度,有近2 cm的高度差[5]。
本研究目的是前瞻性研究自由呼吸(free breath, FB)、T-DIBH与A-DIBH3种呼吸模式下,心脏、冠状动脉左前降支(left anterior descending coronary artery, LAD)、肺等危及器官(organ at risks, OARs)的平均受照剂量及受照体积等剂量学参数,重点探索最适用于左侧乳腺癌辅助放射治疗的最佳DIBH模式。
资料与方法1.研究对象:本研究为前瞻性研究,经浙江大学医学院伦理委员会审核通过,所有患者均签署知情同意书。自2016年2月起共连续纳入左侧乳腺癌保乳术后行辅助全乳放疗的患者18例。年龄29~69岁,平均46.9岁,中位年龄48岁。所有患者在行放射治疗定位前两周在专业医师的指导下反复训练DIBH,并实现患者可自由切换两种DIBH模式; 每种DIBH模式均获得满意的可重复性; 每次屏气时间不少于20 s。
2.CT模拟定位:行正式CT模拟定位前,再次训练并评估患者是否能较好的按指示完成T-DIBH和A-DIBH两种深吸气屏气模式;患者仰卧位平躺于体位固定架上(AIO solution),双手上举后握于握杆的固定位置,使患者处于最舒适体位并保证左侧乳腺完全暴露;本研究为了减少对患者呼吸运动的束缚与限制,在此阶段不使用固定体膜;由德国西门子大孔径CT扫描,层厚3 mm,扫描范围为锁骨上区至乳腺皱襞下3~5 cm。所有患者采集3组CT图像,分别为FB组、T-DIBH组和A-DIBH组。采用美国瓦里安公司的实时位置管理系统(real-time position management, RPM)实时监测患者的呼吸情况。监测T-DIBH时,将红外线反射标记放于胸部(剑突下);监测A-DIBH时,将红外线反射标记放于腹部(肚脐与剑突连线的中点)。
3.靶区及危及器官勾画:所有患者均有FB、T-DIBH及A-DIBH模式下的3组CT图像,每组CT图像均需要勾画全乳靶区、心脏、冠状动脉左前降支及左侧肺脏。放射治疗医师依据体表定位标志、CT图像及丹麦乳腺癌协作组(DBCG)图谱勾画全乳腺临床靶区CTV[6]。所有靶区均由1名放射治疗医师勾画,随后由高年资医师审核靶区,以减少不同医师勾画靶区间的差异性,便于比较患者在不同呼吸模式下的放射治疗计划。
4.治疗计划设计:使用美国Varian公司的Eclipse治疗计划系统优化放疗计划,分别在FB、T-DIBH及A-DIBH模式下进行计划设计。照射方式为适形放疗,设置2个主切线野,采用野中野技术,每个切线野分为2~3个子野,调整优化各野剂量权重,提高靶区剂量均匀性,降低心脏、冠状动脉左前降支和肺脏的受照体积,要求消除105%处方剂量的高剂量区域,同时95%的等剂量曲线至少包绕>95%的靶区体积。处方剂量为50 Gy,200 cGy/次,共25次。
5.研究参数:不同呼吸模式下的靶区及各危及器官的体积;不同呼吸模式下的靶区平均剂量及均匀指数(homogeneity index, HI), HI=(D2%-D98%)/D×100%;不同呼吸模式下心脏、LAD、同侧肺的平均受照剂量,以及受照大于相应剂量的体积百分比,如V10(%)即为受照大于10 Gy的体积百分比等。
6.统计学处理:采用SPSS 17.0统计软件进行数据分析。剂量参数非正态分布,所有数据用x±s表示。采用配对秩和检验(2-sided Wilcoxon signed rank test)分析各组间参数。P<0.05为差异有统计学意义。
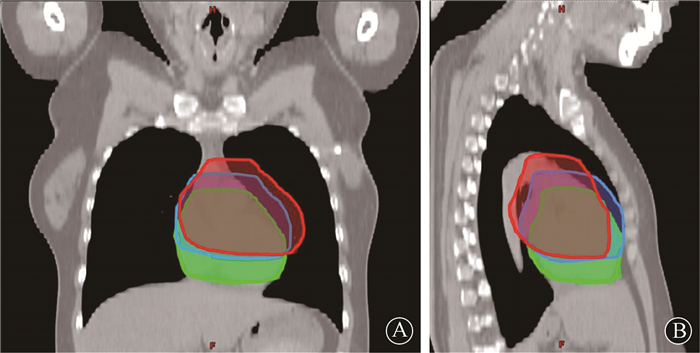
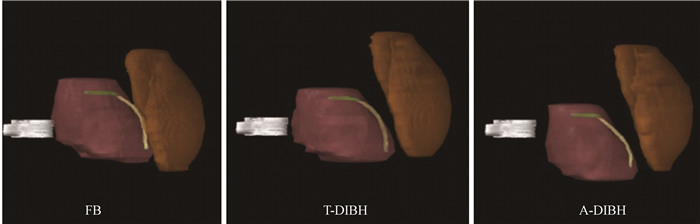
结果1.靶区及各危及器官的空间变化:心脏在不同的呼吸模式中所处的空间位置发生变化,心脏在T-DIBH状态下较FB状态下更加向足侧下移,在A-DIBH状态时较T-DIBH状态下进一步向足侧下移,见图 1。以T7椎体作为参照物,在T-DIBH状态下,心脏、LAD均向足侧下移,且在A-DIBH状态时,进一步下移。心脏及LAD这两个危及器官与乳腺靶区的距离也随着心脏及LAD的下移而进一步增大,见图 2。
|
图 1 3种呼吸模式下,心脏所处不同空间位置示意图 A.冠状位; B.矢状位 注:红色.自由式呼吸模式;蓝色. T-DIBH呼吸模式;绿色. A-DIBH呼吸模式 Figure 1 The relative spatial position relationships of the heart during 3 different breathing maneuvers A.Coronal section; B.Sagittal section |
|
图 2 3种呼吸模式下乳腺靶区、心脏及LAD相对第7胸椎的位置 注:银色.第7胸椎;红色.心脏;黄色.冠状动脉左前降支(LAD);橙色.乳腺;FB.自由呼吸模式,T-DDBH.胸式深吸气屏气模式,A-DIBH.腹式深吸气屏气模式 Figure 2 The relative spatial position relationships of the breast CTV (orange), heart (red), LMCA (green), and (LAD) (yellow) in a typical patient during 3 different breathing maneuvers. A vertebral body (T7) (silver) is contoured as a position marker in the shown case |
2.靶区及各危及器官的体积变化:FB、T-DIBH及A-DIBH 3种呼吸模式下,靶区的体积、LAD体积变化差异均无统计学意义(P>0.05);心脏的体积在T-DIBH与A-DIBH状态下显著小于其在FB状态下(W=171,P<0.05),而在T-DIBH与A-DIBH状态下心脏的体积差异无统计学意义(P>0.05);同侧肺的体积在T-DIBH与A-DIBH状态下显著大于在其FB状态下(W=171,P<0.05),且其在A-DIBH状态下显著大于其在T-DIBH状态下(W=171,P<0.05)。见表 1。
|
|
表 1 乳腺癌保乳术后行辅助全乳放疗的患者3种呼吸模式下靶区及危及器官剂量学比较(x±s) Table 1 Dose and volume comparisons among 3 different breathing models of 18 patients(x±s) |
3.靶区剂量分布:FB、T-DIBH及A-DIBH3种呼吸模式下,乳腺的靶区体积、平均受照剂量、均匀指数差异均无统计学意义(P>0.05)。
4.危及器官剂量分布:如表 1所示,T-DIBH及A-DIBH两种呼吸模式下的心脏、LAD、同侧肺的平均受照剂量均明显低于FB状态(W=171,P<0.05);T-DIBH与A-DIBH两种呼吸模式比较,A-DIBH呼吸模式在心脏、LAD及同侧肺的平均受照剂量明显低于T-DIBH呼吸模式(W=171,P<0.05)。
讨论乳腺癌是女性最常见的恶性肿瘤,严重危害女性健康[1]。与乳腺癌根治术或改良根治术相比,保乳术后辅助放疗取得相同的疗效,并可以最大程度的保留良好的乳房外形,可促进患者取得较为满意的生活质量,故具有巨大的临床价值与社会意义。随着放疗技术及放疗设备的发展进步,心脏的照射剂量在不断降低,由于放疗造成的放射性心脏损伤需要在相当长的时间才能表现出来。因此,放疗实际过程需在不降低靶区受照剂量的均匀性、覆盖性、保证剂量强度的前提下,尽量降低心脏的受照剂量,特别是心脏前区(有LAD)的受照剂量,从而进一步降低患者远期出现缺血性心脏病的死亡风险[2-3]。其关键的心前区结构,如冠状动脉左前降支与胸壁距离较近,受照后更易导致心脏灌注异常而导致远期心血管病发病率增加,甚至可导致死亡[3]。研究表明,心脏受照剂量与发生缺血性心脏病的比例呈剂量效应关系,心脏平均受照剂量每增加1 Gy会增加4%的患心脏病风险,并增加7.4%的患冠状动脉相关事件的风险[3]。放疗对于心脏产生的不良反应通常发生在放疗后数十年,临床表现主要以心肌梗死和冠状动脉狭窄为常见[3]。
既往的研究表明,深吸气屏气技术在乳腺癌放疗中的应用,不仅可以减少或消除因呼吸而造成的靶区位移,更重要的是能减少靶区周围重要组织器官如心脏、LAD的照射体积和剂量,减少辐射损伤[4, 7-13]。DIBH技术首次由Sixel等[14]于2001年提出,其实现形式包括主动呼吸控制(active breathing coordinator, ABC)[14]、实时位置管理系统(real-time position management, RPM)[15]、自主呼吸配合(voluntary breath-hold)[16]等。本研究中,采用RPM方式,患者依从性好,可以很好的配合。
本研究中,T-DIBH和A-DIBH均可以使心脏和LAD向足侧下移,从而远离乳腺靶区,减少受照剂量。A-DIBH由腹肌带动深吸气后屏气,心脏和LAD可以更好的向足侧下移,远离乳腺靶区。而T-DIBH由膈肌及胸肌带动深吸气后屏气,心脏和LAD虽然也会向足侧下移,但下移的程度较A-DIBH少,本文首次比较T-DIBH与A-DIBH间的差别。在DIBH状态下,心脏体积均有所减少,这和深吸气后肺部压力增大而导致心脏受压有关。在DIBH状态下,左肺的体积明显增加,尤其是A-DIBH模式下,肺部体积增加超过70%,可以有效的降低实际收到照射的肺部体积占比,而减低肺的受量,这与既往单纯研究FB与DIBH两种状态的文献报道基本相符[7-8]。
本研究建立在靶区受照剂量及靶区剂量均匀性不影响的大前提下。重点比较了3种呼吸模式下,心脏、LAD及左肺的受照剂量,其中心脏的平均剂量从FB状态下的3.21 Gy降至T-DIBH状态下的1.74 Gy(约45.79%),再降至A-DIBH状态下的1.31 Gy(约59.19%);LAD的平均剂量从FB状态下的34.61 Gy降至T-DIBH状态下的14.38 Gy(约58.45%),再降至A-DIBH状态下的9.21 Gy(约73.39%);左肺的平均剂量从FB状态下的8.31 Gy降至T-DIBH状态下的7.46 Gy(约10.23%),再降至A-DIBH状态下的6.89 Gy(约17.09%)。
综上所述,相比于FB呼吸模式,左侧乳腺癌保乳术后行深吸气屏气呼吸(T-DIBH或A-DIBH)管理具有显著降低各危及器官照射剂量的优势,具有广阔的临床应用价值;相比于T-DIBH呼吸模式,A-DIBH呼吸模式展现出了更加显著的降低各危及器官照射剂量的优势,在临床工作中应加强患者呼吸模式培训及训练,尽量训练患者采用A-DIBH呼吸模式,以期获得最佳的保护乳腺周围正常组织的效果;A-DIBH在乳腺癌放疗中的应用,不仅可以减少或消除因呼吸而造成的靶区位移,更重要的是能进一步减少靶区周围重要组织器官如心脏、LAD及同侧肺的照射体积和剂量,减少辐射损伤,有望进一步减少放疗并发症的发生,提高放疗的精确性,改善患者的长期生存质量。
利益冲突 所有作者以及基金无任何利益冲突,未接受任何不当的职务或财务利益作者贡献声明 赵峰负责患者宣教培训、靶区勾画及论文撰写;陆中杰负责数据统计及论文撰写;姚国荣、卜路懿、葛迦及宁丽华负责患者招募及患者宣传培训、呼吸模式验证及数据采集;严森祥负责靶区勾画确认为、整体实验设计、论文撰写指导及修改
| [1] | Kirova YM. Radiation therapy (RT) after breast-conserving surgery (BCS) in 2015-The year of radiation therapy advances[J]. Eur J Surg Oncol, 2016, 42 (4): 437-440. DOI:10.1016/j.ejso.2016.01.017. |
| [2] | Darby S, McGale P, Correa C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death:meta-analysis of individual patient data for 10, 801 women in 17 randomised trials[J]. Lancet, 2011, 378 (9804): 1707-1716. DOI:10.1016/S0140-6736(11)61629-2. |
| [3] | Darby S C, Ewertz M, Mcgale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer[J]. N Engl J Med, 2013, 368 (11): 987-998. DOI:10.1056/NEJMoa1209825. |
| [4] | Boda-Heggemann J, Knopf AC, Simeonova-Chergou A, et al. Deep inspiration breath hold-based radiation therapy:a clinical review[J]. Int J Radiat Oncol Biol Phys, 2016, 94 (3): 478-492. DOI:10.1016/j.ijrobp.2015.11.049. |
| [5] | Plathow C, Zimmermann H, Fink C, et al. Influence of different breathing maneuvers on internal and external organ motion:use of fiducial markers in dynamic MRI[J]. Int J Radiat Oncol Biol Phys, 2005, 62 (1): 238-245. DOI:10.1016/j.ijrobp.2005.01.042. |
| [6] | Nielsen MH, Berg M, Pedersen AN, et al. Delineation of target volumes and organs at risk in adjuvant radiotherapy of early breast cancer:national guidelines and contouring atlas by the Danish Breast Cancer Cooperative Group[J]. Acta Oncol, 2013, 52 (4): 703-710. DOI:10.3109/0284186X.2013.765064. |
| [7] | Lin A, Sharieff W, Juhasz J, et al. The benefit of deep inspiration breath hold:evaluating cardiac radiation exposure in patients after mastectomy and after breast-conserving surgery[J]. Breast Cancer, 2017, 24 (1): 86-91. DOI:10.1007/s12282-016-0676-5. |
| [8] | Hepp R, Ammerpohl M, Morgenstern C, et al. Deep inspiration breath-hold (DIBH) radiotherapy in left-sided breast cancer:dosimetrical comparison and clinical feasibility in 20 patients[J]. Strahlenther Onkol, 2015, 191 (9): 710-716. DOI:10.1007/s00066-015-0838-y. |
| [9] | Register S, Takita C, Reis I, et al. Deep inspiration breath-hold technique for left-sided breast cancer:An analysis of predictors for organ-at-risk sparing[J]. Med Dosim, 2015, 40 (1): 89-95. DOI:10.1016/j.meddos.2014.10.005. |
| [10] | Mulliez T, Veldeman L, Speleers B, et al. Heart dose reduction by prone deep inspiration breath hold in left-sided breast irradiation[J]. Radiother Oncol, 2015, 114 (1): 79-84. DOI:10.1016/j.radonc.2014.11.038. |
| [11] | Swamy S T, Radha C A, Kathirvel M, et al. Feasibility study of deep inspiration breath-hold based volumetric modulated arc therapy for locally advanced left sided breast cancer patients[J]. Asian Pac J Cancer Prev, 2014, 15 : 9033-9038. DOI:10.7314/apjcp.2014.15.20.9033. |
| [12] | Rong Y, Walston S, Welliver MX, et al. Improving intra-fractional target position accuracy using a 3D surface surrogate for left breast irradiation using the respiratory-gated deep-inspiration breath-hold technique[J]. PloS One, 2014, 9 : e97933 DOI:10.1371/journal.pone.0097933. |
| [13] | Alderliesten T, Betgen A, Elkhuizen PHM, et al. Estimation of heart-position variability in 3D-surface-image-guided deep-inspiration breath-hold radiation therapy for left-sided breast cancer[J]. Radiother Oncol, 2013, 109 (3): 442-447. DOI:10.1016/j.radonc.2013.09.017. |
| [14] | Sixel KE, Aznar MC, Ung YC. Deep inspiration breath hold to reduce irradiated heart volume in breast cancer patients[J]. Int J Radiat Oncol Biol Phys, 2001, 49 (1): 199-204. DOI:10.1016/s0360-3016(00)01455-3. |
| [15] | Pedersen AN, Korreman S, Nyström H, et al. Breathing adapted radiotherapy of breast cancer:reduction of cardiac and pulmonary doses using voluntary inspiration breath-hold[J]. Radiother Oncol, 2004, 72 (1): 53-60. DOI:10.1016/j.radonc.2004.03.012. |
| [16] | Nakamura K, Shioyama Y, Nomoto S, et al. Reproducibility of the abdominal and chest wall position by voluntary breath-hold technique using a laser-based monitoring and visual feedback system[J]. Int J Radiat Oncol Biol Phys, 2007, 68 (1): 267-272. DOI:10.1016/j.ijrobp.2006.12.046. |
 2017, Vol. 37
2017, Vol. 37


