2. 473000 南阳, 郑州大学附属南阳医院 南阳市中心医院肿瘤内科;
3. 473000 南阳, 郑州大学附属南阳医院 南阳市中心医院放疗科;
4. 473000 南阳, 郑州大学附属南阳医院 南阳市中心医院肝脏外科;
5. 430022 武汉, 华中科技大学同济医学院附属协和医院胰腺外科
2. Department of Oncology, Nanyang Hospital Affiliated to Zhengzhou University, Nanyang 473000, China;
3. Department of Radiotherapy, Nanyang Hospital Affiliated to Zhengzhou University, Nanyang 473000, China;
4. Department of Liver Surgery, Nanyang Hospital Affiliated to Zhengzhou University, Nanyang 473000, China;
5. Department of Pancreatic Surgery, Union Hospital Affiliated to Tongji Medical College of Huazhong University of Science and Technology, Wuhan 430022, China
胰腺癌是一种严重危害人类生命健康的疾病,胰腺癌的发生与环境、职业、生活习惯、遗传等多种因素有关,并且其在早期的临床症状不明显,大多数患者在确诊时已经是胰腺癌的晚期,耽误了最佳的治疗时机[1]。随着基因技术的不断发展,基因靶向治疗癌症已经成为了目前癌症治疗的重要途径。程序性细胞死亡4(programmed cell death 4, PDCD4)是一种能够调控细胞死亡的蛋白,PDCD4蛋白在肿瘤组织中表达下降[2-3]。有研究表明,PDCD4参与肝癌、胃癌、卵巢癌、胰腺癌等细胞的生长和凋亡过程,并且能够影响其放射敏感性[4-7]。本研究旨在探讨PDCD4对胰腺癌细胞放射敏感性的影响,以期为提高胰腺癌放射敏感性提供理论依据。
材料与方法1.组织及细胞:选取2011年2月—2016年8月在河南省南阳市中心医院和华中科技大学附属协和医院确诊并切除的胰腺癌患者的胰腺癌组织和对应的癌旁组织各50份,所有患者在切除手术前均没有接受放化疗,患者年龄41~68岁,所有组织的采集均经过患者及家属同意,组织采集后投放于液氮中保存。胰腺癌细胞Sw1990购于上海继和生物科技有限公司。
2.主要仪器及试剂:sc-12584羊抗人PDCD4多克隆抗体、sc-393501小鼠抗人β-连环蛋白(β-catenin)多克隆抗体、sc-764小鼠抗人c-myc多克隆抗体、sc-22171小鼠抗人活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)多克隆抗体、sc-26054辣根过氧化物标记的二抗均购于美国Stanta Cruz;紫外分光光度计购于美国Thermo公司;PDCD4过表达载体pIRES2-PDCD4、空载体pIRES2均由广州辉骏生物科技有限公司合成鉴定;RT-PCR试剂盒、细胞蛋白提取试剂盒、组织蛋白提取试剂盒、RNA提取试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒均购于美国Promega公司。
3. RT-PCR检测细胞中PDCD4的表达:取胰腺癌组织和对应的癌旁组织,剪碎后,用RNA提取试剂盒提取组织中的RNA,紫外分光光度计检测RNA样品的浓度及纯度。按照RT-PCR试剂盒操作说明书检测PDCD4的表达水平,以β-肌动蛋白为内参,以2-△△Ct方法计算目的基因的表达。PDCD4上游引物为5′GTGCCAACCAGTCCAA3′,下游引物5′TTCCCCTCCAATGCTA3′。β-肌动蛋白上游引物为5′CCAGCCATGTACGTTGCTATC3′,下游引物5CAGGTCCAGCCGACGGATGGC3′。反应条件为:95℃,5 min;94℃,30 s;50℃,45 s;72℃,60 s,共30个循环,72℃,10 min;4℃,10 min。
4. Western blot检测细胞中PDCD4的表达:取胰腺癌组织和对应的癌旁组织,用组织蛋白提取试剂盒提取组织中的总蛋白,BCA蛋白浓度检测试剂盒检测提取的蛋白浓度。蛋白凝胶用12%的分离胶和5%的浓缩胶,将蛋白样品与2×上样缓冲液按照等体积混合后,煮沸5 min,每孔中加入20 μl的变性蛋白样品,在浓缩胶中电泳电压为60 V,在分离胶中的电压用100 V,观察溴酚蓝即将要到达分离胶的底端时,终止电泳。取出蛋白凝胶,100 V电压转膜80 min后,在37℃用5%脱脂奶粉封闭60 min后,在4℃与1:500倍稀释的羊抗人PDCD4多克隆抗体孵育过夜后,加入1:1 000倍稀释的辣根过氧化物标记的二抗在37℃孵育60 min。滴加显色液,X胶片曝光后,Bio-Rad采集图片后,以β-肌动蛋白为参照,Quantity One图像分析目的蛋白表达水平。
5.细胞培养及转染:胰腺癌细胞用含有10%胎牛血清的RPMI 1640细胞培养液培养,培养条件为37℃,5% CO2培养箱,用0.25%的胰蛋白酶消化传代。培养至对数生长期后,胰蛋白酶消化后,以5×103/ml接种到6孔细胞培养板中培养过夜,观察融合度达到70%后,更换为不含有胎牛血清的培养液孵育1 h,按照Lipofectamine 2000转染试剂说明书将pIRES2-PDCD4、pIRES2转染至胰腺癌细胞中,培养48 h后,RT-PCR和Western blot检测细胞中PDCD4表达水平,将转染pIRES2-PDCD4、pIRES2后的细胞分别命名为pIRES2-PDCD4组、pIRES2组,同时以只加入转染试剂的组为未转染组。
6.流式细胞仪检测细胞凋亡:取pIRES2-PDCD4组、pIRES2组和未转染组的细胞,经过8 Gy剂量(6 MV高能X射线,剂量率2 Gy/min,10 cm×10 cm照射野,源皮距为100 cm)照射处理后,培养48 h。收集106个细胞,用150 μl的结合缓冲液重悬后,各加入膜联蛋白V-FITC(Annexin V-FITC)和碘化丙啶(propidium iodide,PI)5 μl,孵育20 min。加400 μl的结合缓冲液,流式细胞仪检测凋亡情况,实验重复3次,取均值。
7.细胞克隆实验:取pIRES2-PDCD4组和pIRES2组的细胞,分别用0、2、4、6、8 Gy剂量照射细胞后,培养12 d,待细胞培养板中出现细胞克隆后,弃去细胞培养液,甲醇固定20 min,室温下干燥后,用含有结晶紫浓度为1%的乙醇染色,洗涤、干燥,在显微镜下观察数目>50的细胞克隆数目,计算细胞克隆形成率。利用GraphPad Prism软件进行曲线拟合,绘制存活曲线,采用单击多靶模型计算放射生物学参数平均致死量(D0,存活曲线斜率的倒数),准阈剂量(Dq,存活曲线直线部分向上延伸与通过细胞存活率为1对应的横轴交叉处的剂量),外推值(N)。单击多靶模型公式为:S=1-(1-e-D/D0)N,D为辐射剂量,e为自然对数的底,S为细胞存活率。克隆形成率=100%×克隆数/接种细胞数,存活分数(SF)=100%×受照射细胞克隆形成率/对照细胞克隆形成率。放射增敏比=单纯照射组D0或者Dq+转染组D0或者Dq。
8.Western blot检测细胞中β-连环蛋白、c-myc、Cleaved Caspase-3表达水平:参照材料与方法4,Western blot检测pIRES2-PDCD4组、pIRES2组和未转染组的细胞经过8 Gy剂量照射后48 h,细胞中β-连环蛋白、c-myc、Cleaved Caspase-3表达水平,β-连环蛋白、c-myc、Cleaved Caspase-3多克隆抗体均稀释800倍,辣根过氧化物标记的二抗稀释1 000倍。
9.统计学处理:实验数据以x±s表示。采用SPSS 22.0软件进行分析。两组数据比较经正态性检验符合正态分布采用t检验。P<0.05为差异有统计学意义。
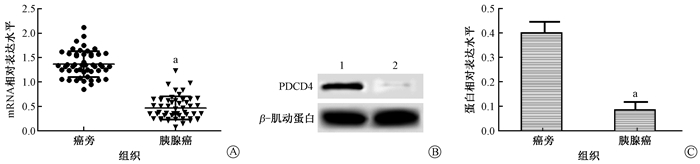
结果1.组织中PDCD4表达结果:检测结果见图 1中所示,胰腺癌组织中PDCD4的mRNA水平和蛋白水平均明显低于癌旁组织,差异有统计学意义(t=4.869、9.208,P<0.05)。PDCD4在胰腺癌组织中表达下调。
|
图 1 胰腺癌组织及癌旁组织中PDCD4的表达 A.mRNA相对表达水平;B.Western blot结果;C.蛋白相对表达水平 注:a与癌旁组织相比,t=4.869、9.208,P<0.05;1.癌旁组织,2.胰腺癌组织 Figure 1 Expression of PDCD4 in pancreatic cancer tissues and adjacent tissues A.Relative expression level of mRNA; B.Results of Western blot assay; C. Relative expression level of protein |
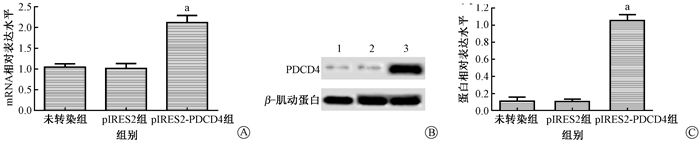
2.转染后的细胞中PDCD4的表达结果:如图 2中所示。未转染组、pIRES2组细胞中PDCD4 mRNA和蛋白表达水平均没有明显差异(P>0.05)。而pIRES2-PDCD4组细胞中PDCD4 mRNA和蛋白表达水平均明显高于未转染组,差异有统计学意义(t=9.074、18.927,P<0.05)。pIRES2-PDCD4能够成功过表达胰腺癌细胞中PDCD4水平。
|
图 2 转染后的细胞中PDCD4的表达 A.mRNA相对表达水平;B.Western blot结果;C.蛋白相对表达水平 a与未转染组相比,t=9.074、18.927,P<0.05;1.未转染组;2.pIRES2组;3.pIRES-PDCD4组 Figure 2 Expression of PDCD4 in transfected cells A. Relative expression level of mRNA; B. Results of Western blot assay; C. Relative expression level of protein |
3.细胞凋亡检测结果:未转染组、pIRES2组和pIRES2-PDCD4组细胞经放疗处理后,统计其凋亡率依次为(26.58±3.64)%、(27.08±3.29)%、(48.65±9.76)%,过表达PDCD4后的胰腺癌细胞经照射处理后凋亡增多。未转染组、pIRES2组和pIRES2-PDCD4组细胞经照射处理后细胞中Cleaved Caspase-3表达水平依次为:0.98±0.06、0.99±0.06、1.45±0.19,过表达PDCD4后的胰腺癌细胞经照射处理后Cleaved Caspase-3蛋白表达增多。
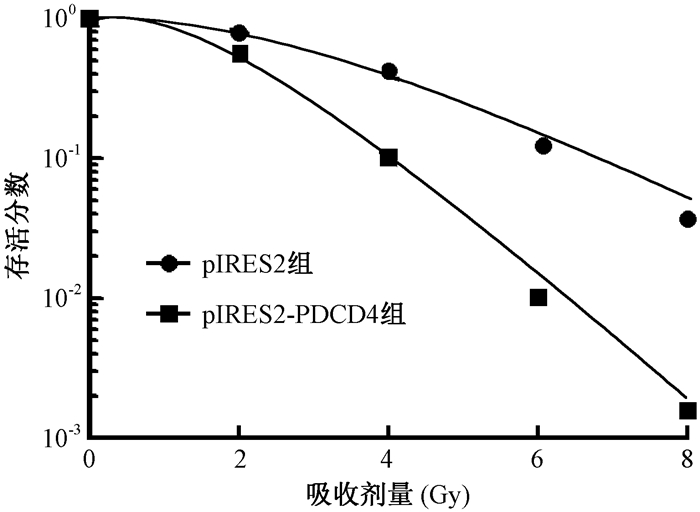
4.放射敏感性:绘制细胞生存曲线,结果见图 3。表 1中所示,pIRES2-PDCD4组细胞存活分数下降,放射增敏比为1.843。
|
图 3 各组细胞存活曲线 Figure 3 The cell survival curves of two groups |
|
|
表 1 单击多靶模型参数值 Table 1 Parameter values of the one-hit multi-target model |
5. β-连环蛋白、c-myc表达检测结果:统计未转染组、pIRES2组和pIRES2-PDCD4组经放疗处理后细胞中β-连环蛋白表达水平依次为:0.59±0.08、0.60±0.04、0.15±0.02,未转染组、pIRES2组和pIRES2-PDCD4组细胞经照射处理后细胞中c-myc表达水平依次为:0.52±0.04、0.50±0.09、0.10±0.01。过表达PDCD4照射处理后能够抑制β-连环蛋白和c-myc的表达。
讨论PDCD4是一种近年来发现的抑癌基因。Mao等[8]研究表明,PDCD4在人肝癌细胞株MHCC-97H、MHCC-97 L和Hep3B中的表达水平均低于人正常的肝细胞株L02,并通过转染PDCD4真核表达载体发现,PDCD4能够将肝癌细胞的凋亡率从10%提高到40%,凋亡率增加了3倍。张霞[9]用RT-PCR、免疫组织化学两种方法分别检测了卵巢癌组织和正常的卵巢中PDCD4的表达发现,PDCD4在卵巢癌组织中的表达异常下调甚至缺失,而外源性的PDCD4能够提高卵巢癌细胞的凋亡率,并且能够提高卵巢癌细胞对顺铂的敏感性。Huang等[10]研究表明,PDCD4能够促进胃癌MKN28、SGC7901、BGC823的凋亡,并且对其放射敏感性也具有增强作用。后续的研究均报道了PDCD4在肺癌、舌鳞癌、骨肉瘤、胃癌等多种癌症中的抑制作用[11-14]。之前的研究表明,PDCD4能够促进胰腺癌细胞凋亡[14]。Jiang等[15]研究表明,miR-21可以通过靶向PDCD4基因影响非小细胞肺癌细胞的放射敏感性。
真核生物的翻译过程极其复杂,三联复合体和eIF4F复合物是翻译的起始,该三联体复合物由蛋氨酸tRNA、eIF2等形成,能够与核糖体特异性结合成一个7-甲基-GTP帽子的mRNA,而eIF4F复合物与三联体复合物结合后能够启动翻译过程。PDCD4含有2个MA-3结构,该结构域与真核生物细胞翻译起始因子(eIF)的通能相同,这样就导致PDCD4能够竞争性的阻碍eIF4F和eIF4G的结合[16]。本研究结果发现,胰腺癌组织中PDCD4基因和蛋白的表达水平均低于正常的癌旁组织,过表达PDCD4能够协同放疗促进胰腺癌细胞的凋亡,增加胰腺癌细胞的放射敏感性,增敏比达到1.843。
细胞凋亡的发生与细胞内的多种信号通路及基因的表达有关,是一个复杂而严格的过程。Wnt信号通路在胚胎发育、心血管系统、消化系统、脑组织等组织器官中均广泛存在,并且在癌症、脑缺血、心肌缺血、重症肺炎等疾病的发生过程中也至关重要[17-18]。有研究表明,Wnt信号通路在胃癌、肝癌等癌组织中异常激活,而通过抑制其关键基因β-连环蛋白的表达后,癌细胞的生长受到抑制,凋亡增多,Wnt信号通路的下游靶基因c-myc的表达也明显减少[19-20]。Caspase-3是Caspase级联反应的执行因子,Caspase级联反应激活后能够促进细胞凋亡的发生,因此Caspase-3的活化水平的高低与细胞凋亡密切相关[21]。本研究检测了过表达PDCD4的胰腺癌细胞经过放射处理后β-连环蛋白、c-myc及Caspase-3的活化水平发现,过表达PDCD4的胰腺癌细胞中的β-连环蛋白、c-myc水平明显降低,而Caspase-3的活化水平升高。这提示,PDCD4对胰腺癌的作用机制可能与Wnt信号通路有关。
综上所述,PDCD4能够增加胰腺癌细胞的放射敏感性,对胰腺癌细胞凋亡具有促进作用,而Wnt信号通路是其可能的作用机制。本研究只在体外细胞实验探讨了PDCD4的作用,并没有在体内进行验证,后续会在体内和体外对其作用机制进行进一步的探讨。这为胰腺癌的治疗提供了新思路和理论基础。
利益冲突 无作者贡献声明 倪猛负责实验设计、资料收集和论文撰写;殷涛参与资料收集审校;李明、杨峥、刘驰负责实验实施;樊宏伟负责实验评估
| [1] | Waddell N, Pajic M, Patch AM, et al. Whole genomes redefine the mutational landscape of pancreatic cancer[J]. Nature, 2015, 518 (7540): 495-501. DOI:10.1038/nature14169. |
| [2] | Jo SH, Kim DE, Clocchiatti A, et al. PDCD4 is a CSL associated protein with a transcription repressive function in cancer associated fibroblast activation[J]. Oncotarget, 2016, 7 (37): 58717-58727. DOI:10.18632/oncotarget.11227. |
| [3] | Cheng Y, Xiang G, Meng Y, et al. MiRNA-183-5p promotes cell proliferation and inhibits apoptosis in human breast cancer by targeting the PDCD4[J]. Reprod Biol, 2016, 16 (3): 225-233. DOI:10.1016/j.repbio.2016.07.002. |
| [4] | Mao XH, Chen M, Wang Y, et al. MicroRNA-21 regulates the ERK/NF-κB signaling pathway to affect the proliferation, migration, and apoptosis of human melanoma A375 cells by targeting SPRY1, PDCD4, and PTEN[J]. Mol Carcinogen, 2017, 56 (3): 886-894. DOI:10.1002/mc.22542. |
| [5] | Wang L, Zhao M, Guo C, et al. PDCD4 deficiency aggravated colitis and colitis-associated colorectal cancer via promoting IL-6/STAT3 pathway in mice[J]. Inflamm Bowel Dis, 2016, 22 (5): 1107-1118. DOI:10.1097/MIB.0000000000000729. |
| [6] | Yin K, Liu M, Zhang M, et al. miR-208a-3p suppresses cell apoptosis by targeting PDCD4 in gastric cancer[J]. Oncotarget, 2016, 7 (41): 67321-67332. DOI:10.18632/oncotarget.12006. |
| [7] | Liu Y, Uzair-Ur-Rehman, Guo Y, et al. miR-181b functions as an oncomiR in colorectal cancer by targeting PDCD4[J]. Protein Cell, 2016, 7 (10): 722-734. DOI:10.1007/s13238-016-0313-2. |
| [8] | Mao B, Xiao H, Zhang Z, et al. MicroRNA-21 regulates the expression of BTG2 in HepG2 liver cancer cells[J]. Mol Med Rep, 2015, 12 (4): 4917-4924. DOI:10.3892/mmr.2015.4051. |
| [9] |
张霞. 抑癌基因PDCD4和PDCD5在卵巢癌中的作用及其机制研究[D]. 济南: 山东大学, 2011.
Zhang X. Study on the roles and mechanisms of tumor suppressor genes PDCD4 and PDCD5 in ovarian cancer[D]. Jinan:Shandong University, 2011. http://d.wanfangdata.com.cn/Thesis/Y1939418 |
| [10] | Huang Y, Liu Y, Yu L, et al. Histone demethylase KDM2A promotes tumor cell growth and migration in gastric cancer[J]. Tumour Biol, 2015, 36 (1): 271-278. DOI:10.1007/s13277-014-2630-5. |
| [11] | Frankel LB, Christoffersen NR, Jacobsen A, et al. Programmed cell death 4(PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells[J]. J Biol Chem, 2008, 283 (2): 1026-1033. DOI:10.1074/jbc.M707224200. |
| [12] | Allgayer H. Pdcd4, a colon cancer prognostic that is regulated by a microRNA[J]. Crit Rev Oncol Hematol, 2010, 73 (3): 185-191. DOI:10.1016/j.critrevonc.2009.09.001. |
| [13] | Pennelli G, Galuppini F, Barollo S, et al. The PDCD4/miR-21 pathway in medullary thyroid carcinoma[J]. Hum Pathol, 2015, 46 (1): 50-57. DOI:10.1016/j.humpath.2014.09.006. |
| [14] |
马刚. 程序性细胞死亡因子4对胰腺癌生长抑制作用的实验研究[D]. 沈阳: 中国医科大学, 2007.
Ma G. Experimental study on the inhibitory effect of programmed cell death factor 4 on pancreatic cancer[D]. Shenyang:China Medical University, 2007. http://cdmd.cnki.com.cn/article/cdmd-10159-2007162681.htm |
| [15] | Jiang LH, Ge MH, Hou XX, et al. miR-21 regulates tumor progression through the miR-21-PDCD4-Stat3 pathway in human salivary adenoid cystic carcinoma[J]. Lab Invest, 2015, 95 (12): 1398-1408. DOI:10.1038/labinvest.2015.105. |
| [16] | Xu H, Dephoure N, Sun H, et al. Proteomic profiling of paclitaxel treated cells identifies a novel mechanism of drug resistance mediated by PDCD4[J]. J Proteome Res, 2015, 14 (6): 2480-2491. DOI:10.1021/acs.jproteome.5b00004. |
| [17] | Takebe N, Miele L, Harris PJ, et al. Targeting Notch, Hedgehog, and Wnt pathways in cancer stem cells:clinical update[J]. Nat Rev Clin Oncol, 2015, 12 (8): 445-464. DOI:10.1038/nrclinonc.2015.61. |
| [18] | Li J, Yang S, Su N, et al. Overexpression of long non-coding RNA HOTAIR leads to chemoresistance by activating the Wnt/β-catenin pathway in human ovarian cancer[J]. Tumour Biol, 2016, 37 (2): 2057-2065. DOI:10.1007/s13277-015-3998-6. |
| [19] | Catalano V, Dentice M, Ambrosio R, et al. Activated thyroid hormone promotes differentiation and chemotherapeutic sensitization of colorectal cancer stem cells by regulating Wnt and BMP4 signaling[J]. Cancer Res, 2016, 76 (5): 1237-1244. DOI:10.1158/0008-5472.CAN-15-1542. |
| [20] | Neri F, Dettori D, Incarnato D, et al. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway[J]. Oncogene, 2015, 34 (32): 4168-4176. DOI:10.1038/onc.2014.356. |
| [21] | Kuchta-Noctor AM, Murray BA, Stanton C, et al. Anticancer activity of buttermilk against SW480 colon cancer cells is associated with caspase-independent cell death and attenuation of Wnt, Akt, and ERK signaling[J]. Nutr Cancer, 2016, 68 (7): 1234-1246. DOI:10.1080/01635581.2016.1206580. |
 2017, Vol. 37
2017, Vol. 37


