放射治疗是中晚期食管癌的主要治疗手段,尽管技术有了长足的进步,但食管癌放射治疗后5年生存率仍仅有10%~39%,失败率在85%以上[1]。因此,如何增加食管癌细胞的放射敏感性,以提高放疗疗效,一直是研究的热点和难题。已有文献报道,具有抗血管生成作用的药物如沙利度胺、重组人血管内皮抑素、尼妥珠单抗等能增加食管癌细胞的放射敏感性[2-6],且在临床放射治疗中取得了一定的治疗效果。甲磺酸阿帕替尼(YN968D1)是我国自主研发的多靶点小分子酪氨酸激酶抑制剂,研究证实,阿帕替尼可抑制VEGFR-2的活性,阻断其与VEGF结合后的信号转导。因此,推测阿帕替尼也可抑制肿瘤的血管生成[7-8],具有潜在的放疗增敏作用。本研究旨在观察阿帕替尼对食管癌细胞放射敏感性的影响,并初步探讨其作用机制。
材料与方法1.主要试剂与仪器:RPMI 1640培养基含0.25%EDTA的胰酶、青霉素链霉素双抗(美国GIBCO公司),胎牛血清(杭州四季青产品),阿帕替尼溶剂(美国MCE公司),浓度为10 mmol/L。实验前以RPMI 1640培养基稀释。CCK试剂盒(日本同仁研究所),结晶紫染色液、Annexin V-FITC细胞凋亡检测试剂盒、细胞周期与细胞凋亡检测试剂盒均由江苏碧云天公司提供;X射线辐照装置(德国西门子Primus-H型医用直线加速器),吸收剂量率1 Gy/min,源靶距100 cm。流式细胞仪(美国BD公司)。
2.细胞系与细胞培养:人食管鳞癌细胞系Kyse-150购自中国科学院细胞库(目录号:TCHu230),用含10%胎牛血清、1%青霉素链霉素双抗的RPMI 1640培养基配成培养液,于37℃、5% CO2的培养箱中培养。细胞单层贴壁,每2~3天传代1次,选取指数生长期细胞用于实验。
3.CCK-8法检测阿帕替尼对食管癌Kyse-150细胞增殖能力的影响:取指数生长期细胞,胰酶消化后制成单细胞悬液,以每孔5 000个接种于96孔细胞培养板中,待细胞贴壁后,阿帕替尼组更换含阿帕替尼终浓度为5、10、20、30和40 μmol/L的培养液200 μl,空白对照组仅加入不含阿帕替尼的完全培养液。各组设6个平行孔,每板分别于37℃、5%CO2的培养箱中孵育24、48和72 h后,每孔加入10 μl CCK-8溶液,继续培养4 h,用酶标仪测定450 nm处的吸光度(A)值,计算抑制率。细胞增殖抑制率(%)=1-(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。求出50%细胞生长抑制浓度(IC50)。独立实验重复3次。
4.克隆形成实验测定细胞存活分数:实验分空白对照组、单纯照射组(2、4、6和8 Gy)、阿帕替尼组(10、20和40 μmol/L),阿帕替尼联合照射组(阿帕替尼浓度同阿帕替尼组,X射线剂量同单纯照射组)。取指数生长期细胞,胰蛋白酶消化并制成单细胞悬液,以500个细胞接种于培养皿中,贴壁培养24 h后换液,阿帕替尼组及联合组加入终浓度分别为10、20、40 μmol/L的含阿帕替尼培养液,继续培养48 h后进行X射线照射。照射后所有组立即更换为不含阿帕替尼的培养液,继续培养8 d后磷酸盐缓冲液(PBS)漂洗,4%多聚甲醛固定,结晶紫染色,以显微镜下计数50个以上的细胞计算集落形成率(PE),PE(%)=集落数/细胞接种数×100%;细胞存活分数(SF)=克隆数/相同条件下接种的细胞数×PE。应用Graphpad Prism 5.0软件,以单击多靶模型,SF=1-(1-e-D/D0)拟合细胞存活曲线,测定、计算N、D0、Dq、SF2等多个放射生物学参数,计算放射增敏比。独立实验重复3次。
5.流式细胞仪检测细胞周期分布:实验分空白对照组、单纯照射组(4 Gy)、阿帕替尼组(20 μmol/L)和阿帕替尼联合照射组。细胞培养及阿帕替尼处理时间同克隆形成实验。X射线照射后换液继续培养24 h,胰酶消化、离心半径20 cm 1 000 r/min离心5 min。收集培养皿中贴壁及悬浮细胞,PBS洗涤,加入75%乙醇固定,4℃保存过夜。离心半径20 cm 1 000 r/min离心5 min,去除乙醇,PBS洗涤后离心获取细胞,细胞重悬于含RNase(1.87%)的碘化丙啶(PI)溶液中染色,37℃避光温浴30 min后上机检测,用Flowjo软件对细胞周期分布进行计算。独立实验重复3次。
6.Annexin V-FITC和PI双染流式细胞仪检测细胞凋亡率:实验分组及细胞培养同细胞周期分布检测。X射线照射后换液继续培养24 h,用不含EDTA的胰酶消化各组细胞,计数,制成细胞密度1×106/L的悬液,按Annexin V-FITC细胞凋亡检测试剂盒说明书操作,用流式细胞仪检测,用Flowjo软件对样品的细胞凋亡率进行计算。独立实验重复3次。
7.统计学处理:采用SPSS 20.0软件进行数据分析。数据以x±s表示。两组间比较经正态性检验符合正态分布,采用独立样本t检验,多个样本均数间比较经方差齐性检验,采用单因素方差分析(one-way ANOVA)。P < 0.05为差异有统计学意义。
结果1.阿帕替尼对食管癌Kyse-150细胞的增殖抑制作用:CCK-8检测结果示,不同浓度的阿帕替尼作用于食管癌Kyse-150细胞24、48和72 h后,均可抑制细胞的生长,且IC50值分别为(26.53±0.61)、(18.86±0.42)和(11.15±0.26) μmol/L,提示阿帕替尼对食管癌细胞的增殖抑制作用具有剂量-时间依赖性,表 1为不同浓度阿帕替尼处理24、48和72 h后Kyse-150细胞的增殖抑制率。以下实验均选取48 h作为药物处理时间,以其IC50作为药物浓度选取标准。
|
|
表 1 不同浓度阿帕替尼处理后不同时间的Kyse-150细胞的增殖抑制率(%,x±s) Table 1 Cell proliferation inhibition rate of Kyse-150 cells treated with different concerntrations of apatinib at different time(%, x±s) |
2.阿帕替尼联合照射对食管癌Kyse-150细胞存活分数的影响:Kyse-150细胞的存活分数随着照射剂量的增加而下降,与空白对照组相比,阿帕替尼浓度越高,存活分数越低。按照单击多靶模型拟合Kyse-150细胞的存活曲线(图 1),获得D0、Dq及SF2等参数(表 2),放射增敏比SERD0=对照组D0/实验组D0。随着阿帕替尼浓度的增加,食管癌Kyse-150细胞的D0、Dq及SF2值逐渐减少,且具有浓度依赖性。阿帕替尼组与空白对照组比较,Kyse-150细胞的D0、Dq及20和40 μmol/L浓度时差异有统计学意义(t=2.78、2.92、5.83、6.09, P < 0.05),在40 μmol/L时SF2值各组差异均有统计学意义(t=12.88, P < 0.05),在20 μmol/L浓度时,SERD0、SERDq分别为1.36、1.35;在40 μmol/L浓度时,SERD0、SERDq分别为1.36、2.96。
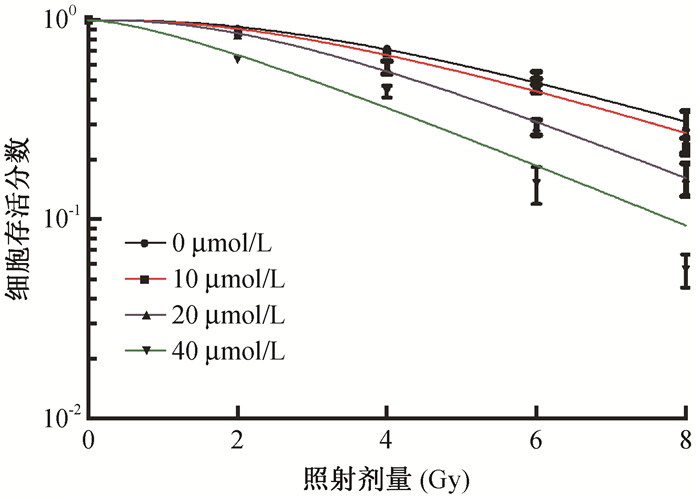
|
图 1 Kyse-150细胞的存活曲线 Figure 1 The survival curve of Kyse-150 cells |
|
|
表 2 不同药物浓度时Kyse-150细胞的放射增敏参数及增敏比(x±s) Table 2 The radiosensitization parameters and sensitization ratio of Kyse-150 cells treated with different concentrations of apatinib(x±s) |
3.阿帕替尼联合照射组对Kyse-150细胞周期分布及凋亡的影响:流式细胞仪分析结果显示,阿帕替尼组、单纯照射组及阿帕替尼联合照射组细胞凋亡率较空白对照组增加,差异均有统计学意义(t=12.36、5.99、15.47, P < 0.05)。阿帕替尼组、单纯照射组及阿帕替尼联合照射组G2/M期比例分别为(26.27±3.30)%、(68.79±2.77)%、(47.27±3.59)%,与空白对照组比较,差异均有统计学意义(t=8.81、39.69、20.61, P < 0.05),其中,单纯照射组G2/M期细胞比例最高,而阿帕替尼联合照射组次之。阿帕替尼组、阿帕替尼联合照射组细胞S期比例明显增高,与空白对照组比较,差异有统计学意义(t=6.06、3.82,P < 0.05),与单纯照射组比较差异也有统计学意义(t=8.81、6.24, P < 0.05);但阿帕替尼组与阿帕替尼联合照射组比,差异无统计学意义(P > 0.05);单纯照射组与空白对照组相比,S期比例差异无统计学意义(P > 0.05)。见表 3。图 2为Kyse-150细胞各组细胞凋亡图。可见与空白对照组相比,所有实验组Annexin V-FITC染色阳性并且PI染色阴性的细胞,即凋亡细胞,明显增加(右下象限);Annexin V-FITC和PI染色双阳性的细胞,即坏死细胞,也有所增加(右上象限)。
|
|
表 3 不同实验组细胞周期分布比例及凋亡率(%,x±s) Table 3 The distribution ratio of cell cycle and apoptosis rate in different groups(%, x±s) |
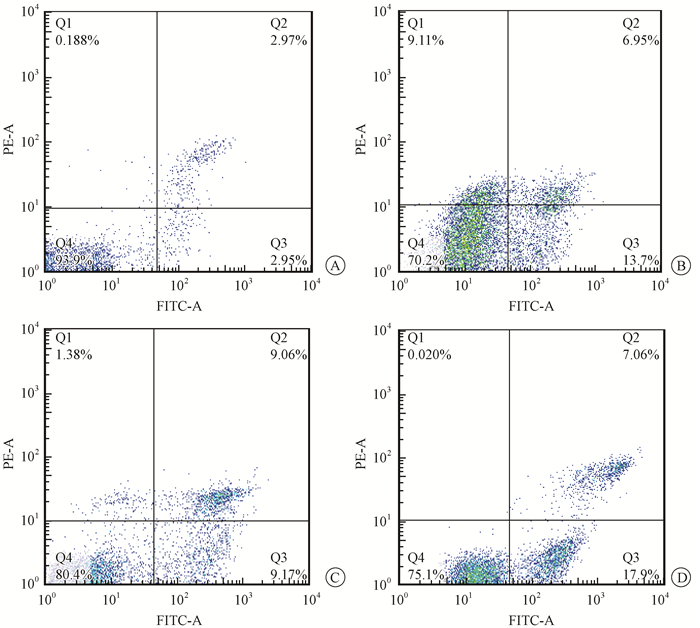
|
图 2 各实验组细胞凋亡的流式细胞仪分析 A.空白对照组;B.阿帕替尼组;C.单纯照射组;D.阿帕替尼联合照射组 Figure 2 Apoptosis induction detected by flow cytometry after different treatments A.Control group; B. Apatinib group; C.Radiation group; D. Combination group treated with X-rays plus apatinib |
讨论
阿帕替尼是一种以VEGFR-2为靶点的抗血管生成治疗靶向药物,已有学者研究发现,阿帕替尼能抑制结肠癌HCT-116细胞、白血病HL-160细胞、肝内胆管细胞癌细胞等肿瘤细胞的增殖、促进其凋亡及增加化疗敏感性[9-11]。但阿帕替尼是否对肿瘤细胞具有放射增敏作用及其相关机制的研究较少。本实验主要研究阿帕替尼对食管癌细胞放射敏感性的影响,并初步探讨其作用机制。
细胞增殖抑制曲线显示,阿帕替尼能明显抑制食管癌细胞的增殖,且呈剂量-时间依赖性,药物作用72 h后,抑制效应较24和48 h明显增加,推测阿帕替尼在直接杀伤细胞的同时,也通过促进细胞凋亡进一步杀伤肿瘤细胞。细胞存活曲线表明:Kyse-150细胞的存活分数随辐射剂量的增高呈指数性降低,且随着阿帕替尼浓度的增加,Kyse-150细胞的放射生物学参数D0、Dq、SF2值逐渐减小,而放射增敏比SERD0逐渐增加。放射增敏比越高,说明放射敏感性越强。可见阿帕替尼可通过抑制细胞亚致死损伤修复来增加Kyse-150细胞的放射敏感性。流式细胞术结果显示,阿帕替尼既可直接诱导食管癌细胞凋亡,也可促进射线诱导的食管癌细胞的凋亡。细胞处于不同时相其放射敏感性不同,其中,G2、M期对射线最为敏感[12]。细胞周期结果分析显示,阿帕替尼能显著增加食管癌Kyse-150细胞G2/M期比例,与X射线联合后24 h,G2/M期比例更高,而G1期比例显著下降,这可能与射线损伤细胞的DNA双链,诱导细胞由G1期向G2/M期分化相关。由此推测,阿帕替尼诱导细胞凋亡,导致食管癌Kyse-150细胞发生G2/M期阻滞,加速G2/M期细胞死亡,从而诱导细胞周期再分布可能是其对放疗增敏的机制之一。同时,经阿帕替尼处理过的细胞S期比例明显增加,而射线对细胞S期比例的改变无明显影响,表明阿帕替尼可诱导食管癌细胞发生S期阻滞,此现象提示,如果阿帕替尼联合对S期较为敏感的细胞周期特异性化疗药物如氟尿嘧啶等,治疗食管癌患者,可能效果较好,这将为临床食管癌的治疗提供一个新思路。
阿帕替尼是我国自主研发的一类新药,各期临床试验已发现其在很多晚期肿瘤如晚期胃癌、结直肠癌、非小细胞肺癌、乳腺癌等的治疗中显现出较好的疗效[13-15],但阿帕替尼在细胞内的具体作用机制及其联合作用靶点还未明确。本实验发现阿帕替尼能抑制食管癌Kyse-150细胞增殖,与X射线联合能明显抑制细胞存活率,并通过诱导其凋亡及细胞周期再分布来增加食管癌细胞的放射敏感性。推测其增敏作用可能与调控凋亡相关蛋白,如PRAP,Caspase-3、Caspase-9等的表达有关,这将为进一步明确阿帕替尼作为放疗增敏剂治疗食管癌的具体机制提供新的思路,也为临床食管癌的综合治疗提供理论依据及新的策略。
利益冲突 本研究还接受常州市科技支撑社会发展项目(CE20165024)、常州市高层次卫生人才项目(2016C2BJ007)、常州市科技局应用基础研究项目(CJ20159050)的资助。全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益作者贡献声明 孙菲为实验和论文撰写主要完成者;孙志强、汪建林负责研究过程指导;王坚负责数据统计指导;胡莉钧提出修改意见;周梦耘、封悦、孔泽、华秋协助实验完成;于静萍参与研究的酝酿和设计实验,提出修改意见
| [1] | Napier KJ, Scheerer M, Misra S. Esophageal cancer:a review of epidemiology, pathogenesis, staging workup and treatment modalities[J]. World J Gastrointest Oncol, 2014, 6 (5): 112-120. DOI:10.4251/wjgo.v6.i5.112. |
| [2] |
于静萍, 孙志强, 倪新初, 等. 沙利度胺联合照射对人食管癌裸鼠移植瘤生长和肿瘤血管生成的影响[J].
中华放射医学与防护杂志, 2013, 33 (6): 584-587. Yu JP, Sun ZQ, Ni XC, et al. The growth and angiogenesis inhibition effects of thalidomide combined with radiation on the human esophageal carcinoma transplanted nude mice[J]. Chin J Radiol Med Prot, 2013, 33 (6): 584-587. DOI:10.3760/cma.j.issn.0254-5098.2013.06.004. |
| [3] |
于静萍, 孙志强, 倪新初, 等. 沙利度胺联合放疗治疗食管癌的临床观察[J].
中华放射医学与防护杂志, 2012, 32 (4): 369-373. Yu JP, Sun ZQ, Ni XC, et al. Clinical effect observation of VEGF expression interfered by Thalidomide combined with radiotherapy in esophageal cancer treatment[J]. Chin J Radiol Med Prot, 2012, 32 (4): 369-373. DOI:10.3760/cma.j.issn.0254-5098.2012.04.009. |
| [4] |
于静萍, 孙苏平, 孙志强, 等. 沙利度胺对食管癌TE1细胞DNA合成抑制作用和辐射敏感性的影响[J].
中华放射医学与防护杂志, 2010, 30 (3): 270-273. Yu JP, Sun SP, Sun ZQ, et al. Inhibition of DNA synthesis and radiosensization effects of thalidomide on esophageal carcinoma TE1 cells[J]. Chin J Radiol Med Prot, 2010, 30 (3): 270-273. DOI:10.3760/cma.j.issn.0254-5098.2010.03.010. |
| [5] |
孙志强, 于静萍, 张志明, 等. 重组人血管内皮抑素对食管癌细胞的放射增敏作用及其机制[J].
中华放射医学与防护杂志, 2013, 33 (4): 346-350. Sun ZQ, Yu JP, Zhang ZM, et al. Effect of recombinant human endostatin on the radiosensitivity of esophageal carcinoma cells and underlying mechanism[J]. Chin J Radiol Med Prot, 2013, 33 (4): 346-350. DOI:10.3760/cma.j.issn.0254-5098.2013.04.003. |
| [6] | Zhao L, He LR, Xi M, et al. Nimotuzumab promotes radiosensitivity of EGFR-overexpression esophageal squamous cell carcinoma cells by upregulating IGFBP-3[J]. J Transl Med, 2012, 10 (1): 1-9. DOI:10.1186/1479-5876-10-249. |
| [7] | Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102 (7): 1374-1380. DOI:10.1111/j.1349-7006.2011.01939.x. |
| [8] | Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10 (1): 529 DOI:10.1186/1471-2407-10-529. |
| [9] |
殷亮, 王荩, 黄凤昌, 等. 甲磺酸阿帕替尼对结肠癌HCT-116细胞增殖的抑制作用及其机制[J].
南方医科大学学报, 2017 (3): 367-372. Yin L, Wang J, Huang FC, et al. Inhibitory effect of apatinib on HCT-116 cells and its mechanism[J]. J Southern Med Univ, 2017 (3): 367-372. DOI:10.3969/j.issn.1673-4254.2017.03.15. |
| [10] | Peng H, Zhang Q, Li J, et al. Apatinib inhibits VEGF signaling and promotes apoptosis in intrahepatic cholangiocarcinoma[J]. Oncotarget, 2016, 7 (13): 17220-17229. DOI:10.18632/oncotarget.7948. |
| [11] |
梁树, 童秀珍, 符立悟. 小分子酪氨酸激酶抑制剂Apatinib对白血病HL-60细胞株抑制增殖作用及机制[J].
南方医科大学学报, 2011, 31 (5): 871-874. Liang S, Tong XZ, Fu LW. Inhibitory effect of apatinib on HL-60 cell proliferation and its mechanism[J]. J Southern Med Univ, 2011, 31 (5): 871-874. |
| [12] | Hu X, Zhang Z, Liu T, et al. Polypeptide fraction from arca subcrenatainduces apoptosis and G2/M phase arrest in HeLa cells via ROS-Mediated MAPKs pathways[J]. Evid Based Complement Alternat Med, 2015, 2015 (8): 1-12. DOI:10.1155/2015/930249. |
| [13] | Lin Y, Zhai E, Liao B, et al. Autocrine VEGF signaling promotes cell proliferation through a PLC-dependent pathway and modulates Apatinib treatment efficacy in gastric cancer[J]. Oncotarget, 2017, 8 (7): 11990-12002. DOI:10.18632/oncotarget.14467. |
| [14] | Zhou N, Liu C, Hou H, et al. Response to apatinib in chemotherapy-failed advanced spindle cell breast carcinoma[J]. Oncotarget, 2016, 7 (44): 72373-72379. DOI:10.18632/oncotarget.12568. |
| [15] | Song Z, Yu X, Lou G, et al. Salvage treatment with apatinib for advanced non-small-cell lung cancer[J]. Onco Targets Ther, 2017, 10 : 1821-1825. DOI:10.2147/OTT.S113435. |
 2017, Vol. 37
2017, Vol. 37


