质子和重离子因其特有的物理特性,具有较大的质量且在物质中有特定的射程,可以在某个深度后形成巨大的剂量跌落,在这个深度之后几乎没有剂量的剂量学优势,也就是布拉格峰(Bragg peak)[1-2],通过多个能量的布拉格峰在不同深度叠加可以得到一个剂量坪区(spread-out Bragg peak,SOBP),坪区之后剂量快速跌落,可以使靶区剂量均匀的同时,周围的危及器官得到更好地保护。本单位的粒子治疗系统,由调强点扫描和能量堆积来完成深度达310 mm的质子和重离子治疗,不同于粒子散射束(raster scan)治疗,粒子点扫描(spot scan)治疗通过磁铁偏转加速粒子后聚焦至治疗中心,减少了粒子与射束路径上与补偿器相互作用时中子的产生,但同时治疗系统对粒子输出精确性要求更高,因此,调强质子和重离子治疗的计划验证也尤为重要[3-4]。为了评估现行质量控制流程的完善性,对近1年的患者验证结果做分析研究。
材料与方法1.患者验证测量材料:两套三维水箱(德国PTW公司)对应两组电离室矩阵,用于剂量验证的测量,包括三维水箱模体1和2。电离室矩阵由PMMA内置24只针型电离室(德国PTW公司)组成有效测量体积约为55 mm×70 mm×60 mm,每个电离室有效测量体积为30 mm3,在垂直束流方向排成6行,每行有4个电离室,每行的电离室与前排相交错开并在深度方向加深。因为束流垂直电离室矩阵,所有验证测量均在水平束流房间(治疗室1, 2, 4)。
2.预热计划:每次验证计划执行之前,会以标准立方体预热计划(preheat plan)来监测设备的输出剂量和水箱摆位情况,标准的质子和碳离子预热计划体积均为80 mm3,物理剂量测量深度不同但剂量为2 Gy均匀剂量分布的照射计划。
3.患者验证计划:将治疗计划中每个射束的束斑位置、能量、粒子数目、射程移动补偿器(range shifter,RS)等参数拷贝至均匀三维水箱模体上生成验证计划,TPS为Syngo® TPS (德国西门子公司),每个射束通常选择一个测量位置,尽量避免电离室矩阵落在剂量跌落区,验证计划生成后传输到临床治疗系统上后执行测量。按文献[5-6]方法,由电离室矩阵的测量值与TPS计划值做剂量学比较来评估患者治疗计划。
4.验证结果分析方法:现行患者剂量验证通过评判标准为,对于电离室矩阵中24个电离室的任意单个电离室,其测量值与计划值之间的绝对剂量差异≤3%,或测量值与计划值之间DTA≤3 mm,此电离室验证测量通过;24个电离室中有至少22个电离室通过3%的剂量差异或测量值与计划值之间DTA≤3 mm,同时满足24个电离室测量值与计划值之间剂量差异的平均值≤3%,为此患者验证测量通过。对于不通过此标准的结果,将进一步以γ DTA 3 mm/3%剂量差异进行分析[7]。每个射束剂量测量后,系统自动将照射信息以XML文档的方式保存,包含束流参数(粒子数、能量、束斑位置等)、电离室矩阵测量深度、治疗机房等,读取2015年7月—2016年7月期间约608个计划验证的所有照射信息,共1 734个射束验证测量结果(523个质子和1 211个碳离子),按照测量水箱、测量深度和治疗室分类,列于表 1,其中包含部分重复测量数据。
|
|
表 1 预热计划和患者验证计划分类汇总 Table 1 Summary of preheat plans and patient verification plans |
结果
1.预热计划测量结果分析:测量数据中共245个质子和碳离子预热计划,图 1显示预热计划按照不同的分类信息测量值与计划值之间剂量偏差,总体来讲预热计划的测量值与计划值之间剂量差异的平均值 < ±1%,质子的预热计划相比碳离子预热计划测量与计划值剂量差异的平均值小。
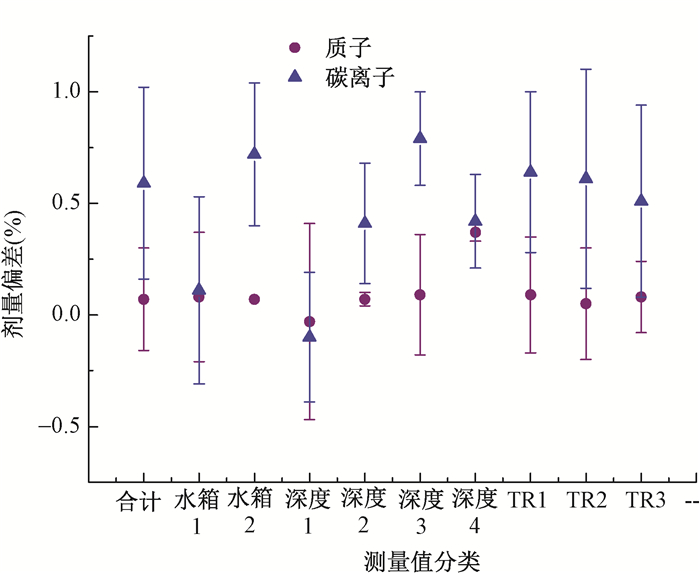
|
图 1 质子和碳离子预热计划测量结果按照测量水箱、测量机房和电离室矩阵深度评估的剂量偏差 注:深度1.0~50 mm;深度2.50~100 mm;深度3.100~150 mm;深度4.150~200 mm。TR1.治疗室1;TR2.治疗室2;TR4.治疗室4 Figure 1 Mean dose deviations for proton and carbon ion beams measured by water phantom, depth of ion chamber array in phantoms and treatment rooms |
为了分析单个电离室的特性,质子和碳离子预热计划测量单个电离室测量值与计划值之间剂量偏差见图 2,3。所有电离室测量值与计划值之间剂量差异的平均值均 < ±2%,质子2号水箱的电离室4和电离室5有较大的偏差,分别为(-1.56±0.93)%和(-1.04±0.74)%,碳离子2号水箱的预热计划测量也有类似现象。
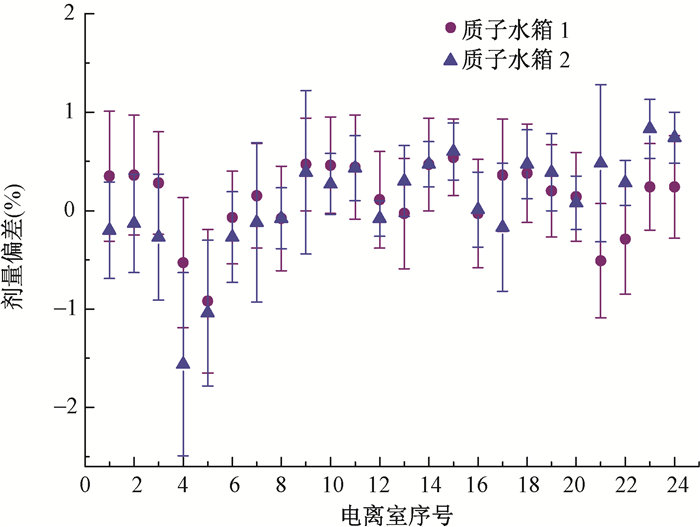
|
图 2 质子用三维水箱模体1和2测量的预热计划中每个电离室的剂量偏差 Figure 2 Mean dose deviation measured in water phantoms 1 and 2 |
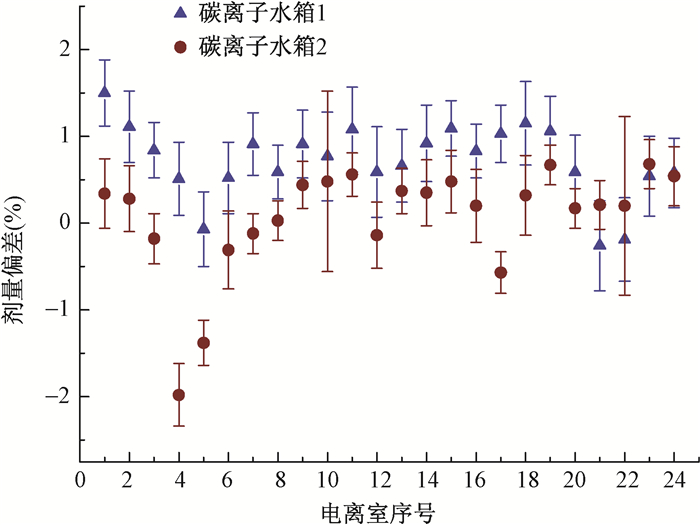
|
图 3 碳离子用三维水箱模体1和2测量的预热 Figure 3 Mean dose deviation measured in water phantoms 1 and 2 for each chamber for carbon ion beam |
2.患者剂量验证结果分析:分析数据中共有523个质子射束测量和1 211个碳离子射束测量结果,图 4显示所有分析数据中质子和碳离子验证计划按照测量水箱,RS,电离室矩阵测量深度和治疗机房分类后测量值与计划值之间剂量偏差。所有质子验证测量值和计划值差异按照不同分类信息的剂量差异平均值 < ±1%,其中,验证计划包含RS的测量值与计划值剂量差异的平均值较高,为(-1.19±1.11)%;所有碳离子验证测量按照不同分类信息分析,多数电离室矩阵测量值和计划值剂量差异的平均值 < 2%,和质子测量一样,验证计划中包含RS的碳离子测量与计划值之间剂量差异平均值也较高,为(-1.95±1.46)%。
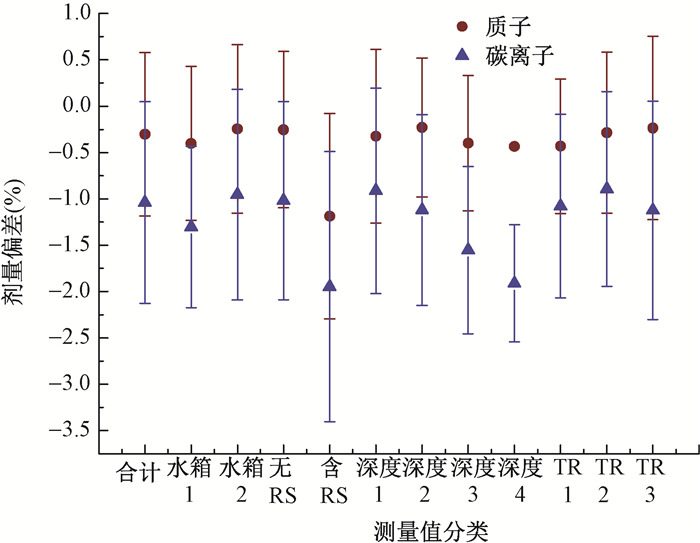
|
图 4 质子和碳离子射束验证测量按照测量水箱,RS,电离室矩阵测量深度和治疗机房评估的剂量偏差 注:深度1.0~50 mm;深度2.50~100 mm;深度3.100~150 mm;深度4.150~200 mm。TR1.治疗室1;TR2.治疗室2;TR4.治疗室4 Figure 4 Mean dose deviation for proton and carbon beams measured by water phantom, range shifter (RS), depth of ion chamber array in phantoms and treatment rooms |
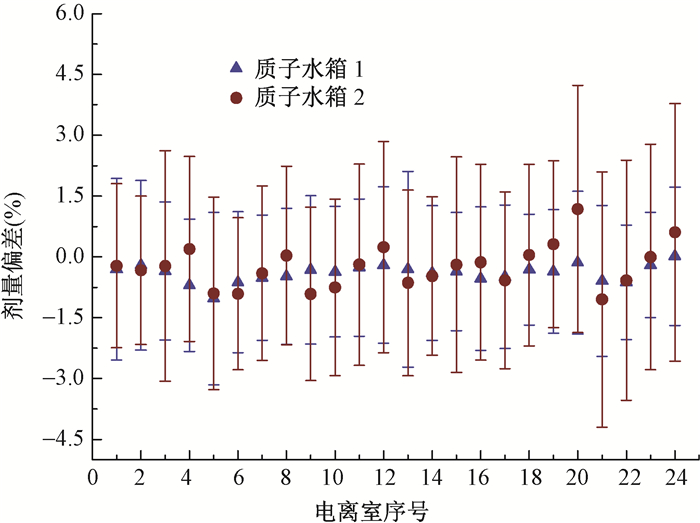
对于单个电离室在质子验证测量中的特性分析见图 5。质子验证测量中多数电离室测量值与计划值剂量差异的平均值 < ±1%,其中具有最大剂量差异平均值的电离室为2号水箱的电离室20(1.18±3.05)%和2号水箱的电离室21(-1.05±3.15)%。
|
图 5 质子射束验证用三维水箱模体1和2测量 Figure 5 Mean dose deviations measured by water phantoms 1 and 2 for each chamber for all proton beams |
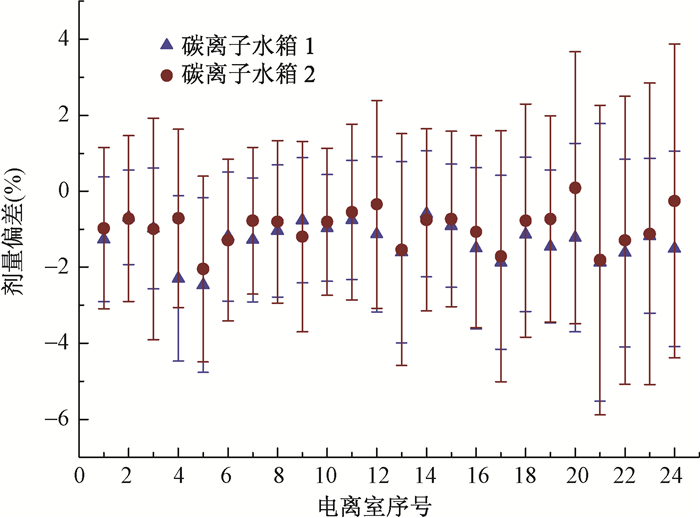
对于单个电离室在碳离子验证测量中的特性分析示于图 6。碳离子验证测量中多数电离室测量值与计划值剂量差异的平均值<±2%,其中具有最大剂量差异平均值的电离室为2号水箱的电离室20(0.09±3.58)%和1号水箱的电离室5(-2.47±2.30)%。
|
图 6 碳离子射束验证用三维水箱模体1和2测量的每个电离室的剂量偏差 Figure 6 Mean dose deviations measured by water phantoms 1 and 2 for each chamber for carbon ion beams |
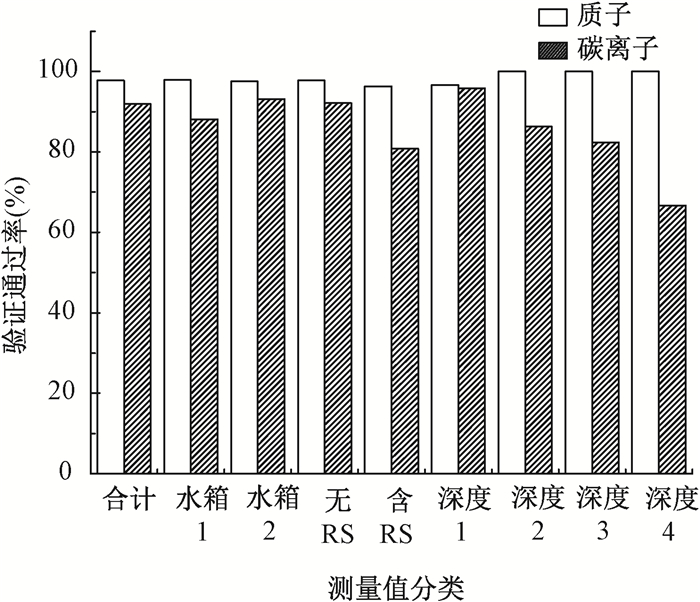
按照不同分类信息分析,评估的质子和碳离子射束测量验证通过率示于图 7,质子和碳离子的验证测量总体通过率分别为97.7%和91.9%。从图 7可以看出,质子和碳离子用水箱模体2的射束测量单个电离室的通过率略高于水箱模体1,此现象可能与两组水箱的电离室的剂量校准因子不一致,2号水箱的电离室剂量校准因子较1号水箱略高,而结合前面电离室测量分析来看,无论是质子还是碳离子,实际测量值均有略低于计划值的现象存在。从图中可以看出,碳离子测量在电离室矩阵深度为150~200 mm时,通过率最低为66.7%,但是此区间的射束测量样本较小只有13个,造成该现象的原因需做进一步分析研究,此现象在质子测量中并不明显。碳离子验证测量中含有RS的计划验证通过率低于不含RS的计划验证通过率,此现象在质子验证测量中并不明显。对所有验证测量结果的单个电离室通过率分析显示,多数电离室的测量通过率高于91.2%,而碳离子和质子验证用三维水箱模体1和2测量在不同月份间的通过率差异性亦不明显。
|
图 7 质子和碳离子射束验证测量按照测量水箱,RS和电离室矩阵测量深度分类的整体通过率 注:深度1:0~50 mm;深度2:50~100 mm;深度3:100~150 mm;深度4:150~200 mm。TR1.治疗室1,TR2.治疗室2,TR4.治疗室4 Figure 7 Patient-specific QA measurement passing rate categorized by water phantom, range shifter (RS) and depth of ion chamber array in phantom |
约608个计划共包含1 734个射束测量中,共有56例计划测量(7例质子,49例碳离子)没有通过剂量验证,多数因为计划测量值与计划值之间剂量差异的平均值>3%造成,其中有部分通过再次测量或检查测量参数后验证通过。如果将这些没有通过的验证按照γ DTA 3 mm/3%剂量差异分析,则共有6例(1例质子和5例碳离子)计划没有通过此验证标准,其中有4例碳离子计划为前列腺病例,电离室矩阵测量深度均>150 mm,另外1例碳离子含有RS,此5例计划均通过重新设计计划方案再次测量验证通过。唯一的一例验证不过质子计划因计划参数设置错误导致。
讨论本研究就对标准预热计划测量结果和1 734个射束验证测量结果进行分类分析,标准的预热计划因均匀的剂量分布测量值和计划值差异很小;而患者的验证剂量因非均一的剂量分布,测量分歧较标准预热计划大,但仍在临床接受范围内。从测量结果的不同分类信息评估比较显示,多数电离室测量值和计划值之间有较好的一致性;不同治疗室之间、不同月份以及同一水箱不同月份间验证通过率无明显差异,对于不同水箱的电离室校准因子不一致问题,通过交叉校准将两个水箱电离室校准因子保持一致;含有RS的计划验证较不含RS的计划验证通过率略低,可能因计划系统对于RS的散射贡献评估略高引起;而对于碳离子射束,当电离室位置深度为150~200 mm,测量值与计划值之间剂量差异平均值降低约1%,此现象可能与在此深度时TPS散射模型对碳离子的散射剂量贡献评估不足造成,另一可能原因是在靶区较小的情况下电离室矩阵不能完全放置在靶区内,周边的剂量梯度大的情况下,较深的电离室矩阵位置对水箱摆位精度要求更高,类似现象在德克萨斯大学安德森癌症中心也有提及[8]。对于患者验证计划的通过标准,现行的临床评估标准并没有应用γ DTA 3 mm/3%剂量差异分析,设计了γ DTA 3 mm/3%剂量差异分析评估标准与现行验证评估标准并行测试,因为质子重离子形成的剂量跌落较光子更为锋利,γ DTA 3 mm/3%剂量差异分析标准更符合临床应用需求[9],并行测试通过后将取代现行的患者验证剂量评估标准。
另外,含有多个电离室的二维电离室矩阵逐渐用于质子和碳离子验证[10],为质子和重离子的三维剂量分析提供了更多选择。本单位二维电离室矩阵为OCTAVIUS 1500 XDR (德国PTW公司), 设计将电离室矩阵密封后在三维水箱中进行临床患者剂量验证。目前,此QA项目仍在设计阶段,二维电离室矩阵的临床应用将提供更直观有效和方便快捷的患者剂量验证方式,三维剂量验证也将会是本单位日后的QA验证方向。通过对1 734个射束验证记录分类分析研究表明,现行的质子和碳离子患者验证方式,即由电离室矩阵测量的点剂量和计划计算值之间有较好的一致性,而更方便快捷的患者计划验证方式也将在摸索中寻求及临床的实施应用。
利益冲突 全体作者未因进行该研究而接收任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 刘晓莉负责数据统计分析并起草论文;邓宇参与数据统计分析;Nicki Schlegel、黄志杰参与论文修改;Michael F. Moyers指导论文写作
| [1] | Ando K, Kase Y. Biological characteristics of carbon-ion therapy[J]. Int J Radiat Biol, 2009, 85 (9): 715-728. DOI:10.1080/09553000903072470. |
| [2] | Durante M, Loeffler JS. Charged particles in radiation oncology[J]. Nat Rev Clin Oncol, 2010, 7 (1): 37-43. DOI:10.1038/nrclinonc.2009.183. |
| [3] | Regan M, Stathakis S, Nayebi N, et al. SU-E-T-350:Three year analysis using ionization chamber array for patient specific IMRT QA[J]. Med Phys, 2012, 39 (6): 3784 DOI:10.1118/1.4735437. |
| [4] | Scarlat F, Scarisoreanu A, Badita E, et al. Ionization chamber dosimetry for conventional and laser-driven clinical hadron beams[J]. J Biosci Med, 2015, 3 (4): 8-17. DOI:10.4236/jbm.2015.34002. |
| [5] | Heeg P, Hartmann G, Jäkel O, et al. Quality assurance at the heavy-ion therapy facility at GSI[J]. Strahlenther Onkol, 1999, 175 (suppl 2): 36-38. DOI:10.1007/BF03038885. |
| [6] | Karger CP, Jkel O, Hartmann GH, et al. A system for three-dimensional dosimetric verification of treatment plans in intensity-modulated radiotherapy with heavy ions[J]. Med Phys, 1999, 26 (10): 2125-2132. DOI:10.1118/1.598728. |
| [7] | Low DA, Harms WB, Mutic S, et al. A technique for the quantitative evaluation of dose distributions[J]. Med phys, 1998, 25 (5): 656-661. DOI:10.1118/1.598248. |
| [8] | Zhu XR, Poenisch F, Song XF, et al. Patient-specific quality assurance for prostate cancer patients receiving spot scanning proton therapy using single-field uniform dose[J]. Int J Radiat Oncol Biol Phys, 2012, 81 (2): 552-559. DOI:10.1016/j.ijrobp.2010.11.071. |
| [9] | Tom D, Ann VE, Dominique Pierre H. A quantitative evaluation of IMRT dose distributions:refinement and clinical assessment of the gamma evaluation[J]. Radiother Oncol, 2002, 62 (3): 309-319. DOI:10.1016/S0167-8140(01)00497-2. |
| [10] | Varasteh Anvarab M, Attilia A, Cioccac M, et al. Quality assurance of carbon ion and proton beams:A feasibility study for using the 2D MatriXX detector[J]. Phys Med, 2016, 32 (6): 831-837. DOI:10.1016/j.ejmp.2016.05.058. |
 2017, Vol. 37
2017, Vol. 37


