2. 430022 武汉, 华中科技大学同济医学院附属协和医院肿瘤中心
2. Cancer Center, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
放疗是胸部恶性肿瘤如肺癌、乳腺癌、食管癌和淋巴癌等的重要治疗手段之一[1-2]。射线导致的放射性肺损伤是胸部肿瘤治疗中的常见并发症,也是限制其疗效的主要因素之一。尽管现在越来越多地运用先进的放射治疗技术改善剂量分布和减少不良反应,但高达15%的癌症患者发展为肺炎并最终进展为放射性肺纤维化[3]。虽然可以使用类固醇激素来控制肺部急性炎症,但是常规用于临床治疗纤维化的药物却并不多,因此开发有效的抗纤维化药物的需要非常迫切。
最近研究表明,放射性肺纤维化不是一种特有的病理过程,而是正常组织过度修复的表现[4-5]。放射性肺损伤后可以观察到纤维化相关细胞因子形成的级联瀑布反应[6]。转化生长因子β(TGF-β)是参与放射性肺纤维化的重要细胞因子,起着重要的致炎、致纤维化作用[7-8]。它由许多炎症细胞、间充质细胞和上皮细胞产生,并在大鼠肺中于放射后数小时至数周上调[9]。因此,抑制TGF-β信号通路可能作为减少放射性肺纤维化的潜在途径。二甲双胍是2型糖尿病患者常用的双胍类抗糖尿病药物,并且对细胞生物学显示多效性[10]。已经显示能够减少源自鼻息肉的成纤维细胞中TGF-β诱导的ECM蛋白生成[11]。此外,二甲双胍阻止了支气管哮喘大鼠模型中的气道重塑,并减弱了博莱霉素诱导的肺纤维化,这表明在抗纤维化过程中有巨大的潜在作用[12-13]。本研究旨在通过观察大鼠肺部CT的影像学变化及检测大鼠肺组织的病理学改变,评估二甲双胍干预放射性肺纤维化的效果,探讨其可能的作用机制,为临床治疗提供新方法及理论依据。
材料与方法1.细胞和试剂:非小细胞肺癌(NSCLC)A549和H460细胞系购自中国科学院细胞库。细胞培养用胎牛血清、双抗及RPMI 1640培养基均购自美国GIBCO公司。采用贴壁细胞培养法,使用含10%胎牛血清的RPMI 1640培养基,在37℃、含5%CO2的恒温湿润条件下培养。二甲双胍(metformin)购自美国Aldrich公司并重悬于生理盐水中。使用以下一抗:I型胶原蛋白(Col1)(1 :1 000稀释,美国Abcam公司),TGF-β(2 μg/ ml,美国Biorbyt公司),p-AMPKα(Thr172)(1 :1 000稀释,美国CST公司),AMPKα(1 :500稀释,美国Santa公司),p-Smad2(Ser465/467)(1 :1 000稀释,美国CST公司),p-Smad3(Ser423/425)(1 :1 000稀释,美国CST公司),Smad2/3(WB:1 :500稀释,美国Santa公司),GAPDH(1 :3 000稀释,美国Abcam公司)。
2.动物分组及处理:7~8周龄的雌性Sprague-Dawley(SD)大鼠30只, 体重180~200 g, 购买自北京华阜康生物科技股份有限公司,在适宜的温度(22±2℃)、照明(12 h)和湿度(60%±10%)下饲养。动物质量合格证号:医动字第20-050号,动物饲养设施合格证号:00022033。动物研究方案由华中科技大学伦理委员会审查和批准。用随机数字表法将大鼠分为对照、单纯照射和照射+二甲双胍组共3组,每组5只。在照射后4 h开始腹腔注射给予二甲双胍(200 mg/kg)或生理盐水,此后每天给药1次,共14 d。使用腹腔注射戊巴比妥钠(50 mg/kg)将大鼠麻醉,并使其在特制的凹形泡沫上保持仰卧位置。使用CT模拟图像对与右肺相对应的胸部区域进行定位,并且照射时使用与右肺大小相适的矩形照射野。照射组和照射+二甲双胍组的大鼠接受单次20 Gy 6 MV X射线。吸收剂量率为600 cGy/min,源皮距100 cm。对照组的大鼠在相同条件下接受右侧胸部的假照射(0 Gy)。
3.CT扫描:通过CT-sim系统(德国Philips公司)进行高分辨率计算机断层扫描(HRCT),参数为90 kV、150 mA。将CT图像导入RadiAnt DICOM Viewer 3.4.1(美国Radiantviewer公司)。肺密度以CT强度单位(HU)表示。选取气管分叉层面的肺CT图像,并测量右肺前2个区域的密度值,将其算术平均值定义为肺密度,作为肺纤维化的定量参数。实验过程中每4周进行1次CT扫描。
4.组织病理学和纤维化评分:照射后12周,麻醉后以颈椎脱臼法处死大鼠,取出右上肺叶测量羟脯氨酸含量[14]。取部分剩余右肺组织置于4%多聚甲醛中固定24 h,然后进行HE染色、Masson染色和天狼星染色[14]。肺纤维化评分根据从0(正常肺)到8(肺组织结构的严重变形)的分级标准,由2名有经验的病理科医师独立地将样本分为9个级别。通过在100×镜下随机选取视野,以0至8的等级评价肺纤维化的级别。0级,正常肺; 1级,肺泡或细支气管壁极小纤维增厚; 3级,细支气管壁中度增厚,对肺结构无明显损害; 5级,显著纤维化,对肺结构有明显损害,形成纤维带或小纤维团; 7级,肺结构严重变形,有大纤维团; 8级,全部视野中均为纤维性闭塞。2、4和6级是根据主要组织病理学变化确定的中间等级。对每个样本,从其5个镜下视野的等级评分计算出平均纤维化评分。
5. CCK-8检测细胞活性:将NSCLC A549和H460细胞以(5~10)×103细胞/孔的密度接种在96孔板中,过夜贴壁后将不同浓度的二甲双胍加入培养基中,48 h后,依据CCK-8试剂盒(美国Sigma公司)的说明书操作,检测细胞活性。所有实验中均使用4~6个复孔,并重复至少3次。
6.蛋白质印迹(Western blot)分析:提取肺组织样本的总蛋白,BCA(bicinchoninic acid)法蛋白浓度定量测定蛋白浓度,取30 μg蛋白,于8%~12% SDS-聚丙烯酰胺凝胶中进行电泳分离,将分离后的蛋白进行转膜,3%脱脂奶粉室温封闭1 h,然后用Tris-HCl缓冲盐溶液洗膜3次后,加入相应的一抗,于4℃孵育过夜,再使用Tris-HCl缓冲盐溶液洗膜3次后,加HRP标记的二抗,37℃孵育1 h,采用ECL法进行显色,然后于凝胶图像分析系统拍照,并使用ImageJ软件分析蛋白表达量的差异。
7.统计学处理:实验数x±s表示。采用GraphPad Prism软件对实验数据进行分析并绘图,经正态性检验,数据符合正态分布,采用t检验比较单纯照射组与照射组联合二甲双胍组间肺密度、肺纤维化、羟脯氨酸含量等指标之间的差异。P < 0.05为差异有统计学意义。
结果1.CT影像表现:胸部照射后12周,与对照组相比,单纯照射组大鼠的肺中显示出明显的放射性肺纤维化表现,肺结构紊乱,伴有牵引性支气管扩张和斑片状磨玻璃阴影等改变。二甲双胍治疗能够减轻照射后肺纤维化形成的影像学特征(图 1)。
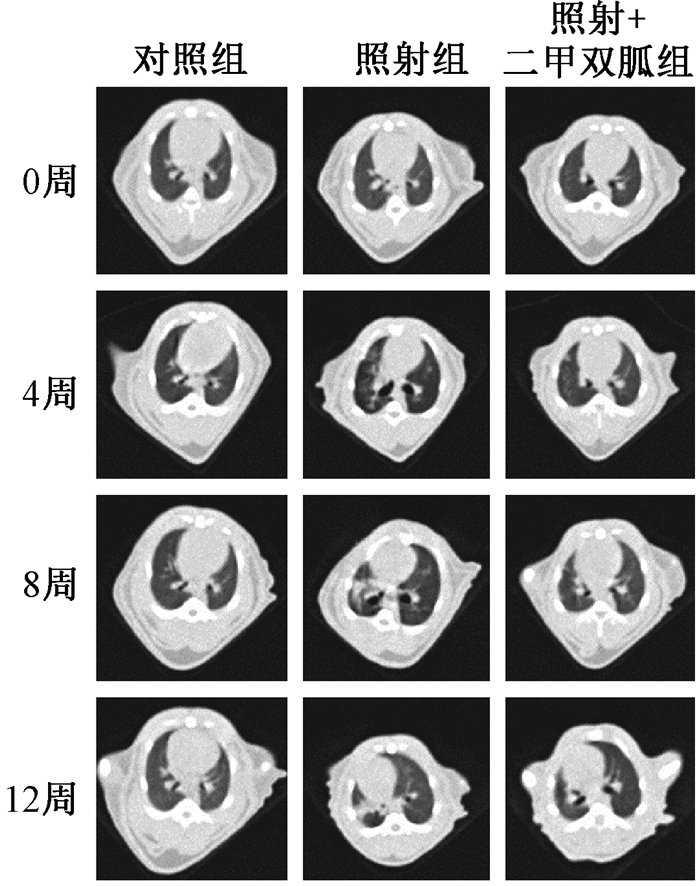
|
图 1 胸部照射后的大鼠HRCT表现 Figure 1 HRCT of rat lungs after thoracic irradiation |
2.肺密度评价:以Hounsfield单位(HU)定量。二甲双胍治疗减弱了胸部放射治疗诱导的肺密度的增加(-310±18 vs. -521±58, t=13.68,P < 0.01, 图 2)。
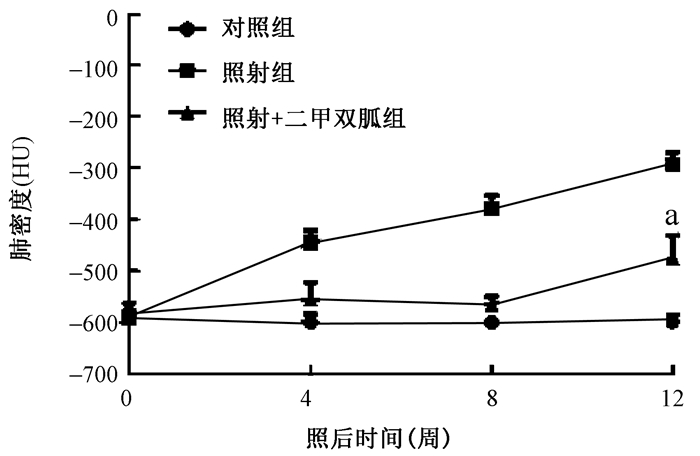
|
图 2 胸部照射后的大鼠肺密度的变化 注:a与照射组比较,t=13.68, P<0.01 Figure 2 Lung density of rat lungs after thoracic irradiation |
3.HE染色、Masson染色和天狼星染色光镜观察:HE染色发现对照组肺组织结构清晰,未见明显结构异常。照射组肺内可见广泛炎性细胞浸润,肺泡间隔水肿、增宽,肺泡结构破坏。Masson染色可见照射组肺间质内大量蓝染的胶原纤维,肺泡结构被破坏。天狼星染色也可以观察肺组织中橘红色和黄色的胶原纤维沉积增多。照射+二甲双胍组可见部分肺泡完整,少量炎性细胞浸润及肺泡壁部分纤维化,以上结果说明二甲双胍治疗可以减轻由于照射导致的肺部组织病理学改变(图 3)。
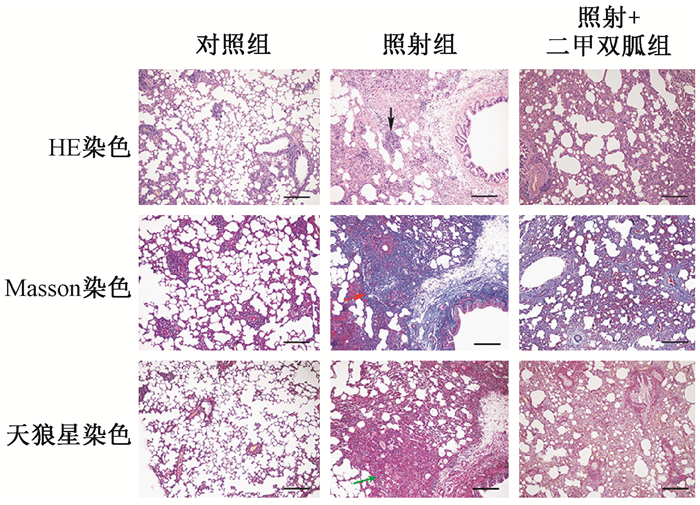
|
图 3 大鼠肺组织HE染色、Masson染色和天狼星染色结果 注:黑色箭头指示炎症细胞浸润,红色和绿色箭头指示胶原纤维,“-”代表250 μm Figure 3 Hematoxylin-eosin, Masson′s trichrome and Sirius red staining of right lungs excised from rats |
4.肺纤维化评分:盲法评分5个高倍视野结果显示照射+二甲双胍组大鼠肺纤维化评分明显小于单纯照射组(6.52±0.43 vs. 3.31±0.57, t=6.37,P < 0.01,图 4)。
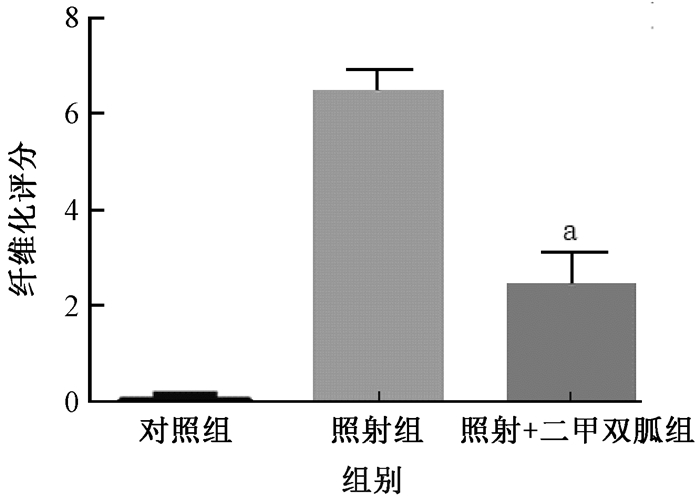
|
图 4 大鼠肺组织的纤维化评分 注:a与照射组比较,t=6.37,P<0.01 Figure 4 Fibrosis scores for grading lung histopathological changes |
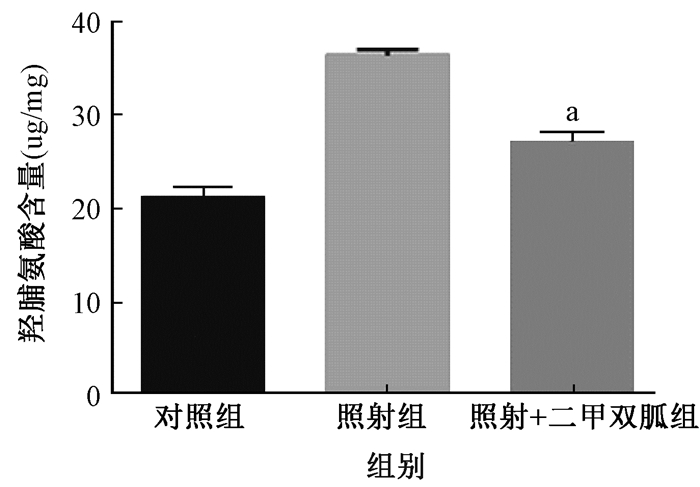
5.羟脯氨酸测量:羟脯氨酸是机体胶原蛋白主要成分之一。本组结果表明,照射组大鼠肺组织中的羟脯氨酸较对照组明显升高,二甲双胍治疗可以部分降低照射导致的肺组织中羟脯氨酸含量的增加(32.58±1.59 vs. 23.47±2.46, t=12.72,P < 0.01,图 5)。
|
图 5 大鼠肺组织羟脯氨酸含量测量 注:a与照射组比较,t=12.72,P<0.01 Figure 5 Hydroxyproline content in lungs of rats |
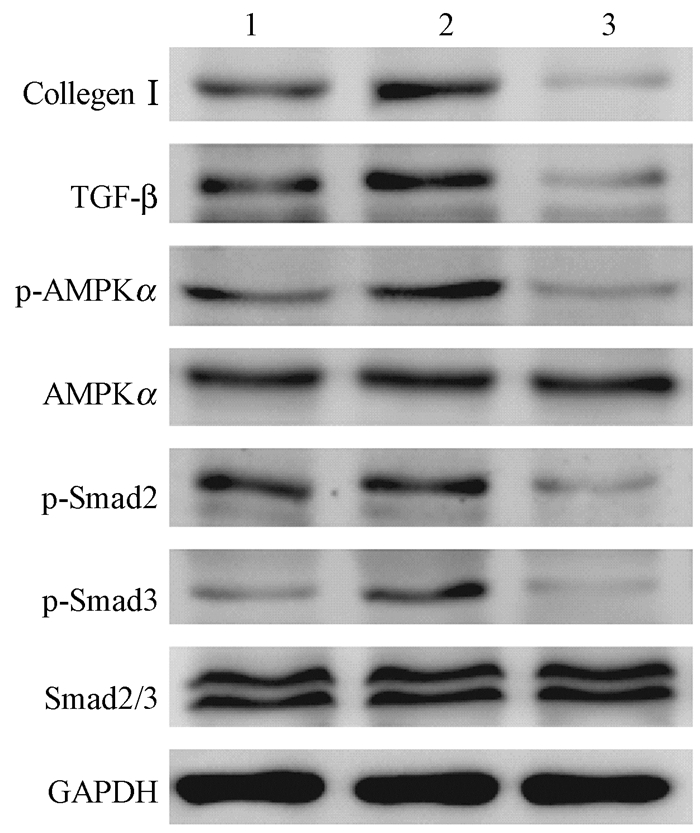
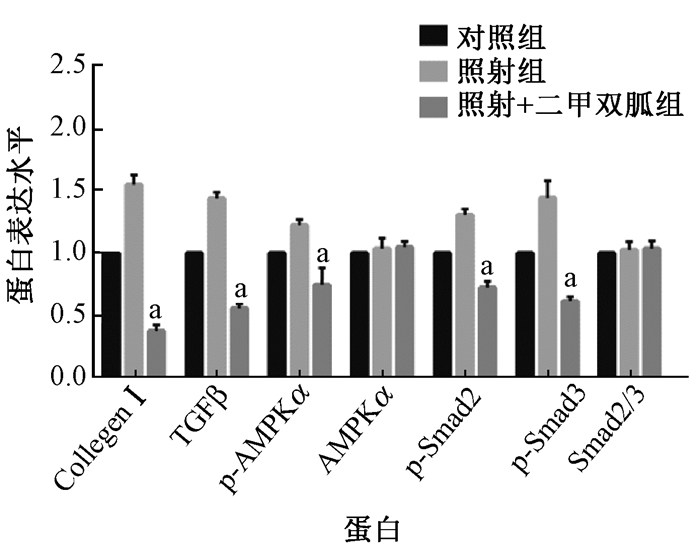
6.蛋白印迹实验结果:为了进一步评估二甲双胍的放射防护效应的机制,运用蛋白质印迹实验评估大鼠肺组织的纤维化和炎症相关蛋白的变化。如图 6,7所示,20 Gy的X射线照射使得大鼠肺组织中I型胶原蛋白和TGF-β的表达水平升高,而二甲双胍治疗可以降低其表达。为了确定二甲双胍抑制TGF-β通路诱导的胶原蛋白合成的机制,进一步研究TGF-β活化的下游信号发现,二甲双胍治疗也可以降低由于放射导致的磷酸化Smad2和Smad3的蛋白水平。另外,同时照射+二甲双胍组中磷酸化AMPKα表达水平低于单纯照射组,提示二甲双胍有可能通过AMPKα非依赖性信号通路发挥作用。
|
图 6 Western blot显示照射后12周大鼠肺组织中纤维化和炎症相关蛋白的表达水平 注:1.对照组;2.照射组;3.照射+二甲双胍组 Figure 6 Western blot showing expression of fibrosis and inflammation-associated proteins in lungs of rats at 12 weeks after radiation |
|
图 7 照射后12周大鼠肺组织中纤维化和炎症相关蛋白的表达量定量 注:a与照射组比较,t=7.72、9.21、13.38、12.66、10.53,P<0.01 Figure 7 Protein quantification of fibrosis and inflammation-associated proteins in lungs of rats at 12 weeks after radiation |
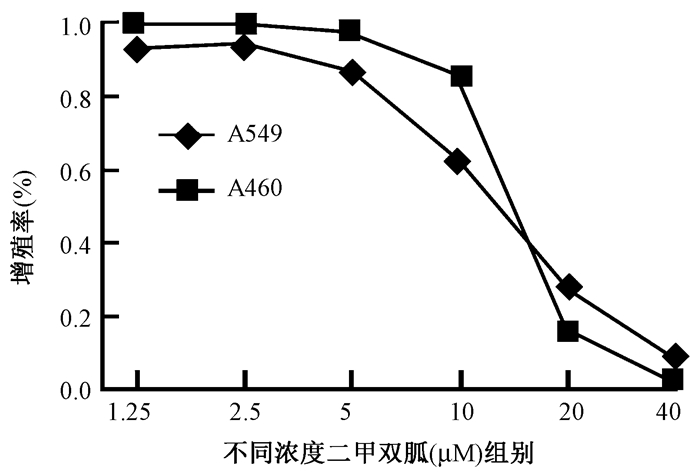
7.CCK-8法检测细胞活性:将A549和H460细胞用二甲双胍或磷酸盐缓冲液(PBS)作为载体对照处理。如图 8所示,二甲双胍以剂量依赖的方式抑制A549和H460细胞的活性。
|
图 8 二甲双胍对NSCLC细胞活性的影响 Figure 8 Effects of metformin on NSCLC cells |
讨论
放射性肺纤维化是胸部放射治疗造成的主要晚期不良反应,其可以导致许多显著影响生活质量的症状。二甲双胍是一种广泛使用的能够激活AMPK发挥作用的抗糖尿病药物。研究结果表明,在接受辐射的动物上给予二甲双胍治疗不仅是可行和安全的,而且其在减轻放射性肺纤维化的影像学和病理学表现方面显示出很好的效果。二甲双胍在放射诱导肺损伤的大鼠模型中对正常组织起保护作用,说明二甲双胍在治疗放射性肺纤维化中具有潜在的临床使用价值。
减少放射性肺纤维化是非常重要的治疗目标。虽然在啮齿类动物模型中已经有许多研究能够减轻放疗或化疗后肺纤维化,但是仍然没有有效的治疗可用于人类[15]。尽管病因不同,但是成纤维细胞激活增殖和细胞外基质过度沉积是该病理过程的共同特征。既往研究表明,二甲双胍对细胞的保护是多方面的,其中通过活化AMPK发挥作用是其非常重要的机制之一。除了能量代谢,AMPK还可以参与多种细胞过程的调节,包括线粒体的完整性、细胞增殖、ER应激、炎症反应和氧化应激[16]。TGF-β诱导的肌成纤维细胞分化和博来霉素(bleomycin)诱导的肺纤维化能够被二甲双胍通过活化AMPK介导的机制有效抑制[17]。与此相一致,通过肺组织的HRCT图像和肺密度测量,发现二甲双胍可以降低大鼠放射性肺损伤的程度和严重性。以往也有报道二甲双胍可通过AMPK依赖及非依赖方式来降低肾纤维化程度[8]。在本研究模型中,二甲双胍并没有导致组织中AMPK磷酸化水平的增加,提示可能存在其他的非AMPK依赖机制的存在[18]。近年来,对促纤维化信号传导通路的深入分析已经证明TGF-β的作用非常关键,其在照射后的损伤部位被激活。它由许多炎症细胞、上皮细胞和间质细胞产生,并且能够将成纤维细胞转化为肌成纤维细胞,促进细胞基质的产生。此外,TGF-β在纤维化过程中发挥多种功能,例如抑制结缔组织的分解和促进结构重塑。研究表明,照射后14 d,支气管和肺泡组织中TGF-β1显著激活,表明特定的支气管和肺泡细胞可以通过产生细胞来源的活化TGF-β来参与放射性肺纤维化过程[19]。为了研究二甲双胍的抗放射性纤维化的作用机制,本研究中通过蛋白质印记实验测量了二甲双胍对大鼠肺组织中TGF-β的作用,发现照射能够诱导肺组织中TGF-β的表达,而二甲双胍却可以抑制其产生。长期的TGF-β暴露是诱导上皮间质转化(EMT)的强大刺激因素。在上皮细胞中,TGF-β的刺激促进Smad蛋白的表达。Smad蛋白是重要的转录因子,其也激活其他转录因子,例如Slug、Snail、Scatter、淋巴增强因子1(lymphoid enhancing factor1) 和β-catenin[20]。研究显示大多数Smad依赖性靶基因由Smad3控制,Smad3和Smad4一起被TGF-β受体丝氨酸/苏氨酸激酶活化后转移到细胞核,Smad蛋白复合物通过与DNA上特异性结合序列或基因调控区相互作用控制靶基因转录。在Smad3缺陷大鼠中,单侧输尿管梗阻引起的肾间质纤维化和放射诱导的皮肤纤维化都减轻,这表明Smad蛋白在TGF-β信号通路中发挥重要作用[21]。因此,TGF-β/ Smad信号通路的激活是纤维化发展中的关键步骤,可以作为治疗纤维化的潜在干预点。研究发现,TGF-βRI的小分子抑制剂SM16在大鼠模型中可以减轻放射性肺损伤的严重程度[22]。TGF-β Ⅰ型受体丝氨酸/苏氨酸激酶抑制剂LY2109761可以降低p-Smad2和p-Smad1的表达,抑制参与经典和非经典TGF-β信号通路的基因的表达,减少肺纤维化,并延长生存期[14]。因此,本研究通过检测二甲双胍对Smad2和Smad3蛋白磷酸化水平的影响,证明二甲双胍可以抑制放射诱导的Smad2和Smad3蛋白活化。这表明二甲双胍抗放射性肺纤维化是通过抑制TGF-β-Smad信号通路介导。然而,只有当放射防护剂仅对正常组织起保护作用而不能保护癌细胞时,才可以考虑将其作为放射防护剂使用。二甲双胍的潜在抗肿瘤作用已在许多癌症模型中得到验证,包括子宫内膜癌、卵巢癌、胰腺癌、肺癌、前列腺癌、乳腺癌和结肠癌等[23]。为了验证二甲双胍的放射防护作用是选择性地作用于正常组织,本研究使用CCK-8检测细胞活性实验来研究二甲双胍对非小细胞肺癌细胞A549和H460的作用,并发现二甲双胍对肺癌细胞没有保护作用。相比之下,它可以抑制NSCLC的活性,这些结果进一步证实二甲双胍在肺癌治疗中的潜在应用价值。
总之,本研究结果表明,二甲双胍可以有效地减轻放射性肺纤维化,在胸部放疗中保护正常的肺组织,并且对肺癌细胞没有放射性防护作用。这项研究为二甲双胍作为潜在放射防护剂用于肺癌患者提供了依据。
利益冲突 本文得到华中科技大学同济医学院附属协和医院科研基金(02.03.2015-22) 资助。所有作者均于投稿前阅读并认可本研究内容,不存在任何潜在利益冲突作者贡献声明 王晔负责数据的采集、论文撰写,对结果进行统计和分析;熊咏超、薛少博、吴志华负责动物的照射,实验的实施及操作;彭振军确定选题、指导写作和修改
| [1] | Morgan GW, Breit SN. Radiation and the lung:a reevaluation of the mechanisms mediating pulmonary injury[J]. Int J Radiat Oncol Biol Phys, 1995, 31 (2): 361-369. DOI:10.1016/0360-3016(94)00477-3. |
| [2] | Mehta V. Radiation pneumonitis and pulmonary fibrosis in non-small-cell lung cancer:pulmonary function, prediction, and prevention[J]. Int J Radiat Oncol Biol Phys, 2005, 63 (1): 5-24. DOI:10.1016/j.ijrobp.2005.03.047. |
| [3] | Rancati T, Ceresoli GL, Gagliardi G, et al. Factors predicting radiation pneumonitis in lung cancer patients:a retrospective study[J]. Radiother Oncol, 2003, 67 (3): 275-283. DOI:10.1016/S0167-8140(03)00119-1. |
| [4] | Ding NH, Li JJ, Sun LQ. Molecular mechanisms and treatment of radiation-induced lung fibrosis[J]. Curr Drug Targets, 2013, 14 (11): 1347-1356. DOI:10.2174/13894501113149990198. |
| [5] | Mangoni M, Sottili M, Gerini C, et al. A PPAR-gamma agonist attenuates pulmonary injury induced by irradiation in a murine model[J]. Lung Cancer, 2015, 90 (3): 405-409. DOI:10.1016/j.lungcan.2015.11.005. |
| [6] | Straub JM, New J, Hamilton CD, et al. Radiation-induced fibrosis:mechanisms and implications for therapy[J]. J Cancer Res Clin Oncol, 2015, 141 (11): 1985-1994. DOI:10.1007/s00432-015-1974-6. |
| [7] | Fernandez IE, Eickelberg O. The impact of TGF-β on lung fibrosis:from targeting to biomarkers[J]. Proc Am Thorac Soc, 2012, 9 (3): 111-116. DOI:10.1513/pats.201203-023AW. |
| [8] | Samarakoon R, Overstreet JM, Higgins PJ. TGF-β signaling in tissue fibrosis:Redox controls, target genes and therapeutic opportunities[J]. Cell Signal, 2013, 25 (1): 264-268. DOI:10.1016/j.cellsig.2012.10.003. |
| [9] | Tatler AL, Jenkins G. TGF-β activation and lung fibrosis[J]. Proc Am Thorac Soc, 2012, 9 (3): 130-136. DOI:10.1513/pats.201201-003AW. |
| [10] | Viollet B, Guigas B, Sanz Garcia N, et al. Cellular and molecular mechanisms of metformin:an overview[J]. Clin Sci (Lond), 2012, 122 (6): 253-270. DOI:10.1042/CS20110386. |
| [11] | Park SJ, Lee KS, Kim SR, et al. AMPK activation reduces vascular permeability and airway inflammation by regulating HIF/VEGFA pathway in a murine model of toluene diisocyanate-induced asthma[J]. Inflamm Res, 2012, 61 (10): 1069-1083. DOI:10.1007/s00011-012-0499-6. |
| [12] | Li L, Huang W, Li K, et al. Metformin attenuates gefitinib-induced exacerbation of pulmonary fibrosis by inhibition of TGF-β signaling pathway[J]. Oncotarget, 2015, 6 (41): 43605-43619. DOI:10.18632/oncotarget.6186. |
| [13] | Park CS, Bang BR, Kwon HS, et al. Metformin reduces airway inflammation and remodeling via activation of AMP-activated protein kinase[J]. Biochem Pharmacol, 2012, 84 (12): 1660-1670. DOI:10.1016/j.bcp.2012.09.025. |
| [14] | Flechsig P, Dadrich M, Bickelhaupt S, et al. LY2109761 attenuates radiation-induced pulmonary murine fibrosis via reversal of TGF-β and BMP-associated proinflammatory and proangiogenic signals[J]. Clin Cancer Res, 2012, 18 (13): 3616-3627. DOI:10.1158/1078-0432.CCR-11-2855. |
| [15] | Tang X, Peng R, Phillips JE, et al. Assessment of Brd4 inhibition in idiopathic pulmonary fibrosis lung fibroblasts and in vivo models of lung fibrosis[J]. Am J Pathol, 2013, 183 (2): 470-479. DOI:10.1016/j.ajpath.2013.04.020. |
| [16] | Mihaylova MM, Shaw RJ. The AMPK signalling pathway coordinates cell growth, autophagy and metabolism[J]. Nat Cell Biol, 2011, 13 (9): 1016-1023. DOI:10.1038/ncb2329. |
| [17] | Sato N, Takasaka N, Yoshida M, et al. Metformin attenuates lung fibrosis development via NOX4 suppression[J]. Respir Res, 2016, 17 (1): 107 DOI:10.1186/s12931-016-0420-x. |
| [18] | Feng Y, Wang S, Zhang Y, et al. Metformin attenuates renal fibrosis in both AMPKα2-dependent and independent manners[J]. Clin Exp Pharmacol Physiol, 2017, 44 (6): 648-655. DOI:10.1111/1440-1681.12748. |
| [19] | Rube CE, Uthe D, Schmid KW, et al. Dose-dependent induction of transforming growth factor β (TGF-β) in the lung tissue of fibrosis-prone mice after thoracic irradiation[J]. Int J Radiat Oncol Biol Phys, 2000, 47 (4): 1033-1042. DOI:10.1016/S0360-3016(00)00482-X. |
| [20] | Kalluri R, Neilson EG. Epithelial-mesenchymal transition and its implications for fibrosis[J]. J Clin Invest, 2003, 112 (12): 1776-1784. DOI:10.1172/JCI20530. |
| [21] | Duffield JS. Cellular and molecular mechanisms in kidney fibrosis[J]. J Clin Invest, 2014, 124 (6): 2299-2306. DOI:10.1172/JCI72267. |
| [22] | Bahl A, Sharma DN, Rath GK, et al. Small molecular inhibitor of transforming growth factor-β protects against development of radiation-induced lung injury[J]. Int J Radiat Oncol Biol Phys, 2008, 72 (2): 630 DOI:10.1016/j.ijrobp.2008.05.057. |
| [23] | Pierotti MA, Berrino F, Gariboldi M, et al. Targeting metabolism for cancer treatment and prevention:metformin, an old drug with multi-faceted effects[J]. Oncogene, 2013, 32 (12): 1475-1487. DOI:10.1038/onc.2012.181. |
 2017, Vol. 37
2017, Vol. 37


