2. 510120 广州, 中山大学孙逸仙纪念医院神经外科;
3. 511500 清远, 广州医科大学附属第六医院神经外科
2. Department of Neurosurgery, Sun Yat-sen Memorial Hospital, Sun Yat-sen University, Guangzhou 510120, China;
3. Department of Neurosurgery, The Sixth Affiliated Hospital of Guangzhou Medical University, Qingyuan 511500, China
脑胶质瘤是最常见的成人颅内原发肿瘤,而胶质瘤在颅内呈浸润性生长,手术难以完全切除,因此,高级别胶质瘤术后需辅以放疗及同步化疗治疗,但预后仍然不佳[1-2]。因此,寻找新的胶质瘤治疗靶点或预后判断指标成为胶质瘤治疗的重要研究方向。PDLIM4基因又称为RIL基因(reversion-induced LIM), 该基因定位于5q31,并能与碱性磷酸酶、PDLIM1(PDZ and LIM domain 1) 共同构成PDZ-LIM蛋白的ALP亚家族,进而影响细胞骨架的形成及功能[3]。近年来有文献报道,在前列腺癌、急性淋巴细胞白血病细胞中PDLIM4基因可抑制细胞增殖并促进细胞凋亡[4-5]。但是通过对胶质母细胞瘤基因芯片GSE53733的数据分析却得到了与急性淋巴细胞白血病及前列腺癌不同的结果。因此,本研究旨在探讨PDLIM4基因在胶质瘤中的表达水平与患者预后的关系,并希望其能作为反映胶质瘤诊断及治疗的新生物学指标,成为胶质瘤治疗和研究的新靶点。
材料与方法1.基因芯片数据提取:基因表达综合(gene expression omnibus,GEO)数据库下载GSE53733基因芯片数据[6],基因芯片中的标本均为胶质母细胞瘤组织标本,其中,将生存期小于12个月的16例患者标本纳入为短期生存组;23例生存期超过36个月的患者标本纳入为长期生存组。本研究将短期生存组以及长期生存组基因数据进行对比及基因表达差异分析,选取表达差异最大的前100个基因制作热图,并进一步通过DAVID(The database for annotation, visualization and integrated discovery)数据库[7]对上述基因进行基因本体分析(gene ontology,GO)分析。
2.研究对象:收集2014年1月至2015年12月在中山大学孙逸仙纪念医院接受手术治疗的胶质瘤患者的病例资料以及病理标本,肿瘤病理分级按照世界卫生组织(World Health Organization,WHO)分级标准进行。入选标准:病理确诊为WHO Ⅰ~Ⅳ级的胶质瘤患者;病理资料完整者。排除标准:术前进行了放化疗或免疫治疗;术后未经规范化治疗患者;临床资料不完整。最终符合入选标准病例共40例。其中,男性患者23例,女性患者17例,患者平均年龄(44.5±14.3) 岁,肿瘤均位于幕上,第1例标本取材时间为2014年1月9日,最后1例标本取材时间为2015年2月28日,相关资料见表 1。将Ⅰ、Ⅱ级胶质瘤归为低级别胶质瘤组,将Ⅲ、Ⅳ级胶质瘤归为高级别胶质瘤组。所有病例均进行电话随访,确定生存时间,失访病例以最后1次返院复查时间为准。相关病例的生存时间观察终点为2017年1月1日。
|
|
表 1 40例不同病理分级胶质瘤患者基本资料 Table 1 The basic information of 40 glioma patients |
3. qPCR方法:TRIzol法提取胶质瘤标本中的总RNA并利用NanoDrop对提取液进行定量;利用日本TaKaRa公司反转录试剂盒对RNA进行反转录并获取cDNA样品。相关反应条件为:预变性95℃ 3 min,90℃ 30 s,56℃ 10 s,共40个循环并得到反转录产物cDNA以进行qPCR检测。选用GAPDH作为实验内参,相关引物序列:GAPDH正向引物:5′ GCACCGTCAAGGCTGAGAAC 3′,反向引物:5′ TGGTGAAGACGCCAGTGGA 3′,扩增长度267 bp;PDLIM4正向引物:5′ CCAGAAGATGGCAGACCAAG 3′,反向引物:5′ ACACATGCAGGGTGCTCAT 3′,扩增长度118 bp。参照GAPDH表达结果计算得到PDLIM4的CT值,CT值≥5.5的归为高表达组,< 5.5的归为低表达组。
4.细胞培养以及siRNA转染:细胞使用含10%胎牛血清的高糖DMEM(美国ThermoFisher公司)进行孵育,并置于5%二氧化碳恒温培养箱37℃进行培养,当细胞融合度达80%左右时进行传代。35 mm的细胞培养皿培养细胞,待皿内细胞密度达40%~60%时进行转染。使用DEPC水溶解siRNA并配置成20 μmol/L的储备液,取10 μl siRNA储备液与250 μl Opti-MEM,混匀制备为A液;另取5 μl lipofectamine 3000与250 μl Opti-MEM混匀制备为B液。A、B液室温静置5 min后混匀。去除培养皿内的含血清培养基,并加入1.5 ml Opti-MEM以及A、B液混合液,轻微晃动培养皿混匀。将细胞放入37℃培养箱中继续培养6 h,后将转染液换成完全培养基继续培养48~72 h。本研究通过上海吉玛公司构建了2条用于对PDLIM4进行干扰的siRNA序列,以及一条siRNA阴性(NC)对照序列;siRNA(1) 正向序列:5′ GGGAUCUCCAUAUGGACAAUU 3′,反向序列:5′ UUCCCUAGAGGUAUACCUGUU 3′;siRNA(2) 正向序列:5′ GUGGUUACUUCUUUCUGGAUU 3′,反向序列:5′ UUCACCAAUGAAGAAAGACCU 3′;siRNA-NC(siRNA阴性对照序列)对照正向序列:5′ UUCUCCGAACGUGUCACGUTT 3′,反向序列:5′ ACGUGACACGUUCGGAGAATT 3′。
5.Western blot实验方法:细胞融合度达80%提取总蛋白,每个30 mm的培养皿加入50 μl RIPA裂解液,冰上静置30 min后将裂解液收集于1.5 ml EP管,并置于4℃离心机,离心半径15 cm,12 000 r/min离心15 min,取上清。对蛋白定量、分装后100℃加热5 min。使用10% SDS-聚丙烯酰胺凝胶对分离蛋白样品,后转印至PVDF膜上(美国Millipore公司),一抗4℃孵育过夜,二抗室温孵育1 h,最后采用化学发光法对条带进行检测。一抗:α-tublin(1 :3 000, 鼠,美国ThermoFisher公司);PDLIM4(RIL, 1 :1 000,兔,美国Abcam公司)。鼠二抗及兔二抗均购于美国Thermofisher公司。使用ImageJ软件计算PDLIM4条带的灰度值,并进行组间灰度值比较。
6.细胞照射:使用6 MV X射线,源靶距为100 cm,剂量率为200 cGy/min,总剂量为2 Gy[8]。
7.四甲基偶氮唑盐(MTT)比色法:对细胞进行分组,将未进行任何siRNA转染的U87细胞设为U87,转染siRNA阴性对照序列的U87细胞设为U87 siRNA-NC细胞,转染了siRNA干扰序列的则设为U87 siRNA(1) 及(2) 细胞。上述细胞未经过照射处理的设为对照组,经过照射处理的设为观察组。观察组细胞经过照射处理后,继续培养12 h,然后对照组及观察组细胞均加入加入含5 mg/ml MTT试剂(美国Sigma公司)40 μl,培养箱继续培养1 h后弃培养基,并加入200 μl二甲基亚砜(DMSO,美国Sigma公司),振荡混匀后使用酶标仪检测570 nm波段的吸光度(A)值,并计算细胞活性。
8.细胞凋亡率检测:分别用siRNA-NA及siRNA(1) 序列转染U87细胞,并备注为siRNA-NA及siRNA(1) 细胞,将未经照射的细胞设为对照,使用射线照射的细胞设为照射处理组。细胞经过照射处理后12 h使用流式细胞仪对细胞凋亡率进行检测。使用不含乙二胺四乙酸(EDTA)的胰酶消化细胞,并收集至检测管内,离心半径14 cm,1 500 r/min离心5 min后去上清,磷酸盐缓冲液(PBS)清洗沉淀,离心半径14 cm,1 500 r/min离心5 min,加入200 μl Annexin V-FITC结合液重悬细胞,再依次加入5 μl Annexin V-FITC以及5 μl碘化丙啶染色液,混匀后避光孵育15 min后进行凋亡测定。计算Q2+Q3象限值作为细胞凋亡率。
9.统计学处理:数据使用SPSS 20.0以及GraphPad Prism 6.0软件进行分析。低级别以及高级别胶质瘤组间PDLIM4基因表达差异、细胞活力、细胞凋亡率等比较使用方差分析、χ2检验以及t检验(数据符合正态分布)进行分析,其中多个独立样本资料的均数的比较经方差齐性检验后采用方差分析进行计算。生存曲线由Kaplan-Meier法分析,使用Log-rank分析生存时间差异。P < 0.05为差异有统计学意义。
结果1.差异性表达基因绘制热图并进行GO分析:R软件对GSE53733基因芯片进行数据分析,选取在短期生存组及长期生存组中表达差异排序前100的基因进行分析,54个在短期生存组中表达升高的基因考虑为危险性因子,另外46个表达下降的基因则考虑为保护性因子,短期生存组中升高最明显的为PDLIM4基因(211564_s_at,logFC=1.055 897,P=0.000 491)。对这100个基因进行GO分析,富集程度最高的前5位为:GO:0032989(P=0.031 103)、GO:0016192(P=0.053 056)、GO:0006811(P=0.060 207),GO:0000902(P=0.089 856),GO:0048646(P=0.089 856),提示短时间生存组以及长时间生存组患者的肿瘤基因可能在细胞形态构成(P=0.031 103)、细胞囊泡转运(P=0.060 207) 及离子转运(P=0.053 056) 方面存在差异。
2. PDLIM4基因在不同级别胶质瘤中差异表达并与预后相关:通过对40例胶质瘤患者的肿瘤样品进行检测,PDLIM4基因在高级别组(WHO分级Ⅲ~Ⅳ级)中平均CT值为7.21±2.13,在低级别组胶质瘤(WHO分级Ⅰ~Ⅱ级)中平均CT值为4.61±0.97,高级别与低级别组胶质瘤组织中PDLIM4基因表达比较,差异有统计学意义(t=4.44,P < 0.05),其在高级别组胶质瘤中表达升高。将CT值≥5.5的归为高表达组,< 5.5的归为低表达组,绘制患者生存曲线,对40例患者进行生存分析提示PDLIM4高表达的胶质瘤患者生存时间较低表达组降低(χ2=5.52,P < 0.05),见图 1。
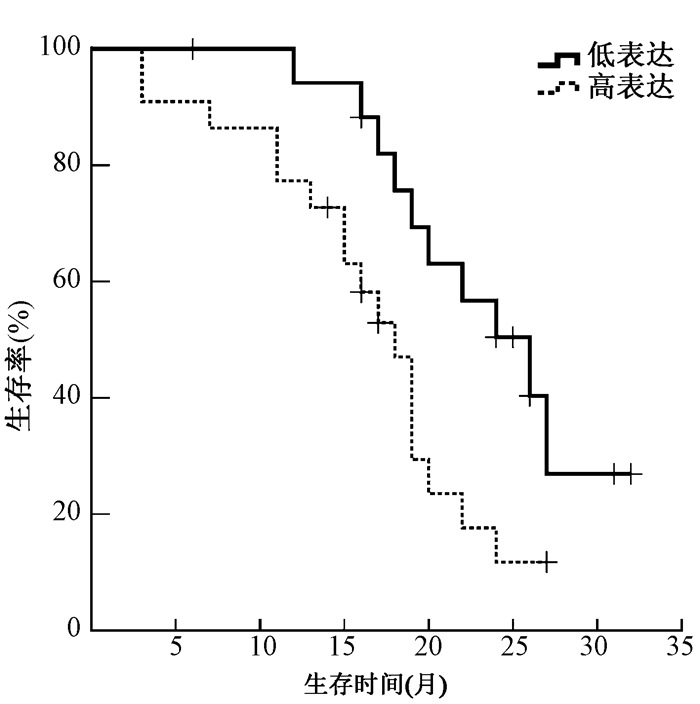
|
图 1 Kaplan-Meier法绘制两组胶质瘤患者生存曲线 +号代表删失(失访或终止观察时结局事件未发生) Figure 1 Survival curves of two groups of glioma patients |
3. PDLIM4基因与胶质瘤细胞X射线照射的敏感性相关:先使用Western blot证明设计的siRNA序列对U87细胞内PDLIM4表达具有干扰效能,与U87细胞(对照组)及siRNA阴性对照相比,siRNA(1)、siRNA(2) 能显著降低细胞内PDLIM4表达,使用ImageJ软件计算条带间灰度值并进行对比(t=55.40, P < 0.05),见图 2A。然后利用siRNA(1)、(2) 敲减细胞中PDLIM4的表达,并使用MTT法、细胞凋亡实验验证细胞对X射线照射的敏感性、凋亡率的改变。MTT法结果显示,经X射线照射后,siRNA(1)、siRNA(2) 两组细胞的细胞活力较U87、siRNA-NC两组细胞显著下降(F=18.99, P < 0.05),PDLIM4与照射敏感性相关,见图 2B。进一步使用siRNA-NC,siRNA(1) 对U87细胞进行转染,分别备注为siRNA-NC细胞及siRNA(1) 细胞。经照射处理后,siRNA-NC细胞凋亡率为37.9%,siRNA(1) 细胞凋亡率为59.1%,与siRNA-NC细胞对比,敲减了PDLIM4基因表达的siRNA(1) 细胞凋亡率增加(t=35.99,P < 0.05),见图 3。
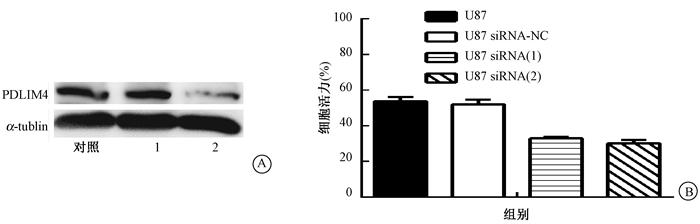
|
图 2 U87细胞PDLIM4的表达下降对细胞放射敏感性的影响A. PDLIM4基因Western blot结果;B. MTT法检测各组细胞活力 注:1.转染siRNA阴性对照(siRNA-NC)的U87细胞;2.转染siRNA(1) 的U87细胞;siRNA(1)、siRNA(2) 与U87 siRNA-NC、U87比较,F=18.99, P<0.05 Figure 2 Effect of down-regulated PDLIM4 on radiosensitivity of U87 cells A. Western blot assay of PDLIM4; B. Cell viability detected by MTT |
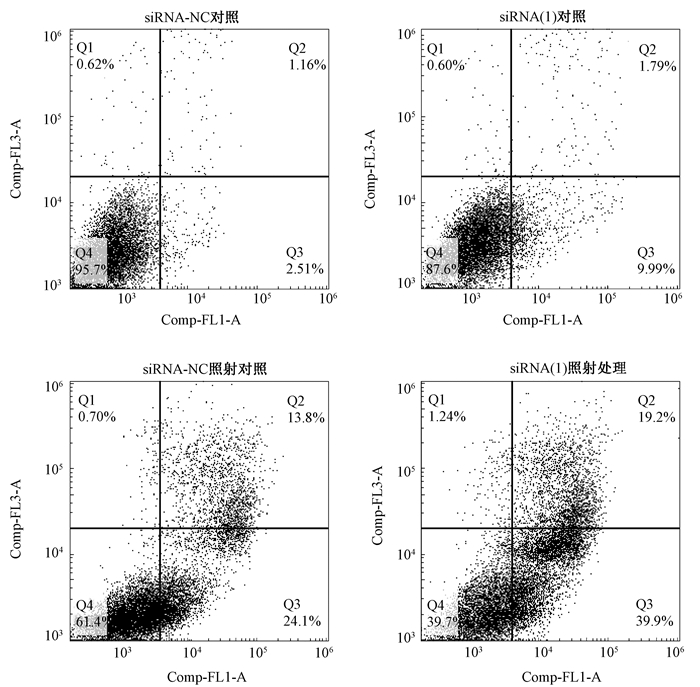
|
图 3 PDLIM4基因siRNA转染的U87细胞及阴性对照的细胞凋亡率检测 Figure 3 Apoptosis assay of U87 cells transferred by PDLIM4 siRNA and its negative control |
讨论
恶性胶质瘤死亡率极高,其5年病死率在全身肿瘤中排第3位,仅次于胰腺癌和肺癌。目前胶质瘤的治疗预后不佳[1-2]。因此,找到并研究与胶质瘤恶性程度以及预后相关的因子,对推动胶质瘤的治疗具有重要意义。
本研究通过对GEO数据库的检索,获得了胶质母细胞瘤基因芯片GSE53733的70例胶质母细胞瘤基因样本,利用生物信息学技术,通过对患者的数据进行分析,得到了多个与胶质瘤预后有关的基因,而差异性最大的前100个基因则是最有可能对胶质瘤患者预后产生不良影响的重要因素。而通过对这100个基因的生物学功能进行的GO分析表明,肿瘤细胞形态组份的构成方面存在着显著的差异性。而在这100个差异基因中,PDLIM4基因是短时间生存组中差异性表达最高的基因,同时该基因参与了细胞骨架形成及功能[3]。结合GO分析的结果,可以推测PDLIM4与胶质瘤患者的预后具有重要的相关性。但是目前国内外的许多研究均报道PDLIM4基因是膀胱癌及急性粒细胞白血病等的保护性因子,能抑制肿瘤细胞的生长及细胞集落的形成[8-11],这与胶质瘤芯片分析所得出的结论是截然相反的。造成这种差异的原因,可能存在以下两种可能性:PDLIM4的功能确实存在着组织差异性。GSE53733基因芯片可能存在抽样误差。为了验证这两个设想,本研究在细胞水平以及组织标本水平上对PDLIM4基因的功能展开了初步验证。
通过对40例胶质瘤组织标本的qPCR检测,提示了PDLIM4基因在不同级别胶质瘤中的表达具有差异性,因此,对该基因表达水平的测定有助于对胶质瘤恶性程度进行判断。此外,生存曲线分析则再次证实了PDLIM4与胶质瘤患者的预后具有的密切关系。但是,PDLIM4基因影响胶质瘤患者的预后的相关机制却不清楚。因此,本研究进一步构建了PDLIM4基因的siRNA干扰序列,并以U87细胞系作为工具细胞对PDLIM4生物学功能进行了初步探索。通过MTT实验及细胞流式实验发现了干扰PDLIM4基因表达后细胞对X射线照射的敏感性增加,细胞凋亡率升高。因此,该实验结果提示PDLIM4基因对胶质瘤患者预后的影响可能与肿瘤对放射敏感性有关,PDLIM4基因表达降低可能促使肿瘤细胞对放疗更为敏感。而放疗是胶质瘤综合治疗的重要手段,一旦肿瘤发生了放疗抵抗,将对患者的预后产生十分不利的影响。因此,PDLIM4对放射敏感性的调节作用很可能是影响胶质瘤患者预后的重要机制。但目前与PDLIM4基因相关的机制研究尚不多,本研究发现PDLIM4具有调节胶质瘤细胞放射敏感性的生物学作用,在后续的研究中,对该基因具体的生物学特性将展开更为深入的研究。
综上所述,PDLIM4基因是影响胶质瘤患者预后的重要因子,通过对胶质瘤组织中PDLIM4基因的检测能判断胶质瘤的恶性程度,并对患者预后做出预测。因此,PDLIM4基因有望作为反映胶质瘤诊断及治疗的新生物学指标,并为改善胶质瘤患者预后提供帮助。
利益冲突 无作者贡献声明 罗铭负责实验设计与论文撰写;蔡望青负责论文修改;李凯舒负责生物信息学资料收集;刘家豪负责细胞及PCR实验;薛卫平负责病例回访;刘宜敏负责数据整理
| [1] | Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352 (10): 987-996. DOI:10.1056/NEJMoa043330. |
| [2] | Mirimanoff RO, Gorlia T, Mason W, et al. Radiotherapy and temozolomide for newly diagnosed glioblastoma:recursive partitioning analysis of the EORTC 26981/22981-NCIC CE3 phase Ⅲ randomized trial[J]. J Clin Oncol, 2006, 24 (16): 2563-2569. DOI:10.1200/JCO.2005.04.5963. |
| [3] | Vallenius T, Luukko K, Mäkelä TP. CLP-36 PDZ-LIM protein associates with nonmuscle alpha-actinin-1 and alpha-actinin-4[J]. J Biol Chem, 2000, 275 (15): 11100-11105. DOI:10.1074/jbc.275.15.11100. |
| [4] | Jelinek J, Gharibyan V, Estecio MR, et al. Aberrant DNA methylation is associated with disease progression, resistance to imatinib and shortened survival in chronic myelogenous leukemia[J]. PLoS One, 2011, 6 (7): e22110 DOI:10.1371/journal.pone.0022110. |
| [5] | Vasiljević N, Wu K, Brentnall AR, et al. Absolute quantitation of DNA methylation of 28 candidate genes in prostate cancer using pyrosequencing[J]. Dis Markers, 2011, 30 (4): 151-161. DOI:10.3233/DMA-2011-0790. |
| [6] | Reifenberger G, Weber RG, Riehmer V, et al. Molecular characterization of long-term survivors of glioblastoma using genome-and transcriptome-wide profiling[J]. Int J Cancer, 2014, 135 (8): 1822-1831. DOI:10.1002/ijc.28836. |
| [7] | Huang DW, Sherman BT, Lempicki RA. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4 (1): 44-57. DOI:10.1038/nprot.2008.211. |
| [8] | Arora H, Qureshi R, Jin S, et al. miR-9 and let-7g enhance the sensitivity to ionizing radiation by suppression of NFκB1[J]. Exp Mol Med, 2011, 43 (5): 298-304. DOI:10.3858/emm.2011.43.5.031. |
| [9] | Boumber YA, Kondo Y, Chen X, et al. RIL, a LIM gene on 5q31, is silenced by methylation in cancer and sensitizes cancer cells to apoptosis[J]. Cancer Res, 2007, 67 (5): 1997-2005. DOI:10.1158/0008-5472.CAN-06-3093. |
| [10] |
李云, 钱军, 陈芹, 等. 慢性髓系白血病PDLIM4基因表达与其启动子甲基化水平的关系[J].
江苏大学学报(医学版), 2013 (1): 17-21. Li Y, Qian J, Chen Q, et al. Expression pattern and promoter hypermethylation of PDLIM4 gene in patients with chronic myeloid leukemia[J]. J Jiangsu Univ Med Edit, 2013 (1): 17-21. DOI:10.13312/j.issn.1671-7783.2013.01.003. |
| [11] |
李先哲, 司曼飞, 郭艳霞, 等. 抑癌基因PDLIM4在前列腺癌细胞中的差异表达[J].
山东大学学报(医学版), 2013 (6): 34-39. Li XZ, Si MF, Guo YX, et al. Differential expression and regulation of PDLIM4 in prostate cancer cells[J]. J Shandong Univ (Health Sci), 2013 (6): 34-39. DOI:10.6040/j.issn.1671-7554.2013.06.008. |
 2017, Vol. 37
2017, Vol. 37
