2. 266071 青岛, 解放军第四○一医院全军临床航海医学中心 ;
3. 266071 青岛大学公共卫生学院职业卫生教研室 ;
4. 266071 青岛大学研究生院
2. Department of Hyperbaric Medicine, No. 401 Hospital of PLA, Qingdao 266071, China ;
3. Department of Occupational Health, School of Public Health, Qingdao University, Qingdao 266071, China ;
4. Graduate School, Qingdao University, Qingdao 266071, China
树莓是蔷薇科悬钩子属的多年生落叶性灌木型果树,又称托盘、 悬钩子、 覆盆子等[1],树莓籽富含花青素、 鞣化酸、 黄酮、 抗败血酸等物质[2],这些物质具有良好的抗氧化性。花青素能有效降低毛细血管通透性、 调控细胞周期活性,有清除自由基和良好的还原能力;树莓籽中鞣化酸的含量居各食物之首[3],为较强的抗氧化剂,是天然的抗致癌物质;黄酮类有很好的自由基清除、 抗氧化和抗菌作用;抗坏血酸即维生素C,是一种自由基清除剂,将维生素E转化为其活性形式参与抗氧化反应[4]。本实验将复方树莓籽粉作为一种预防性抗氧化剂,观察其对急性放射性损伤大鼠的抗氧化效果,以期为放疗患者急性放射性损伤的防治提供实验依据。
材料与方法1. 动物及分组:清洁级、 健康成年雄性Wistar大鼠40只,体质量(200±20)g,由青岛市实验动物和动物实验中心提供,合格证号:SCXK鲁2014-0001,于光照明暗12 h交替、 自由饮水进食、 温度(23±2)℃、 湿度适宜的环境中适应性饲养。1周后,按随机数字法将实验动物分为4组:空白对照组、 单纯照射组、 维生素组、 复方树莓籽粉组。每组10只,分笼喂养。
2. 实验材料及主要实验仪器:复方树莓籽粉(山东黑尚莓生物技术发展股份有限公司);维生素E(上海蓝季生物科技有限公司);维生素C(大连美仑生物有限公司);超氧化物歧化酶(SOD)试剂盒及谷胱甘肽过氧化物酶(GSH-PX)试剂盒(南京建成生物工程研究所);鼠外周血淋巴细胞分离液(天津灏洋生物制品科技有限公司)。
VARIAN21EX直线加速器由美国瓦里安公司生产(由解放军第401医院提供);722E型可见分光光度计由上海光谱仪器有限公司生产;Sunrise光吸收酶标仪由瑞士Tecan公司生产。
3. 动物处理:实验动物适应性喂养1周后,空白对照不做任何处理 、 单纯照射组行X射线全身一次性照射8 Gy,维生素组维生素E(30 mg/kg)和维生素C(50 mg/kg)混合灌胃,复方树莓籽组复方树莓籽粉(2.5 g/kg)灌胃,维生素和复方树莓籽粉皆用生理盐水溶解至2 ml,连续灌胃7 d,自由饮水和进食。
4. 动物模型的建立: 单纯照射组、 维生素组和复方树莓籽粉组大鼠第7天灌胃结束后1 h进行X射线全身一次性照射,总剂量为8 Gy,吸收剂量率为400 cGy/min,源皮距100 cm,照射野为80 cm×80 cm,建立急性放射性损伤大鼠模型。
5. 血样采集:大鼠照射后禁食,24 h后10%水合氯醛麻醉,腹主动脉取血5 ml,加入到肝素钠抗凝管中,混匀,部分送检测进行血细胞计数,部分全血分离淋巴细胞用于DNA损伤分析,部分全血用作GSH-PX活力测定,部分离心后获取血浆测SOD活力和丙二醛(MDA)含量。
6. SOD、 MDA、 GSH-PX指标和血细胞计数的测定:血浆SOD活力采用WST-1法测定,酶标仪波长为450 nm;血浆MDA含量采用硫代巴比妥酸(TBA)法测定,测定波长532 nm;全血GSH-PX酶活力采用比色法波长412 nm测定;WBC和PLT检测采用阻抗法进行计数。
7. DNA损伤的检测和分析:采用的碱性单细胞凝胶电泳法(SCGE),是一种敏感快速的DNA断裂损伤分析技术。主要步骤包括淋巴细胞的分离和DNA损伤的处理、 双层琼脂的制备、 溶解液的处理、 电泳液的制备、 电泳、 中和、 染色和"彗星"图像半定量分析。正常的淋巴细胞的细胞核应为大、 圆、 亮,而细胞核不同程度的损伤经荧光染色后可出现"彗星"图像,"彗星"图像包括头部和尾部,根据两者的比例大小分为0、 Ⅰ、 Ⅱ、 Ⅲ、 Ⅳ 5个等级。0级无尾部,只是一个明亮的圆核,表明DNA无损伤。当DNA断裂损伤的程度由轻到重,则彗星尾部逐渐变长、 变大,头部逐渐变小且荧光强度逐渐变弱。实验分析时,每个样本观察处理100个细胞。使用的专用单位(arbitrary units,AU)[5]是一种根据拖尾的长度衡量DNA链断裂损伤程度的特有单位,把不同的分级加以换算统计,得到DNA损伤的总体水平(AU=0级×0+1级×1+2级×2+3级×3+4级×4)。
8. 统计学处理:采用SPSS 21.0 统计软件进行数据分析,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,SOD、 GSH-PX\,MDA数据以x±s表示。P<0.05为差异有统计学意义。
结果1. 大鼠纳入实验的情况:单纯照射组1只大鼠在照射后24 h内死亡,腹部解剖后发现肠腔扩张、 胀气和黏膜充血,考虑死亡原因为放射性肠炎。
2.血浆SOD活力、 MDA含量和全血GSH-PX活力值的比较:由表 1可知与空白对照组比较,单纯照射组SOD活力和GSH-PX活力皆降低,MDA含量升高,差异有统计学意义(t=4.178、 2.251、 2.937,P<0.05);与单纯照射组比较,维生素组和复方树莓籽粉组SOD活力和GSH-PX活力皆有升高,MDA含量降低,差异有统计学意义(F =7.705、 3.851、 3.134,P<0.05)。
|
|
表 1 复方树莓籽粉对大鼠SOD、 MDA和 GSH-PX的影响(x±s) Table 1 Effect of compound raspberry seed powder on antioxidant enzyme activity(x±s) |
3. 各组大鼠白细胞、 血小板的检测结果:由表 2可知与空白对照组比较,单纯照射组大鼠WBC、 PLT数明显降低,差异有统计学意义(t=7.842、 3.985,P<0.01);与单纯照射组比较,维生素组和复方树莓籽粉组大鼠WBC、 PLT数增加,差异有统计学意义(F =14.869、 6.376,P<0.05)。
|
|
表 2 复方树莓籽粉对大鼠WBC、 PLT的影响(x±s) Table 2 Effect of compound raspberry seed powder on WBC and PLT(x±s) |
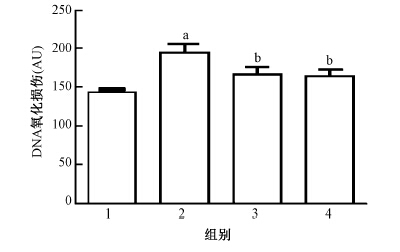
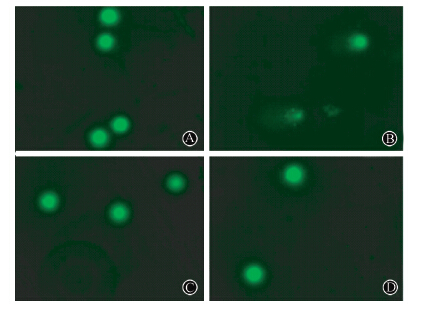
4. 淋巴细胞DNA损伤情况的分析:由图 1可知,与空白对照组比较,单纯照射组淋巴细胞DNA损伤较为严重,差异有统计学意义(t=3.997,P<0.05);与单纯照射组比较,维生素组和复方树莓籽粉组淋巴细胞DNA损伤较轻,差异有统计学意义(F =5.493,P<0.05)。由图 2可知,与空白对照组(图 2A)相比,单纯照射组淋巴细胞DNA严重损伤,彗星尾部延长(图 2B),维生素组(图 2 C)和复方树莓籽粉组(图 2 D)淋巴细胞DNA损伤较轻。
|
图 1 复方树莓籽粉对大鼠淋巴细胞DNA AU值的影响 注:1.空白对照组; 2.单纯照射组; 3.维生素组; 4.复方树莓籽粉组 a与空白对照组比较,t=3.997,P<0.05; b与单纯照射组比较,F=5.493,P<0.05 Figure 1 Effect of compound raspberry seed powder on oxidative DNA damage in lymphocytes 1. Control group; 2. Radiation group; 3. Vitamin group; 4. Compound raspberry seed powder group |
|
图 2 复方树莓籽粉对大鼠淋巴细胞DNA的影响 ×400 A. 空白对照组; B. 单纯照射组; C. 维生素组; D.复方树莓籽粉组 Figure 2 Effect of compound raspberry seed powder on DNA in lymphocytes ×400 A. Normal control group; B. Radiation group; C. Vitamin group; D. Compound raspberry seed powder group |
讨论
随着肿瘤发病率的增加,放射治疗变得越来越普遍,对于放疗产生的损伤目前并没有统一有效的解决办法。放疗后患者体内产生大量的活性氧(reactive oxygen species,ROS),ROS在电离辐射导致的细胞损伤中发挥重要作用[6-7],导致DNA链断裂、 脂质过氧化和蛋白质变性等。如果氧化应激超过机体自我调节能力,血红蛋白、 细胞膜和酶将发生退行性改变,进而导致细胞功能紊乱[8]。
树莓全身都是宝,据《本草纲目》记载:"其(树莓)茎、 根、 叶、 籽皆可入药,味甘性平,无毒;益肾固精,补肝明目,缩尿"。树莓籽油具有抗炎、 防晒、 滋润、 抗氧化性和耐储性等优于其他著名芳香油的优点[9]。
关于树莓籽的现代药理学研究并不透彻,Sariburun等[10]使用ABTS、 DPPH自由基清除法、 CUPRAC铜离子还原法检测树莓的抗氧化活性发现其甲醇提取物中含量最高的有总酚及总黄酮类,其水提取物含量最高的是花青素类,树莓的抗氧化活性值与花青素的含量呈高度相关性(0.93≤r≤0.99,P=0.05),与总黄酮类含量也呈高度的相关性(0.91≤r≤0.93,P=0.05)[11]。经诺安检测复方树莓籽粉中含近百种成分,其中最主要的有效成分为原花青素OPC 1.24 g/100 g,维生素E 3.37 mg/100 g,维生素C 1.04 mg/100 g等。复方树莓籽粉中众多成分皆具有很好的抗氧化活性,其中最主要成分为原花青素,人体原花青素的食用量每天最高约300 mg/kg,根据美国食品药品监督管理局(FDA)发布的动物与人体等效剂量的换算公式计算得到给予大鼠原花青素灌胃的最高剂量为每天125 mg/kg,最后根据复方树莓籽粉含原花青素的百分比,认为大鼠进行复方树莓籽粉灌胃的最适合剂量为每天2.5 g/kg。
造血系统是对辐射最敏感的系统之一,表现在外周血中白细胞、 红细胞和血小板数目降低[12]。实验结果显示,预防性使用复方树莓籽粉能有效改善辐射对造血系统的损伤。Whiteman等[13]发现辐射诱导生成活性氧的机制可能是存在于线粒体内的泛半醌将一个电子转移给氧分子形成超氧离子,从而间接损伤DNA。辐射也可通过电离和激发作用于DNA化学键使其断裂[14]。本实验用彗星实验来评估淋巴细胞DNA的损伤程度。无论是通过统计学计算还是显微镜下肉眼所见,都可明显观察到维生素和复方树莓籽粉极好地减轻了放射对淋巴细胞DNA的损伤作用。
SOD活力是组织过氧化程度的一个重要指标,当机体受到一定量的辐射刺激后,SOD活力明显降低[15]。GSH-PX是体内重要的抗氧化酶,通过清除脂质过氧化物和过氧化氢,从而保护细胞质内或细胞膜上的脂质、 核酸类和蛋白质免受ROS的氧化损伤[16]。本研究采取SOD、 GSH-PX和MDA作为测量指标,单纯照射组前两者活力明显下降,MDA含量升高,说明机体受到严重的氧化损伤,而复方树莓籽粉组酶活力较高,MDA含量也相对单纯照射组低,实验证明预防性使用抗氧化性维生素和复方树莓籽粉对急性放射性损伤大鼠有很好的防治作用。虽然维生素和复方树莓籽粉对大鼠急性放射性损伤的防治效果近似,但目前滥用维生素的现象日益严重,人体过量蓄积甚至发生不良反应,而复方树莓籽粉效价低,安全性更高。
综上所述,实验证明预防性应用复方树莓籽粉可以有效地增强抗氧化酶活性,并且降低淋巴细胞DNA损伤程度,为今后研发新的辐射防护药提供了方向。
利益冲突 本人与本人家属、 其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 王祯祯参与实验设计、 实施、 评估、 资料收集及成文工作; 王海涛、 高光凯、 陈豪协助第一作者进行资料收集及实验实施;王斌对文章进行审校
| [1] | Ryan T.Wilkinson JM.Cavanagh HM. HM.Antibacterial activity of raspberry cordial in vitro[J]. Res Vet Sci , 2001, 71 (3) : 155-159 DOI:10.1053/rvsc.2001.0502 |
| [2] | 王敏, 边晓燕, 何秀丽. 树莓液对2型糖尿病大鼠肾功能保护作用机理研究[J]. 中医药信息 , 2010, 27 (5) : 104-106 Wang M, Bian XY, He XL. Action mechanism research of shumei juice on diabetic nephropathy in strptozotocin -induced diabetic rats[J]. Infor Trad Chin Med , 2010, 27 (5) : 104-106 DOI:10.3969/j.issn.1002-2406.2010.05.040 |
| [3] | 韩加, 刘继文. 树莓营养保健功效及开发前景[J]. 中国食物与营养 , 2008 (8) : 54-56 Han J, Liu JW. Health function of blue raspberry and its prospects[J]. Food Nutr Chin , 2008 (8) : 54-56 DOI:10.3969/j.issn.1006-9577.2008.08.018 |
| [4] | Frei B.England L.Ames BN. Ascorbate is an outstanding antioxidant in human blood plasma[J]. Proc Natl Acad Sci USA , 1989, 86 (16) : 6377-6381 DOI:10.1073/pnas.86.16.6377 |
| [5] | Chao JC, Huang CH, Wu SJ, et al. Effects of beta-carotene, vitamin C and E on antioxidant status in hyperlipidemic smokers[J]. J Nutr Biochem , 2002, 13 (7) : 427-434 DOI:10.1016/S0955-2863(02)00188-2 |
| [6] | Akk se A, Omer B, Yiğitbaşi A. DNA damage and glutathione content in radiology technicians[J]. Clin Chim Acta , 2003, 336 (1-2) : 13-18 DOI:10.1016/S0009-8981(02)00421-7 |
| [7] | Kocer I, Taysi S, Ertekin MV, et al. The effect of L-carnitine in the prevention of ionizing radiation-induced cataracts:a rat model[J]. Graefes Arch Clin Exp Ophthalmol , 2007, 245 (4) : 588-594 DOI:10.1007/s00417-005-0097-1 |
| [8] | Nazima B, Manoharan V, Miltonprabu S. Oxidative stress induced by cadmium in the plasma, erythrocytes and lymphocytes of rats:Attenuation by grape seed proanthocyanidins[J]. Hum Exp Toxicol , 2016, 35 (4) : 428-447 DOI:10.1177/0960327115591376 |
| [9] | 王竹, 阳淑. 树莓开发前景巨大[J]. 四川农业科技 , 2008 (12) : 13 Wang Z, Yang S. The development prospect of raspberry[J]. Sci Technol Sichuan Agric , 2008 (12) : 13 DOI:10.3969/j.issn.1004-1028.2008.12.006 |
| [10] | Sariburun E, Sahin S, Demir C, et al. Phenolic content and antioxidant activity of raspberry and blackberry cultivars[J]. J Food Sci , 2010, 75 (4) : C328-335 DOI:10.1111/j.1750-3841.2010.01571.x |
| [11] | 李琼, 刘永忠, 蒋贤宝, 等. 树莓药理作用综述[J]. 实用中西医结合临床 , 2016, 16 (3) : 92-94 Li Q, Liu YZ, Jiang XB, et al. The pharmacological effects of raspberry[J]. Pract Clinical J Integr Tradit Chin West Med , 2016, 16 (3) : 92-94 DOI:10.13638/j.issn.1671-4040.2016.03.050 |
| [12] | 靳瑾, 白佳利, 龙伟, 等. 吡咯烷二硫代氨基甲酸盐对急性辐射损伤小鼠的防护作用[J]. 中华放射医学与防护杂志 , 2015, 35 (4) : 257-260 Jin D, Bai JL, Long W, et al. The protective effect of pyrrolidine dithiocarbamate on acute radiation injury in mice[J]. Chin J Radiol Med Prot , 2015, 35 (4) : 257-260 DOI:10.3760/cma.j.issn.0254-5098.2015.04.005 |
| [13] | Whiteman M, Hong HS, Jenner A, et al. Loss of oxidized and chlorinated bases in DNA treated with reactive oxygen species:implications for assessment of oxidative damage in vivo[J]. Biochem Biophys Res Commun , 2002, 296 (4) : 883-889 DOI:10.1016/S0006-291X(02)02018-1 |
| [14] | 陈英. 辐射所致DNA损伤与肿瘤风险[J]. 癌变·畸变·突变 , 2011, 23 (6) : 473-475 Chen Y. The risk of DNA damage and tumor induced by radiation[J]. Carcinog Teratogenesis Mutagen , 2011, 23 (6) : 473-475 DOI:10.3969/j.issn.1004-616x.2011.06.017 |
| [15] | Orhon ZN, Uzal C, Kanter M, et al. Protective effects of Nigella sativa on gamma radiation-induced jejunal mucosal damage in rats[J]. Pathol Res Pract , 2016, 212 (5) : 437-443 DOI:10.1016/j.prp.2016.02.017 |
| [16] | Yüksel M, Nazıroğlu M, Özkaya MO. Long-term exposure to electromagnetic radiation from mobile phones and Wi-Fi devices decreases plasma prolactin, progesterone, and estrogen levels but increases uterine oxidative stress in pregnant rats and their offspring[J]. Endocrine , 2016, 52 (2) : 352-362 DOI:10.1007/s12020-015-0795-3 |
 2017, Vol. 37
2017, Vol. 37


