乳腺癌是全球中年女性最常见的恶性肿瘤之一。近年来我国女性乳腺癌的发病率呈现逐年上升的趋势[1]。体外实验模型和动物模型均提示,乳腺癌的发生发展与γ-突触核蛋白(γ-synuclein,SNCG)有着密切的联系[2]。在一些浸润型以及恶性程度高的乳腺癌中能够检测到SNCG的表达,但是在一些良性的乳腺癌以及乳腺炎症疾病中,检测不到SNCG。因此,有学者认为SNCG能够作为预测乳腺癌恶性程度的一个良好的因子[3-4]。本研究依据RNA干扰原理,以SNCG基因为靶点,以乳腺癌细胞为研究对象,通过选择SNCG siRNA瞬时转染T47D乳腺癌细胞,研究抑制SNCG表达后乳腺癌细胞受到γ射线照射后克隆形成率及增殖能力变化,探讨乳腺癌SNCG基因靶向RNA干扰治疗的可行性,并对其作用的信号通路进行初步研究。
材料与方法1.细胞与试剂:乳腺癌T47D细胞系购自中国医学科学院肿瘤细胞库。胎牛血清和RPMI 1640培养液均为美国GIBCO公司,Lipofectamine RNAi MAX(美国Invitrogen公司),反转录试剂盒(美国Promega公司),Real-time PCR试剂(美国ABI公司),鼠抗人SNCG抗体由北京大学肿瘤医院生化与分子生物学研究室寿成超老师馈赠,p-AKT、 AKT、 p-mTOR、 mTOR、 β-肌动蛋白抗体均购自美国CST公司,HRP标记山羊抗兔及抗鼠二抗(北京中杉金桥公司),二喹啉甲酸(BCA)蛋白浓度检测试剂盒(美国Thermo Scientific公司),CCK-8试剂盒(日本同仁化学公司)。
2.SNCG基因siRNA片段的设计与合成:根据siRNA设计原则,合成针对人SNCG基因的2组siRNA序列及阴性对照。SNCG siRNA1:正义链:5' GAAUGUUGUACAGAGCGUtt 3',反义链:5' CACGCUCUGUACAACAUUCtc 3';SNCG siRNA2:正义链:5' CCUCUGCCUUGGACACCAUtt 3',反义链:5' AUGGUGUCCAAGGCAGAGGag 3'。
3. 细胞培养和转染:将液氮保存的T47D乳腺癌细胞取出后迅速置于37℃水浴箱中溶解。将细胞悬液吸取到离心管中,加入RPMI 1640培养液2 ml,1 000 r/min,离心半径147 mm,离心8 min。弃上清,加入适量培养液后吹打成悬液后移至培养瓶中,置于37℃、 5% CO2培养箱内培养,24 h观察生长情况。将细胞分成4组,即转染SNCG siRNA1(干扰1组)、 SNCG siRNA2(干扰2组)、 阴性对照组以及正常T47D细胞的空白对照组。转染T47D乳腺癌细胞步骤参照Lipofectamine RNAiMAX说明书,继续放入37℃、 5%CO2培养箱中培养。
4. 乳腺癌细胞照射:将细胞分为转染SNCG siRNA组、 阴性对照组和空白对照组。将上述各组细胞培养至贴壁覆盖65%。采用北京师范大学化学学院60Co γ射线照射细胞,照射剂量为0、 2、 4、 6、 8 Gy,源靶距为90 cm,吸收剂量率为0.5 Gy/min。
5. RT-PCR检测SNCG基因表达水平:用TRIzol试剂盒提取T47D乳腺癌细的总RNA,定量后按反转录试剂盒说明书合成cDNA。采用SYBR Green法定量检测SNCG表达,β-肌动蛋白(NM001101)作为内参照。PCR引物均由上海生物工程公司合成。SNCG引物序列:上游:5' ATGGATGTCTTCAAGAAGGG 3',下游:5' CTCTGTACAACATTCTCCTT 3'。每组均设3个复孔,每次实验重复3次,将所得结果按2-ΔΔCt分析,即可检测出样品SNCG mRNA表达。
6. Western blot检测T47D细胞中SNCG蛋白的表达:分别提取各实验组细胞的总蛋白,用喹啉甲酸(BCA)蛋白浓度测定试剂盒测定蛋白浓度,上样总蛋白50 μg,经8%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳(SDS-PAGE)后,湿转法将凝胶转移到硝酸纤维素薄膜。转膜完成后,将膜用5%牛血清蛋白V(BSA)室温封闭1 h。之后加入SNCG一抗(1∶1 000稀释),置于摇床上4℃孵育过夜。次日,膜用洗涤缓冲液(TBST)洗涤3次,每次10 min,洗膜后加入二抗(1∶3 000),再次TBST洗涤3次,每次10 min,最后暗室曝光,用超敏酶促增强化学发光法(ECL)化学发光试剂检测蛋白条带。
7. CCK-8检测细胞增殖能力:将各组细胞调整细胞浓度为105,接种于96孔板(100 μl),各组细胞设5个复孔,培养24 h后每孔中加入10 μl CCK-8溶液,将培养板置于培养箱中继续培养4 h,酶标仪测定450 nm波长处的吸光度(A)值。
8. 集落形成实验检测细胞存活率:将稳定生长的单克隆转染SNCG siRNA的乳腺癌细胞单细胞悬液接种到6孔板。设置500、 750、 1 000、 2 000、 4 000/孔,贴壁生长。按照0、 2、 4、 6、 8 Gy照射,每组3个复孔。将照射后的细胞置于5% CO2,37℃培养箱中培养2周,注意细胞生长状态,定期换液。直至肉眼可见培养板中细胞克隆,培养停止,结晶紫染色。显微镜下观察到的>50个的细胞克隆计数。计算克隆率(克隆率=生成克隆数/接种细胞数量)和细胞存活率(细胞存活率=照射细胞的克隆率/对照组细胞克隆率)。
9. Western blot检测细胞AKT信号通路蛋白:取各组细胞,加含有蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液,于4℃下孵育30 min,14 000 r/min,离心半径147 mm,离心30 min,上清液即为总蛋白成分。用BCA法测定蛋白浓度,加入上样缓冲液于95℃下变性5 min。上样总蛋白量为30 μg,于SDS-PAGE进行分离。随后将蛋白转移至硝酸纤维素膜上,用5%脱脂牛奶封闭1 h后加一抗(抗p-Akt、 Akt、 p-mTOR、 mTOR、 GAPDH ),于4℃下摇床过夜,次日TBST洗膜3次,每次10 min;加入二抗,于室温下孵育1 h,TBST洗膜3 次,每次10 min;用超敏ECL化学发光试剂检测蛋白条带,X光片曝光、 显影及定影,采用Image J图像分析软件测定蛋白条带的吸光度(A)值。
10. 统计学处理:数据符合正态分布,其中SNCG基因表达水平、 细胞增殖能力、 细胞存活率数据用x±s表示。采用SPSS 21.0软件包分析,上述3项数据组间比较采用t检验。P<0.05为差异有统计学意义。
结果1. 转染SNCGsiRNA干扰序列对SNCG表达的影响:在24、 48、 72 h分别检测各组细胞中SNCG表达,可见干扰1、 2组的SNCG mRNA表达量均较对照组降低(表 1),同样,Western blot结果显示,干扰1、 2组在转染48及72 h后SNCG的表达均明显下降(图 1)。
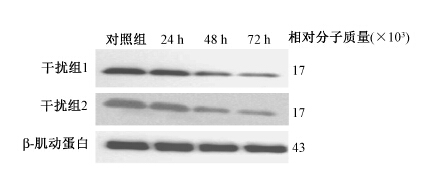
|
图 1 转染siRNA片段后不同时间蛋白水平检测SNCG表达 Figure 1 Expression of SNCG protein after siRNA transfection |
|
|
表 1 转染siRNA片段后不同时间mRNA水平 检测SNCG表达(x±s) Table 1 Expressions of SNCG in mRNA level after transfected siRNA(x±s) |
2. CCK-8检测SNCG转染T47D细胞的增殖:根据前述的研究结果,选取干扰1组研究转染后的T47D乳腺癌细胞受到6 Gy γ射线照射时细胞增殖能力的变化。根据测量的A值观察细胞生长增殖情况(表 2),可见转染组联合γ射线照射细胞生长速度在24、 48、 72 h均较其他对照组降低,表明干扰SNCG表达联合γ射线照射可明显抑制乳腺癌细胞的增殖。
|
|
表 2 转染siRNA片段联合射线照射后不同时间对细胞增殖能力的影响(x±s) Table 2 Cell proliferation of T47D cell treated with siRNA and irradiation together(x±s) |
3. 克隆形成实验检测细胞存活率:结果见表 3。未转染SNCG siRNA的乳腺癌细胞T47D的存活率较高,同时,在4、 6、 8 Gy照射下,转染SNCG的乳腺癌细胞数量明显低于对照组细胞(t=5.449、 8.882、 21.503,P<0.05),表明抑制SNCG表达能够增强乳腺癌细胞的放射敏感性,进而增强放疗效果。
|
|
表 3 不同照射剂量下各组细胞存活率(x±s) Table 3 Cell survival of T47D cell under different doses irradiation(x±s) |
4. Western blot检测AKT及mTOR磷酸化:如图 2所示,两条SNCG siRNA转染细胞后,可明显降低Akt和mTOR的磷酸化水平,而对总Akt和mTOR的含量没有影响。提示SNCG影响乳腺癌细胞对γ射线的敏感性与Akt信号通路活性的改变相关。
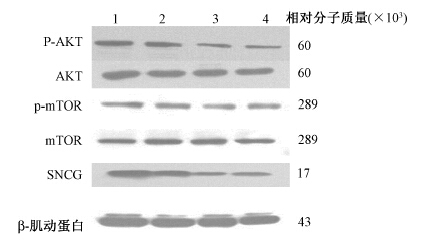
|
图 2 转染siRNA片段对AKT信号通路的影响 注:1. 空白对照组;2. 阴性对照组;3.干扰1组;4.干扰2组 Figure 2 Influence of SNCG siRNA on protein expressions of AKT signaling pathway |
讨论
乳腺癌对射线的抵抗性是导致放疗效果降低的主要原因[6]。随着基因组工程的完成以及精准医学概念的提出,越来越多的人将治疗癌症的目光放在了基因-放射疗法中,希望通过基因治疗达到治愈乳腺癌的效果。
Ji等[7]采用直接差异cDNA序列的方法,成功从人的乳腺癌cDNA文库中分离出来乳腺癌特异性基因1(breast cancer-specific gene,BCSG1)。随后,相关研究报道提示,BCSG1与阿尔茨海默病以及帕金森病等一系列神经系统的相关蛋白synuclein蛋白具有高度同源性,又称之为γ-synuclein(SNCG)[9]。研究发现,SNCG在乳腺癌的发生发展中阶段表达,并且SNCG的异常表达会刺激乳腺癌细胞的增殖,出现癌细胞转移情况,加重乳腺癌的病情[10-12]。
本研究通过瞬时转染SNCG siRNA片段进人乳腺癌细胞T47D后应用RT-PCR和Western blot法检测SNCG在基因和蛋白水平上的表达,结果显示成功转染SNCG siRNA片段的乳腺癌T47D细胞,抑制效果明显,说明了RNA的高效性和特异性,为进一步从整体水平研究SNCG基因的功能提供保证。在确保敲低SNCG表达后,按照转染组和对照组对细胞进行不同剂量γ射线照射,通过细胞克隆形成实验对细胞存活率分析提示,当照射剂量>4 Gy时,转染SNCG siRNA乳腺癌T47D细胞克隆数量明显降低,说明抑制SNCG表达可以增强乳腺癌细胞的辐射敏感性,从而加强乳腺癌放疗疗效。CCK-8实验也说明,转染SNCG siRNA的细胞再给予6 Gy射线照射,其增殖能力明显低于其他各组,这也为乳腺癌患者提供个性化放疗方案提供了理论依据。
P13K/Akt信号通路作为细胞内主要信号转导通路之一[13],在细胞代谢、 生长、 增殖、 凋亡、 分化中起重要作用。P13K/Akt信号通路异常激活与人体细胞的恶性转变及肿瘤细胞的迁移、 黏附、 血管生成、 外基质降解等相关,在肿瘤细胞恶性增殖、 转移及放化疗拮抗中显示重要作用,可作为预后不良的指标[14-15]。本研究结果显示,干扰组Akt磷酸化水平(p-Akt)有所下调,mTOR的磷酸化(p-mTOR)程度明显被抑制,提示SNCG可以通过调控Akt通路磷酸化来抑制乳腺癌细胞的凋亡。
近年来,随着肿瘤细胞生长、 增殖及凋亡深入研究,靶向治疗肿瘤有很大的可能性[16],siRNA介导靶向识别和切割同源性靶基因,抑制靶基因表达,实现特异性治疗肿瘤的目的[17]。越来越多的SNCG siRNA设计,给特异性识别内源性同源序列提供了希望。本研究通过特异性的siRNA同源序列,得到低表达SNCG的T47D细胞系,经γ射线照射后发现低表达SNCG的T47D对射线更敏感,肿瘤的增殖能力更弱。这一结果为以后靶向沉默SNCG表达,进而提高乳腺癌患者对射线的敏感性,提供了一个有利的证据。
利益冲突 作者无利益冲突,排名无争议,作者的配偶、 工作伙伴或子女不存在影响研究结果的财务关系,在此对研究的独立性和科学性予以保证作者贡献声明 吴丽娜负责实验设计、 数据整理及论文撰写;朴春南、 阮建磊参与实验研究;田梅、 刘建香负责参与实验设计,并在论文写作过程中给予指导
| [1] | 胡旭东, 焦旸, 王小玥, 等. B细胞易位基因2过表达增加人乳腺癌细胞T-47D的放射敏感性的研究[J]. 苏州大学学报(医学版) , 2011, 31 (1) : 21-25 Hu XD, Jiao Y, Wang XY, et al. Effects of BTG2 overexpression on the radiosensitivity of human breast cancer T-47D cells[J]. Suzhou Univ J Med Sci , 2011, 31 (1) : 21-25 |
| [2] | Veronesi U, Cascinelli N, Mariani L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J]. N Engl J Med , 2002, 347 (16) : 1227-1232 DOI:10.1056/NEJMoa020989 |
| [3] | Shen PH, Fan QX, Li YW, et al. SNCG shRNA suppressed breast cancer cell xenograft formation and growth in nude mice[J]. Chin Med J (Engl) , 2011, 124 (10) : 1524-1528 |
| [4] | Lavedan C, Leroy E, Torres R, et al. Genomic organization and expression of the human beta-synuclein gene (SNCB)[J]. Genomics , 1998, 54 (1) : 173-175 DOI:10.1006/geno.1998.5556 |
| [5] | 苏长青. 肿瘤的基因治疗:重新燃起的希望[J]. 临床肿瘤学杂志 , 2010, 15 (7) : 577-583 Su CQ. Cancer gene therapy:a rekindled hope[J]. Chin Clin Oncol , 2010, 15 (7) : 577-583 DOI:10.3969/j.issn.1009-0460.2010.07.001 |
| [6] | 李明, 周永, 谭宗才, 等. 三羟异黄酮对HER2/neu高表达人乳腺癌细胞辐射敏感性的影响[J]. 西南国防医药 , 2014, 24 (4) : 358-361 Li M, Zhou Y, Tan ZC, et al. Effect of genistein on radiosensitivity of breast cancer cells with high expression of HER2/neu[J]. Med J Nat Def Forc Southwest China , 2014, 24 (4) : 358-361 DOI:10.3969/j.issn.1004-0188.2014.04.004 |
| [7] | Ji H, Liu YE, Jia T, et al. Identification of a breast cancer-specific gene, BCSG1, by direct differential cDNA sequencing[J]. Cancer Res , 1997, 57 (4) : 759-764 |
| [8] | Lavedan C, Leroy E, Dehejia A, et al. Identification, localization and characterization of the human gamma-synuclein gene[J]. Hum Genet , 1998, 103 (1) : 106-112 DOI:10.1007/s004390050792 |
| [9] | Guo J, Shou C, Meng L, et al. Neuronal protein synuclein gamma predicts poor clinical outcome in breast cancer[J]. Int J Cancer , 2007, 121 (6) : 1296-1305 DOI:10.1002/ijc.22763 |
| [10] | He J, Xie N, Yang J, et al. siRNA-mediated suppression of synuclein γ inhibits MDA-MB-231 cell migration and proliferation by downregulating the phosphorylation of AKT and ERK[J]. J Breast Cancer , 2014, 17 (3) : 200-206 DOI:10.4048/jbc.2014.17.3.200 |
| [11] | Liang B, Wang XJ, Shen PH, et al. Synuclein-γ suppression mediated by RNA interference inhibits the clonogenicity and invasiveness of MCF-7 cells[J]. Oncol Lett , 2013, 5 (4) : 1347-1352 DOI:10.3892/ol.2013.1192 |
| [12] | Knobbe CB, Trampe-Kieslich A, Reifenberger G. Genetic alteration and expression of the phosphoinositol-3-kinase/Akt pathway genes PIK3CA and PIKE in human glioblastomas[J]. Neuropathol Appl Neurobiol , 2005, 31 (5) : 486-490 DOI:10.1111/j.1365-2990.2005.00660.x |
| [13] | Nyåkern M, Tazzari PL, Finelli C, et al. Frequent elevation of Akt kinase phosphorylation in blood marrow and peripheral blood mononuclear cells from high-risk myelodysplastic syndrome patients[J]. Leukemia , 2006, 20 (2) : 230-238 DOI:10.1038/sj.leu.2404057 |
| [14] | Rogers SJ, Box C, Harrington KJ, et al. The phosphoinositide 3-kinase signalling pathway as a therapeutic target in squamous cell carcinoma of the head and neck[J]. Expert Opin Ther Targets , 2005, 9 (4) : 769-790 DOI:10.1517/14728222.9.4.769 |
| [15] | Holen T, Amarzguioui M, Wiiger MT, et al. Positional effects of short interfering RNAs targeting the human coagulation trigger tissue factor[J]. Nucleic Acids Res , 2002, 30 (8) : 1757-1766 DOI:10.1093/nar/30.8.1757 |
| [16] | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells[J]. Proc Natl Acad Sci USA , 2002, 99 (9) : 6047-6052 DOI:10.1073/pnas.092143499 |
| [17] | Takei Y, Kadomatsu K, Yuzawa Y, et al. A small interfering RNA targeting vascular endotheilial growth factor as cancer therapeutics[J]. Cancer Res , 2004, 64 (10) : 3365-3370 DOI:10.2147/DDDT.S94122 |
 2017, Vol. 37
2017, Vol. 37


