2. 215006 苏州大学附属第一人民医院
2. First Affiliated Hospital of Soochow University, Suzhou 215000, China
代谢组学是研究生物体系受外部刺激或扰动后所产生的内源性代谢物整体及其变化规律的一项重要生物学技术,己成为系统生物学的重要组成部分[1],在新药研发、 疾病诊断与标志物发现以及发病机制阐明等领域得到广泛应用[1-3]。已有的动物实验表明,应用高通量、 快速的代谢组学技术筛选辐射损伤标志物并将其用于生物体受照剂量估算是可行的[4-7],但缺乏人类在体研究的支持。考虑到辐射事故偶发及全身辐射伤员病例稀少,本研究以需行全身照射(TBI)预处理的造血干细胞移植患者作为替代辐射伤员的在体辐射模型,利用气相色谱-质谱联用技术(GC-MS),筛选出与辐射损伤密切相关的血浆差异代谢物,为进一步筛选辐射损伤标志物,阐明辐射损伤机制以及评估辐射防护药物提供实验依据。
资料与方法1. 样本收集:40例患者均为苏州大学附属第一人民医院血液科2012年1月至2014年5月期间行造血干细胞移植前需行TBI预处理住院患者,年龄10~51岁,平均年龄30.5岁,男27例,女13例。其中,B淋巴母细胞淋巴瘤1例,NK-急性白血病1例,恶性T细胞性淋巴瘤1例,非霍奇金淋巴瘤1例,骨髓增生异常综合征转急性粒细胞白血病1例,急性粒细胞白血病13例,急性淋巴细胞白血病14例,急性杂合性白血病1例,结外NK/T淋巴瘤1例,淋巴瘤白血病2例,慢性粒细胞白血病2例,弥漫大B细胞淋巴瘤2例。收集患者TBI前1 d血浆和照射后1 d血浆样本共80份并冻存于-80℃冰箱。所有患者于缓解期接受TBI辅助治疗,TBI方案:分次全身照射(FTBI)方案,总剂量12 Gy,分3 d照射,每天照射2次,两次照射间隔至少6 h,肺部剂量8 Gy,吸收剂量率4~8 cGy/min,全身剂量均匀度1.6%~9%。
2. 实验仪器与试剂:气相色谱-质谱联用仪(GC-MS,7890A-5975C)和DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm)购于美国Agilent公司,低温高速离心机购于德国Eppendorf公司,真空冷冻干燥机(Alpha1-4LSCplus RC6)购于美国ALFA公司。三甲基氯硅烷(TMCS)购于美国Fluka公司,N-甲基-N-三甲基硅烷基三氟乙酰胺(MSTFA)、 甲氧胺盐、 吡啶溶液和鉴定化合物用的标准品购于美国Sigma-Aldrich或Alaf Aeser公司。
3. 样本预处理:血浆样本室温解冻,取100 μl于EP管中,分别加入400 μl乙腈和100 μl内标溶液(2,4-二氯苯甲酸乙腈溶液,0.2 mg/ml)涡旋混匀后,超声冰浴15 min,13 000 r/min,离心半径8.37 cm,4℃离心15 min,取500 μl上清于新EP管,放入真空冷冻干燥机中充分冻干。向冻干物中加入50 μl甲氧胺吡啶溶液(15 mg/ml),涡旋混匀后加入50 μl MSTFA(含1% TMCS作催化剂)和50 μl正庚烷,混匀后于13 000 r/min,离心半径8.37 cm,4℃条件下离心15 min,取上清行GC-MS分析。
4. GC-MS分析:样本血浆代谢轮廓分析由GC-MS联用仪完成,衍生后的产物经DB-5MS毛细管柱分离。载气(氦气)线速度为36.966 cm/s,恒流流速为1.0 ml/min,进样体积为1 μl。程序升温条件:起始温度80℃,保持5 min,以 10℃/min升至170℃,再以5℃/min升至250℃,最后以10℃/min升至300℃,保持5 min,分流比为10∶1。质谱条件:进样口温度300℃,接口温度为280℃,离子源温度230℃,电离方式:电子电离(EI),电离能量:70 eV,扫描质量范围30~600核质比(m/z),溶剂切割时间5 min。
从收集照射前后的80份血浆样本中,每份取10 μl混合组成QC样本,以此来考察仪器的稳定性和方法的重现性。QC样本的预处理方法和数据采集条件均与实验样本相同。血浆样本行GC-MS分析时进样顺序完全随机,每8个实验样本后运行一个QC样本,用于监测GC-MS分析系统的稳定性。每运行6个样本后运行一个空白样本(二氯甲烷),以此冲洗色谱柱中残留的分析物。样本衍生后均于72 h内行GC-MS分析。所有样本数据采集完成后运行一针C8-C40的正构烷烃,用以计算保留指数。
5. 数据采集和处理:原始质谱数据经GC-MS分析系统采集后转化成AIA格式,分别导入AMDIS Aanlysis(NIST)和 ChromaTOF 4.43(美国LECO公司)软件进行质谱峰检测,去卷积,离子峰筛选和鉴定等处理。血浆特征差异代谢物的鉴定工作主要基于谱库(包括NIST 11、 Wiley、 Fiehn、 Replib和Main)及标样的保留时间和质谱图比对完成[8]。应用安捷伦数据分析软件建立包含保留时间(retention time,RT)和特征离子信息m/z的化合物表及定量积分方法,并对每个样本进行定量积分。根据QC样本零值80%规则删除缺失值,QC相对标准偏差(relative standard deviation,RSD)>30%剔除的原则删除检测不稳定离子峰[9]。最后经内标(2,4-二氯苯甲酸)归一化,生成以代谢物为行,样本数为列的二维数据矩阵。所获取数据采用MATLAB R2012a数据分析软件进行处理,应用非参数配对检验方法(Mann-Whitney U-test)筛选差异代谢物。P<0.05为差异有统计学意义。代谢通路分析在MetaboAnalyst(http://www.metaboanalyst.ca/)中完成。
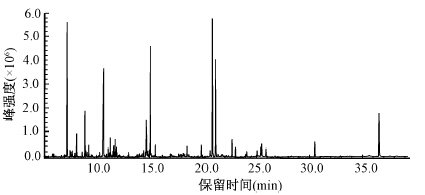
结果1. 血浆代谢轮廓分析性能的评价:图 1是样本总离子流图,由图可以看出代谢物分离性能良好。用QC样本中衍生代谢产物(178个)的相对含量归一化后RSD的分布考察血浆代谢轮廓分析方法和分析系统的稳定性。结果表明,分别有97.19%、 88.20%和73.60%的代谢物RSD分别在10%、 20%和30%以内,表明该分析系统和方法具有高度的稳定性,获得的样本差异信息能反映生物体真实的代谢变化。血浆经GC-MS分析后,得到的典型总离子流图如图 1所示,这些代谢物主要包括有机小分子酸类、 脂肪酸类、 氨基酸类和固醇类等几类物质。
|
|
表 1 TBI后血浆中差异代谢物的相对变化(x±s) Table 1 Relative levels of different metabolites in plasma after TBI(x±s) |
|
图 1 GC-MS中典型的血浆样本总离子流图 Figure 1 Typical total ion current chromatograms of the plasma samples in GC-MS |
2. 辐射损伤差异代谢物和相关代谢通路:从40例患者配对样品的178个离子峰中筛选出37个差异离子峰,根据上述定性方法鉴定出22个差异代谢物(表 1)。非参数配对检验结果表明,电离辐射后血浆中葡萄糖、 肉豆蔻酸、 草酸、 3-羟基丁酸、 尿素、 天冬氨酸、 缬氨酸、 亮氨酸、 赖氨酸和苏氨酸含量显著增加,胆固醇、 丙酮酸、 丙酸、 乳酸、 丙氨酸、 甘氨酸、 肌醇、 山梨糖酐、 乙二醇和次黄嘌呤含量显著降低。
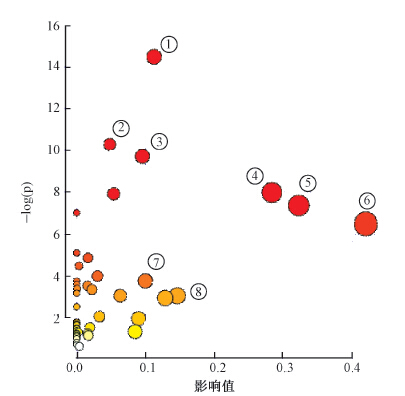
将筛选出的差异代谢物在MetaboAnalyst中做通路分析(图 2),图中横坐标表示代谢通路的重要性,纵坐标表示代谢通路富集分析的显著性水平,代谢通路越靠近右上方说明通路可信性越高。结果显示,辐射损伤主要涉及如图 2标注的代谢通路。
|
图 2 基于放射损伤血浆差异代谢物的代谢通路分析 注:1.氨酰转运RNA生物合成;2.缬氨酸、 亮氨酸和异亮氨酸的生物合成;3.糖酵解和糖异生;4.甘氨酸、 丝氨酸和苏氨酸代谢;5.丙氨酸、 天冬氨酸和谷氨酸代谢;6.丙酮酸代谢;7.赖氨酸生物合成;8.赖氨酸降解 Figure 2 Pathway analysis based on the differential metabolites in plasma after TBI |
讨论
辐射可直接或间接通过继发反应对人体组织和细胞造成损伤,主要影响机体正常代谢活动和导致基因突变,进而引发一系列与之相关的氧化应激反应和诱导与蛋白质代谢相关的机体功能紊乱[10-12]。为了筛选与辐射损伤相关的特征血浆代谢物,本研究以需行TBI预处理的造血干细胞移植患者作为替代辐射损伤的在体辐射模型,利用GC-MS联用技术研究电离辐射对血浆代谢物的影响。
与TBI前相比,TBI后机体血浆中多种氨基酸发生显著性变化,涉及到多种相关的氨基酸代谢通路。已有文献报道,缬氨酸的碳骨架可以生成三羧酸循环的中间产物琥珀酰辅酶A以及与三羧酸循环相关的代谢产物如乳酸,进而影响TCA循环[13]。缬氨酸含量的增加可能反映辐射诱导缬氨酸富集的蛋白质分解和一些相关酶灭活,而亮氨酸含量的增加可能与其保护机体免受氧化应激反应所致伤害的功能相关[14]。此外,缬氨酸和亮氨酸共同参与以缬氨酸、 亮氨酸和异亮氨酸代谢为主的体内支链氨基酸代谢。已有研究表明,辐射可引起肌肉分解代谢活动增加,骨骼肌内的支链氨基酸(缬氨酸、 亮氨酸和异亮氨酸)可由肌肉释放进入血液[15]。与支链氨基酸增加不同,TBI后血浆中甘氨酸含量显著降低,以次黄嘌呤和胆固醇为主的甘氨酸代谢产物也呈显著下降趋势,这与文献报道的辐射可引起机体血浆中次黄嘌呤含量显著降低的结果一致[16]。此外,多种氨基酸可通过参与氨酰转运RNA生物合成过程调节蛋白质合成[17]。因此,血浆中游离氨基酸水平在一定程度上反映了电离辐射引起的蛋白质生物合成和分解变化。
无论是在体外细胞实验还是在在体大鼠动物模型中,电离辐射均可导致尿素循环中间产物精氨酸、 鸟氨酸和瓜氨酸出现不同程度的下降[18-19],提示辐射暴露可引起尿素循环障碍。尿素循环是人体中已知的尿素生物合成的唯一途径,肝脏是其完成主要部位,因而尿素循环显示了陆栖脊椎动物的肝脏功能水平。作为尿素循环的参与者,TBI后患者血浆尿素和天冬氨酸的显著增加可能与电离辐射引起的肝功能受损有关。
丙氨酸、 丙酮酸、 乙酸和乳酸这些代谢物主要参与了葡萄糖-丙氨酸循环和葡萄糖-乳酸循环以及丙酮酸代谢过程。丙氨酸可通过转氨作用形成单糖,再进一步生成丙酮酸转运至肝脏进入三羧酸循环,其碳骨架可再次转换为葡萄糖[20]。葡萄糖转化成丙氨酸或乳酸的过程受到抑制,或乳酸和丙氨酸生成葡萄糖的能力增强,均可使葡萄糖含量升高,丙氨酸和乳酸及其代谢相关产物乙酸含量降低。此外,血浆葡萄糖升高可能与电离辐射引起的肝血红素催化和葡萄糖储存降解有关[21]。
综上所述,电离辐射可导致人血浆中多种代谢物发生显著性变化,其涉及的代谢通路包括氨基酸代谢、 尿素循环、 糖代谢等。目前,辐射损伤标志物的研究多集中在鼠科和灵长类动物模型,而缺乏人类在体研究的支持。本研究以需行TBI预处理的造血干细胞移植患者作为辐射损伤模型,通过代谢物水平的变化寻找与辐射损伤密切相关的血浆差异代谢物并初步探索了相关代谢通路。该研究结果对于在体筛选灵敏、 稳定、 可靠的电离辐射损伤标志物及其代谢水平变化,阐明人体电离辐射损伤机制和修复的分子机制提供了实验依据。此外,由于代谢物种类繁多,生物、 化学和物理性质差别比较大,单独一种检测方法很难对千差万别的代谢物较全面的测定,下一步将利用液相色谱-质谱联用技术(LC-MS)扩大代谢物的研究范围,以期找到更多灵敏和特异性的潜在辐射损伤标志物,为建立电离辐射早期损伤的生物剂量估算新方法和发展快速、 准确的新型生物剂量计算提供实验依据和理论指导。
利益冲突 本研究还接受苏州市科技发展计划项目(SYS201316)资助,本人及本人家属、 其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 赵明晓负责实验设计、 实验运行、 数据处理和论文撰写;鲍协炳、 陈怀远提供临床样本收集及技术支持;吴小津、 王畅负责论文思路指导及修改
| [1] | Nicholson JK, Lindon JC. Systems biology:Metabonomics[J]. Nature , 2008, 455 (7216) : 1054-1056 DOI:10.1038/4551054a |
| [2] | Shajahan-Haq AN, Cheema MS, Clarke R. Application of metabolomics in drug resistant breast cancer research[J]. Metabolites , 2015, 5 (1) : 100-118 DOI:10.3390/metabo5010100 |
| [3] | Zeng J, Yin P, Tan Y, et al. Metabolomics study of hepatocellular carcinoma:discovery and validation of serum potential biomarkers by using capillary electrophoresis-mass spectrometry[J]. J Proteome Res , 2014, 13 (7) : 3420-3431 DOI:10.1021/pr500390y |
| [4] | De Stefano I, Giardullo P, Tanno B, et al. Nonlinear radiation-induced cataract using the radiosensitive ptch1(+/-) mouse model[J]. Radiat Res , 2016, 186 (3) : 315-321 DOI:10.1667/RR14440.1 |
| [5] | Ryu SH, Park JH, Jeong ES, et al. Establishment of a mouse model of 70% lethal dose by total-body irradiation[J]. Lab Anim Res , 2016, 32 (2) : 116-121 DOI:10.5625/lar.2016.32.2.116 |
| [6] | Chen Z, Coy SL, Pannkuk EL, et al. Rapid and high-throughput detection and quantitation of radiation biomarkers in human and nonhuman primates by differential mobility spectrometry-mass spectrometry[J]. J Am Soc Mass Spectrom , 2016, 27 (10) : 1626-1636 DOI:10.1007/s13361-016-1438-5 |
| [7] | Lanz C, Patterson AD, Slavík J, et al. Radiation metabolomics.3.Biomarker discovery in the urine of gamma-irradiated rats using a simplified metabolomics protocol of gas chromatography-mass spectrometry combined with random forests machine learning algorithm[J]. Radiat Res , 2009, 172 (2) : 198-212 DOI:10.1667/RR1796.1 |
| [8] | Ye G, Zhu B, Yao Z, et al. Analysis of urinary metabolic signatures of early hepatocellular carcinoma recurrence after surgical removal using gas chromatography-mass spectrometry[J]. J Proteome Res , 2012, 11 (8) : 4361-4372 DOI:10.1021/pr300502v |
| [9] | Bijlsma S, Bobeldijk I, Verheij ER, et al. Large-scale human metabolomics studies:a strategy for data (pre-) processing and validation[J]. Anal Chem , 2006, 78 (2) : 567-574 DOI:10.1021/ac051495j |
| [10] | Han J, Won EJ, Lee BY, et al. Gamma rays induce DNA damage and oxidative stress associated with impaired growth and reproduction in the copepod Tigriopus japonicus[J]. Aquat Toxicol , 2014, 152 : 264-272 DOI:10.1016/j.aquatox.2014.04.005 |
| [11] | Whitehead K, Kish A, Pan M, et al. An integrated systems approach for understanding cellular responses to gamma radiation[J]. Mol Syst Biol , 2006, 2 : 47 DOI:10.1038/msb4100091 |
| [12] | Halaby MJ, Li Y, Harris BR, et al. Translational control protein 80 stimulates IRES-mediated translation of p53 mRNA in response to DNA damage[J]. Biomed Res Int , 2015, 2015 : 708158 DOI:10.1155/2015/708158 |
| [13] | Murín R, Mohammadi G, Leibfritz D, et al. Glial metabolism of valine[J]. Neurochem Res , 2009, 34 (7) : 1195-1203 DOI:10.1007/s11064-008-9895-2 |
| [14] | Stoppiglia LF, Nogueira TA, Leite AR, et al. Protective effect of D-glucose, L-leucine and fetal calf serum against oxidative stress in neonatal pancreatic islets[J]. Biochim Biophys Acta , 2002, 1588 (2) : 113-118 DOI:10.1016/S0925-4439(02)00154-0 |
| [15] | Holecek M, Skopec F, Sprongl L, et al. Effect of alanyl-glutamine on leucine and protein metabolism in irradiated rats[J]. Amino Acids , 2002, 22 (1) : 95-108 DOI:10.1007/s726-002-8203-0 |
| [16] | Pannkuk EL, Laiakis EC, Mak TD, et al. A lipidomic and metabolomic serum signature from nonhuman primates exposed to ionizing radiation[J]. Metabolomics , 2016, 12 (5) : 1-11 DOI:10.1007/s11306-016-1010-0 |
| [17] | Ibba M, S ll D. Aminoacyl-tRNA synthesis[J]. Annu Rev Biochem , 2000, 69 : 617-650 DOI:10.1146/annurev.biochem.69.1.617 |
| [18] | Zhang Y, Zhou X, Li C, et al. Assessment of early triage for acute radiation injury in rat model based on urinary amino acid target analysis[J]. Mol Biosyst , 2014, 10 (6) : 1441-1449 DOI:10.1039/c3mb70526a |
| [19] | van Rijn J, van den Berg J, Teerlink T, et al. Changes in the ornithine cycle following ionising radiation cause a cytotoxic conditioning of the culture medium of H35 hepatoma cells[J]. Br J Cancer , 2003, 88 (3) : 447-454 DOI:10.1038/sj.bjc.6600700 |
| [20] | Wang LF, Hu XJ, Peng RY, et al. Application of 1H-NMR-based metabolomics for detecting injury induced by long-term microwave exposure in Wistar rats' urine[J]. Anal Bioanal Chem , 2012, 404 (1) : 69-78 DOI:10.1007/s00216-012-6115-3 |
| [21] | Barshishat-Kupper M, Tipton AJ, McCart EA, et al. Effect of ionizing radiation on liver protein oxidation and metabolic function in C57BL/6J mice[J]. Int J Radiat Biol , 2014, 90 (12) : 1169-1178 DOI:10.3109/09553002.2014.930536 |
 2017, Vol. 37
2017, Vol. 37


