放射性脑坏死是颅内肿瘤立体定向放疗后的常见并发症[1],且长期没有明显有效的治疗手段。发生放射性脑坏死的中位时间为射波刀放疗结束后14个月(5~24个月)[2]。血管机制是造成放射性脑坏死的重要机制之一。由于放射线作用于血管,导致血管内皮细胞纤维素样改变,引起组织缺氧进而坏死,在这个过程中释放大量作用于血管的细胞因子,如血管内皮生长因子(VEGF),这些因子逐渐导致血脑屏障功能障碍及脑水肿,进而影响相应的神经功能[3-5]。此外,射线可引起星型细胞损伤,使VEGF进一步释放,导致血脑屏障损伤及脑水肿进一步加重[6],而贝伐单抗作为抗新生血管形成的重要药物[7-8],为其在放射性脑坏死治疗中的应用提供了空间。本研究总结了天津肿瘤医院放疗科采用贝伐单抗治疗立体定向放疗后放射性脑坏死患者的初步疗效,为放射性脑坏死治疗提供参考。
资料与方法1. 临床资料:2011年6月至2013年2月,天津市肿瘤医院射波刀中心治疗颅内转移瘤后发生放射性脑坏死患者14例,接受贝伐单抗治疗。其中,男性6例,女性8例。年龄31~70岁,中位年龄53岁。其中,肺癌脑转移11例,乳腺癌、胃癌、淋巴瘤颅内转移各1例。4例患者既往接受过全脑放疗。立体定向放疗,50%~82%剂量线(中位75%),给予1 400~4 000 cGy剂量(中位2 600 cGy),等效生物剂量5 980~9 880 cGy(中位7 590 cGy),1~5次分割(中位2次)完成。贝伐单抗治疗3~10周期,中位治疗3周期。
2. 脑坏死临床诊断标准:影像学手段是临床工作中最常应用的放射性脑坏死诊断方法[9-10]。大多数脑坏死在MRI的T1加权像(T1WI)中呈不规则形状低信号,T2加权像(T2WI)中呈不规则形状高信号。脑液化性坏死在T1WI中表现为低信号强度,而T2WI中表现为高信号强度。病变中心在加入造影剂强化后显示不规则强化结节。病灶周围在T1信号和T2信号中呈大面积水肿带,无强化。在磁共振波谱分析(MRS)中,放射性脑坏死病灶胆碱(Cho)、肌酸(Cr)、N-乙酸门冬氨酸(NAA)的含量降低,并且NAA/Cho、NAA/Cr的比值也显著下降。在PET中,放射性脑坏死部位比正常脑组织的代谢率降低;相应的病变区域,葡萄糖的摄取率降低[11-13]。
3.贝伐单抗治疗:影像学上诊断为脑坏死的患者,立即采用贝伐单抗5 mg/kg体重剂量[14-15],每3周应用1次。用药前采用苯海拉明及激素等抗过敏处理。首次用药,贝伐单抗用药时间超过90 min,以后每次用药超过60 min。用药期间心电监护,密切观察患者用药反应。
4.治疗前后评价标准:患者贝伐单抗治疗3个周期后1个月需常规行颅内MRI检查,而后1年内每2~3个月复查1次,而后根据患者实际情况进行复查,但最长不超过6个月,如有颅内症状,需即刻复查。贝伐单抗治疗后患者症状变化,按照国际通用不良反应术语标准4.0版(CTC 4.0)来评价。CTC 4.0采用 5 级评分系统对不良反应的严重度进行评价,并对每一种不良反应的严重度从1~5级进行了特定的临床描述。1级不良反应是指较轻微的不良反应,通常无症状,且不需要对机体进行干预治疗,也不需要进行介入或药物治疗;2级不良反应是指中等程度的不良反应,通常有临床症状,且需要在当地进行药物或其他方面的干预治疗,这类反应可能影响机体的功能,但是不损害日常生活与活动;3级不良反应是指较为严重的不良反应,可能造成不良后果,通常症状复杂,需要进行外科手术或住院治疗等积极的干预治疗;4级不良反应是指可能对生命构成潜在威胁的不良反应,这类反应往往可致残,甚至导致器官损害或器官功能的丧失;5级不良反应是指死亡。射波刀治疗后发生放射性脑坏死的评价见图 1。水肿范围在快速自旋回波序列(FRFSE)-T2WI相测量,体积计算采用在核磁图像勾画的水肿区面积乘以层厚的方法计算。采用水肿指数(EI)进行评价,EI为贝伐单抗使用前后肿瘤水肿的体积比值。EI=1为无水肿,1<EI≤1.5为轻度水肿,1.5<EI≤3为中度水肿,EI>3 为重度水肿[16-17]。脑坏死体积为脑坏死内外边缘体积差值,ml。脑坏死区域信号比为计算3个脑坏死强化区域信号平均值,与MRI白质区域3个信号平均值相比得到。
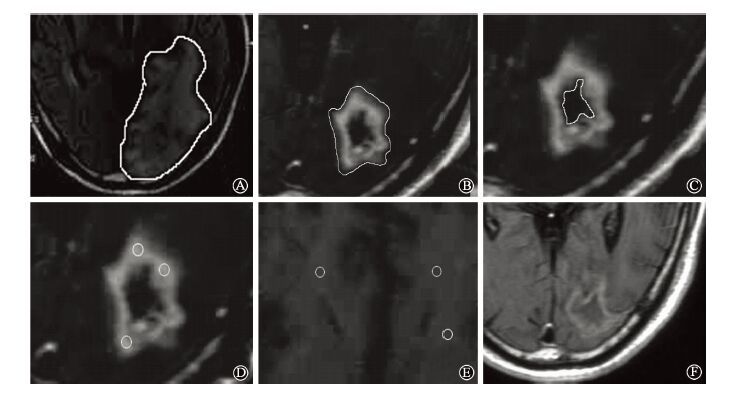
|
图 1 射波刀治疗后并发放射性脑坏死评价示意图 A. 核磁共振影像中脑坏死水肿的面积; B. 脑放射性坏死的外边缘; C. 脑放射性坏死的内边缘; D. 脑坏死区磁共振信号的测定; E. 在同一水平的脑白质区的磁共振成像信号的测定; F. 贝伐单抗治疗脑坏死后图像 Figure 1 The evaluation methods of radiation brain necrosis A. The area of the edema at one layer of the MRI image; B. The outer edge of radiation necrosis of the brain; C. The inner edge of radiation necrosis of the brain; D. Determination of MRI signal in brain necrosis area; E. Determination of MRI signal in cerebral white matter area at the same level; F. Image after bevacizumab on the treatment of brain radiation necrosis |
5.统计学处理:数据用x±s表示。采用SPSS 17.0软件,采用t检验分析贝伐单抗治疗前后症状变化、水肿指数、脑坏死体积及脑坏死区信号变化差异。P<0.05为差异有统计学意义。
结果1. 症状变化:14例患者中,12例患者治疗前有颅内压升高引起的头痛、头晕、恶心、呕吐及记忆力减退、视野缺损等症状。经过贝伐单抗处理后,10例患者症状分级较前降低(t=5.657,P<0.01);其余4例患者治疗前后差异无统计学意义(P>0.05)。
2.不良反应:贝伐单抗治疗后,1例发生轻度过敏,对症处理后好转。1例出现1级血压升高,然后自行缓解。1例发生1级咳血。未见2级以上不良反应。未见皮疹、乏力、蛋白尿、血栓栓塞、出血、胃肠道穿孔,未见伤口愈合延迟、可逆性后脑白质病综合征及充血性心力衰竭等不良反应。
3.脑水肿程度变化:根据患者水肿程度计算水肿指数,并比较治疗前后水肿变化。结果显示,所有患者治疗前后水肿指数分别是7.05±6.48和3.59±4.74,结果差异具有统计学意义(t=3.946,P<0.01),其中9例患者水肿指数等级较前改善明显。
4.脑坏死体积变化:经贝伐单抗治疗后,所有患者治疗前后脑坏死体积分别为(55.96±32.91)和(26.99±31.40)ml,结果差异具有统计学意义(t=3.952,P<0.01),其中13例患者脑坏死体积较前明显减小。
5. 脑坏死MRI信号变化:通过对颅内强化核磁T1相信号相对强度测量,测定脑坏死病灶贝伐单抗治疗前后血供变化。所有患者MRI信号比值治疗前后分别为2.70±4.78和1.82±0.53,结果差异有统计学意义(t=4.507,P<0.01),其中12例患者较前明显减轻。
讨论贝伐单抗治疗放射性脑坏死的机制,要从放射性脑坏死的发生机制及贝伐单抗抑制新生血管的机理两方面展开讨论。血管损伤机制在放射性脑坏死发展过程中起主要作用。由于射线作用于血管,导致血管内皮细胞纤维素样改变,引起组织缺氧进而坏死,在这个过程中释放大量作用于血管的细胞因子,如VEGF,这些因子逐渐导致血脑屏障功能障碍及脑水肿,进而影响相应的神经功能[18-19]。此外,射线可引起星型细胞损伤,使VEGF进一步释放,导致血脑屏障损伤及脑水肿进一步加重。由此看来,应用贝伐单抗阻断VEGF释放到目标毛细血管,并通过降低血管通透性,减少血浆及血浆流动所携带炎性因子通过毛细血管内皮细胞到达细胞外区域,减轻血脑屏障损伤以及脑组织水肿,可能会成为防治放射性脑坏死的一种较为合理的方案。在放射性脑坏死动物实验模型中已证实存在VEGF高水平表达,这也进一步证明了该机制的存在。可见,放射性脑坏死的机制及贝伐单抗通过其抗血管作用,使其可以对放射性脑坏死发挥治疗效果,而此研究结果亦印证了这一机制[20]。本研究结果显示贝伐单抗治疗放射性脑坏死安全、有效。
放射性脑坏死是放射治疗颅内肿瘤的常见并发症,但长期以来,一直采用激素等对症处理,或者高压氧等治疗手段,疗效不尽如人意。手术切除又受到脑坏死发生部位等影响,且对患者创伤较大。贝伐单抗治疗放射性脑坏死研究为临床实践提供了行之有效的新的治疗手段探索,是治疗放射性脑坏死的新思路。
总之,本研究通过探讨贝伐单抗治疗立体定向放疗后放射性脑坏死初步疗效,为放射性脑坏死的治疗提供了新的思路。尽管此研究病例数较少,临床观察较为初步,但毕竟为立体定向放疗颅内肿瘤放射性脑坏死并发症处理提供了新的方法,有益于当前立体定向放射治疗颅内肿瘤的临床实践。相信随着临床资料的进一步积累和临床经验的进一步总结,贝伐单抗治疗放射性脑坏死将会迎来更广阔的临床应用前景。
利益冲突 本研究接受天津医科大学肿瘤医院临床研究提升计划项目资助,进行“贝伐单抗治疗放射性脑坏死的疗效分析”相关研究,本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 王境生负责设计研究方案,收集数据后统计并起草论文;庄洪卿指导、监督试验进行,修改论文;李丰彤、董洋、陈华明协助提供符合入组病例;宋勇春、王晓光、袁智勇负责进行试验,对图像结果进行分析
| [1] | Du Four S, Hong A, Chan M, et al. Symptomatic histologically proven necrosis of brain following stereotactic radiation and ipilimumab in six lesions in four melanoma patients[J]. Case Rep Oncol Med , 2014 : 417913 DOI:10.1155/2014/417913 |
| [2] | Kickingereder P, Dorn F, Blau T, et al. Differentiation of local tumor recurrence from radiation-induced changes after stereotactic radiosurgery for treatment of brain metastasis:case report and review of the literature[J]. Radiat Oncol , 2013, 8 : 52 DOI:10.1186/1748-717X-8-52 |
| [3] | Reddy K, Westerly D, Chen C. MRI patterns of T1 enhancing radiation necrosis versus tumour recurrence in high-grade gliomas[J]. J Med Imaging Radiat Oncol , 2013, 57 (3) : 349-355 DOI:10.1111/j.1754-9485.2012.02472.x |
| [4] | Ozsunar Y, Mullins ME, Kwong K, et al. Glioma recurrence versus radiation necrosis? A pilot comparison of arterial spin-labeled, dynamic susceptibility contrast enhanced MRI, and FDG-PET imaging[J]. Acad Radiol , 2010, 17 (3) : 282-290 DOI:10.1016/j.acra.2009.10.024 |
| [5] | Jiang X, Ding M, Qiao Y, et al. Recombinant human endostatin combined with radiotherapy in the treatment of brain metastases of non-small cell lung cancer[J]. Clin Transl Oncol , 2014, 16 (7) : 630-636 DOI:10.1007/s12094-013-1129-7 |
| [6] | Rinne ML, Lee EQ, Wen PY. Central nervous system complications of cancer therapy[J]. J Support Oncol , 2012, 10 (4) : 133-141 DOI:10.1016/j.suponc.2011.11.002 |
| [7] | Schüttrumpf LH, Niyazi M, Nachbichler SB, et al. Prognostic factors for survival and radiation necrosis after stereotactic radiosurgery alone or in combination with whole brain radiation therapy for 1-3 cerebral metastases[J]. Radiat Oncol , 2014, 9 : 105 DOI:10.1186/1748-717X-9-105 |
| [8] | Lubelski D, Abdullah KG, Weil RJ, et al. Bevacizumab for radiation necrosis following treatment of high grade glioma:a systematic review of the literature[J]. J Neurooncol , 2013, 115 (3) : 317-322 DOI:10.1007/s11060-013-1233-0 |
| [9] | Matuschek C, B lke E, Nawatny J, et al. Bevacizumab as a treatment option for radiation-induced cerebral necrosis[J]. Strahlenther Onkol , 2011, 187 (2) : 135-139 DOI:10.1007/s00066-010-2184-4 |
| [10] | Wang Y, Wang E, Pan L, et al. A new strategy of cyberknife treatment system based radiosurgery followed by early use of adjuvant bevacizumab treatment for brain metastasis with extensive cerebral edema[J]. J Neurooncol , 2014, 119 (2) : 369-376 DOI:10.1007/s11060-014-1488-0 |
| [11] | 郭艺航, 庄洪卿, 袁智勇, 等. 射波刀治疗后放射性脑坏死影响因素及其预测因子研究[J]. 中华放射肿瘤学杂志 , 2015, 24 (3) : 295-299 Guo YH, Zhuang HQ, Yuan ZY, et al. A study of influencing factors and predictors for radiation encephalic necrosis after cyberknife radiotherapy[J]. Chin J Radiat Oncol , 2015, 24 (3) : 295-299 DOI:10.3760/cma.j.issn.1004-4221.2015.03.016 |
| [12] | Parvez K, Parvez A, Zadeh G. The diagnosis and treatment of pseudoprogression, radiation necrosis and brain tumor recurrence[J]. Int J Mol Sci , 2014, 15 (7) : 11832-11846 DOI:10.3390/ijms150711832 |
| [13] | Pallavi T, Prateek P, Lisa R, et al. Texture descriptors to distinguish radiation necrosis from recurrent brain tumors on multi-parametric MRI[J]. Proc Spie Int Soc Opt Eng , 2014, 9035 : 90352B DOI:10.1117/12.2043969 |
| [14] | Shah R, Vattoth S, Jacob R, et al. Radiation necrosis in the brain:imaging features and differentiation from tumor recurrence[J]. Radiographics , 2012, 32 (5) : 1343-1359 DOI:10.1148/rg.325125002 |
| [15] | Stockham AL, Ahluwalia M, Reddy CA, et al. Results of a questionnaire regarding practice patterns for the diagnosis and treatment of intracranial radiation necrosis after SRS[J]. J Neurooncol , 2013, 115 (3) : 469-475 DOI:10.1007/s11060-013-1248-6 |
| [16] | Chernov MF, Hayashi M, Izawa M, et al. Multivoxel proton MRS for differentiation of radiation-induced necrosis and tumor recurrence after γ knife radiosurgery for brain metastases[J]. Brain Tumor Pathol , 2006, 23 (1) : 19-27 DOI:10.1007/s10014-006-0194-9 |
| [17] | Kang TW, Kim ST, Byun HS, et al. Morphological and functional MRI, MRS, perfusion and diffusion changes after radiosurgery of brain metastasis[J]. Eur J Radiol , 2009, 72 (3) : 370-380 DOI:10.1016/j.ejrad.2008.08.009 |
| [18] | Gonzalez J, Kumar AJ, Conrad CA, et al. Effect of bevacizumab on radiation necrosis of the brain[J]. Int J Radiat Oncol Biol Phys , 2007, 67 (2) : 323-326 DOI:10.1016/j.ijrobp.2009.12.061 |
| [19] | Kuffler DP. Hyperbaric oxygen therapy:can it prevent irradiation-induced necrosis?[J]. Exp Neurol , 2012, 235 (2) : 517-527 DOI:10.1016/j.expneurol.2012.03.011 |
| [20] | Rahmathulla G, Marko NF, Weil RJ. Cerebral radiation necrosis:a review of the pathobiology, diagnosis and management considerations[J]. J Clin Neurosci , 2013, 20 (4) : 485-502 DOI:10.1016/j.jocn.2012.09.011 |
 2016, Vol. 36
2016, Vol. 36


