随着航天事业的迅速发展,空间辐射尤其是重离子的生物效应已成为国际学者研究的热点,而且已经逐步深入到分子水平。目前,我国空间辐射生物学的研究还很薄弱,关于空间辐射对人体生命活动影响的研究已经迫在眉睫。电离辐射能够激活或抑制细胞的基因表达,而基因表达的产物存在贮存、转运、翻译调控及翻译后加工等过程,难以准确反映蛋白质的质与量。因此,要了解基因的全部信息,就必须深入研究不同基因所编码的蛋白质[1 - 2]。通过分析不同剂量受照细胞的蛋白质种类和数量,可快速找到与辐射效应相关的蛋白质。本研究主要利用同位素标记的相对和绝对定量(iTRAQ)技术,分析12C6+重离子束照射人淋巴细胞后蛋白质组的改变,筛选出差异表达蛋白质,为探讨重离子照射的损伤机制,寻找健康监护的早期预警指标提供技术支持。
材料与方法1. 细胞系:Peng-EBV人淋巴细胞系购于中国科学院典型培养物保藏中心昆明细胞库。
2. 辐射条件:12C6+离子束(中国科学院近代物理研究所重离子研究装置辐照终端引出),照射能量165 MeV/Nu,剂量率0.3~0.5 Gy/min,照射剂量为0.1、0.5、2.0 Gy,选取未照射为对照组。
3. 主要仪器:Q-Exactive质谱仪(美国Thermo公司);AKTA Purifier 100纯化仪(美国GE Healthcare公司);低温高速离心机(德国Eppendor公司);可见紫外分光光度计WFZ UV-2100[尤尼柯(上海)仪器有限公司];真空离心浓缩仪(德国Eppendor公司);600 V电泳仪(美国GE Healthcare公司)。
4. 细胞培养与照射:Peng-EBV人淋巴细胞使用含有体积分数为20%的胎牛血清(天津灏洋生物制品有限公司)、0.1 U/L青链霉素混合液的RPMI 1640培养液(美国GIBCO公司),于体积分数为5%CO2培养箱中37℃培养。细胞悬浮生长,倍增时间约为24 h。取生长状态良好、对数生长期的细胞在中国科学院近代物理研究所重离子研究装置(HIRFL)辐照终端进行12C6+离子束照射。将培养瓶垂直置于照射坪区接受12C6+离子束照射,受照后混匀受照细胞,置入37℃、体积分数为5%CO2培养箱继续培养24 h。
5. 样品制备:各剂量组及对照组中每2×106细胞分别加入1 ml裂解液,充分混匀,-80℃反复冻融3次以充分裂解细胞,加入50 μg/ml核糖核酸酶A(美国Bio-rad公司),200 μg/ml脱氧核糖核酸酶I(美国Bio-rad公司),4℃放置15 min。40 000×g,4℃离心30 min。收集上清后进行蛋白质定量及电泳分析。电泳条件:恒电流14 mA,电泳时间90 min,考马斯亮蓝染色。
6. 酶解和肽段定量:各取适量样品,加入200μl缓冲液混匀,14 000×g离心30 min,重复2次,弃滤液。加入100μl吲哚乙酸(美国Bio-rad公司),600 r/min振荡1 min,室温避光放置30 min,14 000×g离心20 min。加入100 μl缓冲液,14 000×[JP]g离心20 min,重复2次。加入100μl 溶解缓冲液,14 000×g离心20 min,重复2次。加入40 μl 胰蛋白酶缓冲液,600 r/min振荡1 min,37℃孵育16~18 h,14 000×g离心10 min,取滤液进行光密度(OD280)肽段定量。
7. iTRAQ标记:取适量各组样品肽段,按照美国AB公司iTRAQ试剂盒反应说明书将对照组、0.1、0.5和2.0 Gy照射组加入相对分子质量分别为114、115、116和117的报告基团进行标记。
8. 强阳离子交换色谱(SCX)分级与质谱分析:将标记后的所有肽段混合,进行SCX分离,梯度洗脱。收集洗脱液约30份,根据SCX色谱图合并成6份并冻干,冻干后C18硅胶注脱盐。脱盐后的样品采用毛细管高效液相系统进行分离,再通过与色谱仪耦联的质谱仪进行质谱分析,扫描的质荷比范围为300~1 800 m/z。
9. 数据分析:分别采用英国希而科公司的Mascot 2.2软件和美国Thermo公司的Proteome Discoverer 1.4软件,进行蛋白质数据库搜索鉴定和肽段报告离子峰强度值定量分析。肽段定量结果以对照组标记标签为比较标准(内参),对其余3组进行比较,各组蛋白质的iTRAQ比值均采取各通道标签与内参的比值。定量结果再以各标签比值中位数进行归一化处理,以消除实验中人为因素引入的上样量误差。组间表达差异>120%或<80%被认为该蛋白质表达存在差异。对鉴定到的差异蛋白质进行基因本体(GO)分析、基因组百科全书(KEGG)通路分析和相互作用网络分析。
结 果1. 不同剂量12C6+离子束照射淋巴细胞蛋白质质谱的鉴定及差异表达分析: 经质谱分析及数据库搜索鉴定,在4组样品中共鉴定到5 158种蛋白质,与对照组相比,0.1 Gy组差异蛋白有91种,其中,57种蛋白质上调,34种蛋白质下调;0.5 Gy组有191种差异蛋白质,其中,94种上调,97种下调;2.0 Gy组有68种差异蛋白质,其中,47种上调, 21 种下调;3 组共同表达差异的蛋白质共11 种,有7 种蛋白质表达上调,4 种蛋白质表达下调,见表 1.在共同差异表达蛋白质中,显着下调蛋白质有ADP核糖基化因子相互作用蛋白1(Arfaptin-1)和SZT2,0.1、0.5和2.0 Gy 的iTRAQ 比值分别为0.36、0.49、0.38和0.66、0.22、0.44;显着上调蛋白质有纤维蛋白原γ 链和纤维蛋白原β 链,iTRAQ 比值分别为1.51、1.98、1.34和1.40、1.83、1.33。
|
|
表 1 3个剂量共同差异表达蛋白 Table 1 The differentially co-expressed proteins in the groups of 3 different doses |
2. GO 分析:本研究进一步对鉴定到的5 158种蛋白质进行GO 分类注释,包括分子功能(MF)、细胞成分(CC)、参与的生物过程(BP).结果表明,几乎50%的蛋白质与蛋白质结合、催化活性有关,主要为细胞质蛋白、细胞核蛋白以及膜蛋白,重点参与代谢反应、生物调节、刺激反应等生物过程。其中,0.1 Gy 组的差异蛋白质主要涉及各种核苷酸的代谢、免疫反应、细胞内大分子的组装以及蛋白构型的折叠等。这些差异表达蛋白质主要位于细胞核与细胞膜等,具有各种水解酶、氧化还原酶和磷酸酶的活性,并参与构成细胞骨架。0.5 Gy组的差异表达蛋白质主要与B 细胞增殖以及B 细胞增殖的调控、丘脑与黑质的发育、血小板的激活、蛋白转运和蛋白折叠等有关,主要位于细胞质以及各种细胞器,参与的分子功能分类为:蛋白质结合、甲基转移酶、水解酶、细胞周期素依赖的蛋白激酶等。而2.0 Gy 组的差异表达蛋白质主要涉及离子辐射的反应、急性反应、内吞作用、凋亡通路的调节以及脂类、肽类代谢等,主要位于细胞核、细胞质以及血液微粒子中。功能分类为:氧化还原酶、细胞周期依赖的激酶、肌糖激酶等。
3. KEGG 通路分析:不同剂量部分富集显着通路结果列于表 2.KEGG 分析是基因组破译方面的数据库,本研究主要针对通路(pathway)进行了分析。结果表明,0.1 Gy 组有19 个蛋白质通过KEGG ID 映射到32 条KEGG 通路图,位于第1 位的是剪接体通路;0.5 Gy 组有35 个蛋白质通过KEGG ID映射到108 条KEGG 通路图,主要是与各种疾病相关的通路,包括感染性通路以及与癌症相关的通路;2.0 Gy 组有11 个蛋白质通过KEGG ID 映射到39 条KEGG 通路图,主要参与信号转导、细胞周期以及癌症相关的通路。3 个剂量组共同差异表达蛋白质与系统性红斑狼疮、胆汁分泌以及酒精成瘾通路有关。
|
|
表 2 不同剂量部分富集显著KEGG通路分析 Table 2 Part of enrichment pathways in the KEGG maps of different groups |
4. 相互作用网络分析:利用STRING 软件分别对3 个剂量组差异表达蛋白质进行相互作用网络分析,如图 1~3 所示。网络图中方块是鉴定到的蛋白质,不同颜色分别代表转录因子、酶类、受体、适配器、核苷酸转化因子等类型的蛋白质,并且每个蛋白质之间都存在相互作用关系。其中,0.1 Gy 组热休克蛋白1B(HSPA1B)是蛋白质相互作用网络的关键性节点,0.5 与2.0 Gy 组中,纤维黏连蛋白-1(FN1)蛋白是蛋白质相互作用网络的关键性节点,这几个蛋白质均直接或间接地与其他差异蛋白质存在相互作用,构成相互作用网络的中心。
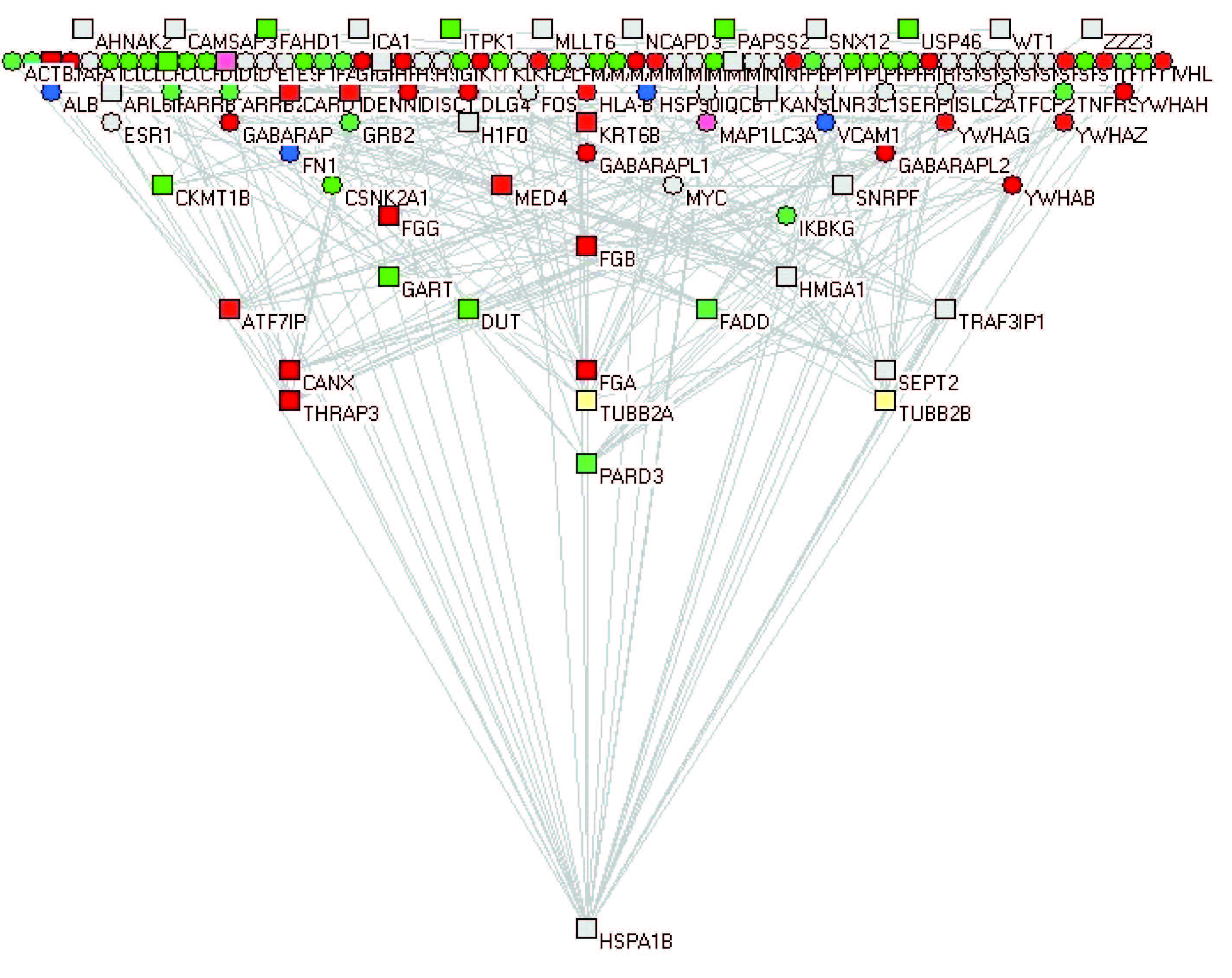
|
图 1 0.1 Gy 差异蛋白质的相互作用网络图 □为显着差异蛋白质;○为能将鉴定到的蛋白联系起来的蛋白质 Figure 1 Network connectivity of differentially expressed proteins exposed to 0.1 Gy |
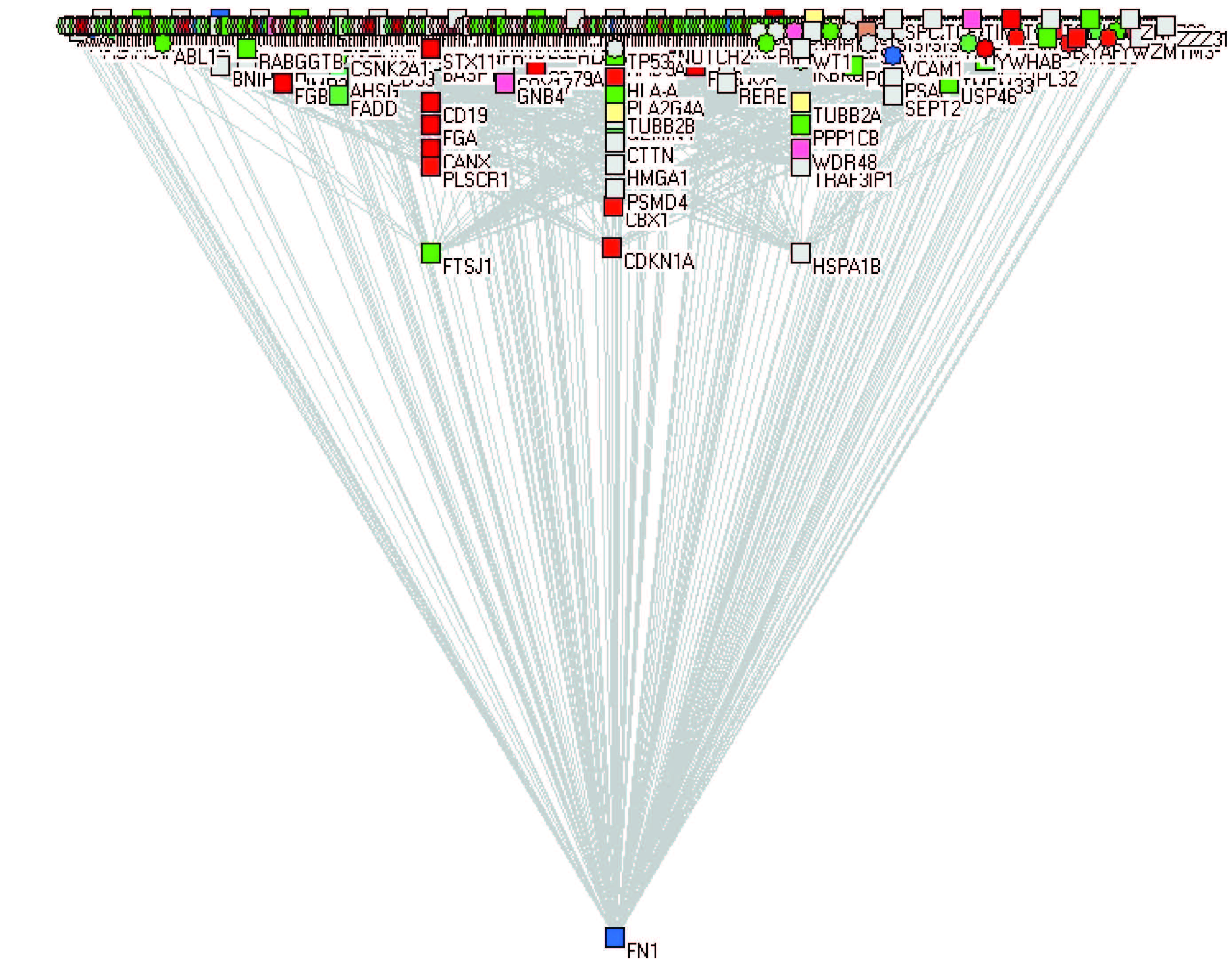
|
图 2 0.5 Gy 差异蛋白质的相互作用网络图 □为显着差异蛋白质;○为能将鉴定到的蛋白联系起来的蛋白质 Figure 2 Network connectivity of differentially expressed proteins exposed to 0.5 Gy |
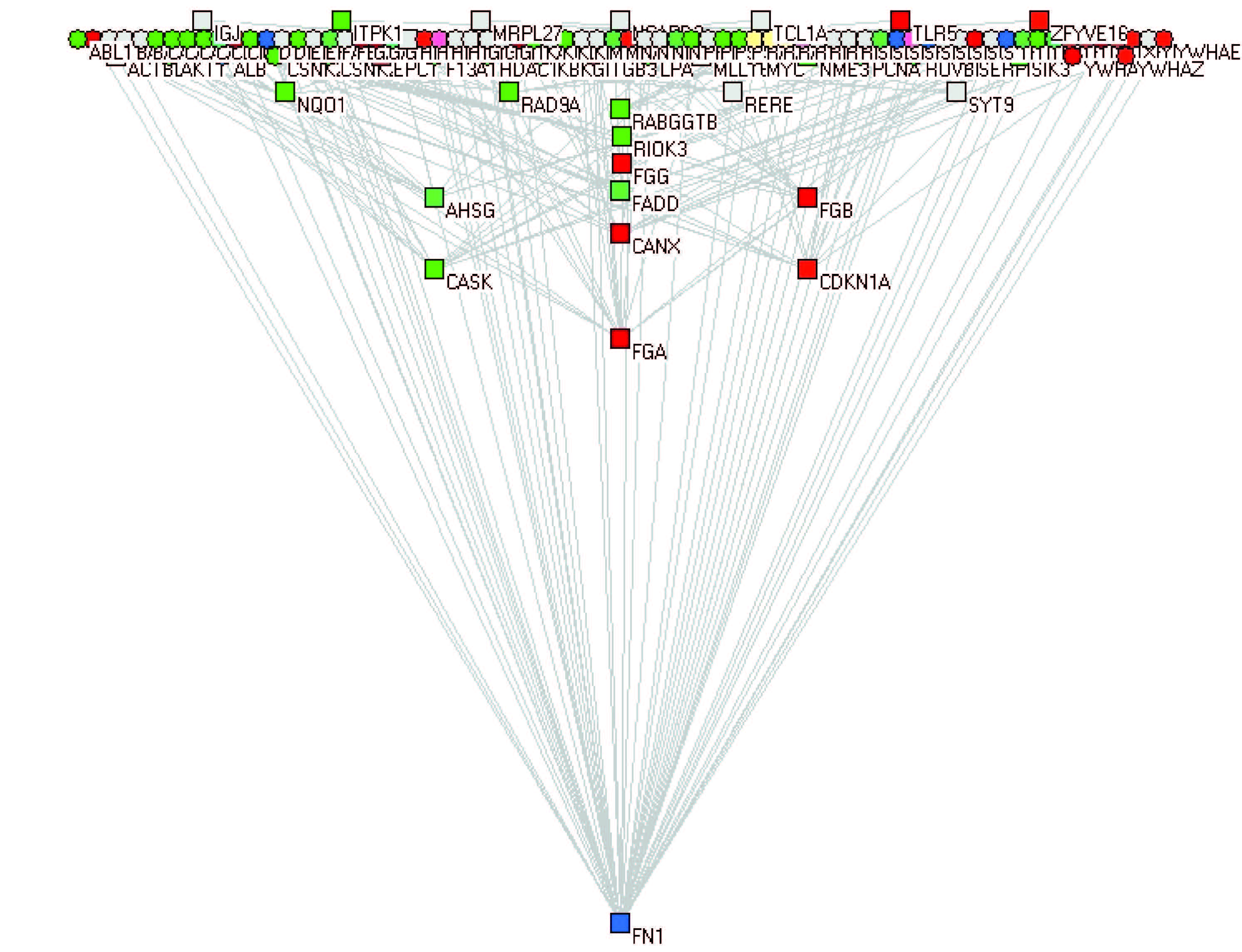
|
图 3 2.0 Gy 差异蛋白质相互作用网络图 □为显着差异蛋白质;○为能将鉴定到的蛋白联系起来的蛋白质 Figure 3 Network connectivity of differentially expressed proteins exposed to 2.0 Gy |
讨 论
蛋白质组学是后基因组时代出现的一门新兴科学,是在特定的时空上对选定的目标人群基因组表达的全部蛋白质进行研究的科学[1]。以细胞内全部蛋白质及其活动方式为主要研究对象,目的是对机体内所有的蛋白质进行鉴定,并对其结构和功能进行分析[2]。iTRAQ是近年来出现的一种先进定量蛋白质组学的研究方法,该技术采用4或8种同位素标签,特异性标记多肽的氨基基团,然后进行串联质谱分析。具有较高的重复性和较好的定量效果,可同时对4或8种不同样品蛋白质的相对或绝对含量进行比较,是寻找生物标记的一种理想技术,目前该技术已被广泛应用到药物作用靶点的研究和各种疾病标志物的筛选中[3]。
本研究以12C6+重离子束为辐射源,设定0.1、0.5及2.0 Gy 3个剂量组及对照组,利用8种同位素标记的iTRAQ技术鉴定到多种差异表达蛋白质,并对其进行生物信息学分析。实验结果表明,不同剂量的12C6+离子束照射淋巴细胞后差异表达蛋白质的种类和数量不同,共同差异表达蛋白质的差异比值也不完全相同。这些差异表达蛋白质主要参与物质转运、生物代谢、氧化应激反应等生物学过程。通常电离辐射引起染色体损伤的方式有两种:一种为直接作用,是将能量直接沉积在靶分子引起的电离或激发;另一种为间接作用,主要是电离辐射与周围介质发生作用产生自由基,使靶分子受到损伤。而体内存在过氧化物酶、过氧化氢酶和超氧化物歧化酶等多种可以清除自由基的物质。本研究发现,共同下调蛋白SZT2是一种可以清除自由基的局限性过氧化物酶,具有超强的抗氧化能力[4 - 5],可以清除电离辐射产生的自由基,减轻电离辐射对细胞造成的损伤,起到辐射防护的作用。在本研究中,各剂量组SZT2蛋白表达均为下调,表明重离子照射可诱导细胞抗氧化和清除自由基的能力下降。结合前期基因芯片的研究数据显示,SZT2在基因水平3个剂量组的表达同样均为下调,与蛋白水平表达一致,提示SZT2的蛋白表达可能与基因转录调控有关,以上结果表明,SZT2在重离子辐射生物效应中可能起着重要作用,有望成为重离子辐射暴露的分子标记物。
生物信息学是研究生物系统、处理和分析大规模生物信息的一门交叉学科,重点体现在基因组学和蛋白质组学两个方面,分析序列中表达的结构功能的生物信息。一般包括GO分析、通络分析以及相互作用网络分析。本研究通过对12C6+离子束照射后各剂量组差异表达蛋白质的GO分析,显示0.1 Gy组的多个差异蛋白质与核苷酸代谢和蛋白折叠相关[6],主要功能可能是影响生物大分子的相关功能;0.5 Gy组的差异表达蛋白质中大部分与免疫反应、B淋巴细胞增殖相关。研究表明,电离辐射对固有免疫(主要为T淋巴细胞与自然杀伤细胞)、适应性免疫(主要为B淋巴细胞)以及免疫器官胸腺、脾都具有明显的作用[7];2.0 Gy组中则出现较多和细胞凋亡相关的差异表达蛋白质,如半胱氨酸天冬氨酸蛋白酶(Caspase)11、Caspase 16呈上调趋势,提示淋巴细胞接受2.0 Gy重离子辐照后发生的凋亡可能主要是通过激活Caspase系统来诱导完成的[8];而3个剂量共同差异表达蛋白质主要与过氧化物反应有关,提示不同剂量的重离子辐照对细胞的损伤程度和作用途径可能不同。从差异蛋白质的通路分析同样可以得出,0.1 Gy主要与剪接体通路有关;0.5 Gy涉及更多感染性疾病的通路,少量为癌症通路;而到2.0 Gy组的差异蛋白质则更多的与癌症通路相关,提示不同剂量重离子诱导人淋巴细胞发生损伤的机制与程度可能不尽相同。另外,2.0 Gy组的差异蛋白质与细胞周期通路相关,结合前期实验[9],经2.0 Gy12C6+离子束照射后的淋巴细胞发生了明显的G2/M期阻滞,这可能与重离子引起的DNA损伤,有丝分裂纺锤体的结合等有关,为损伤、修复争取时间,有利于保证基因组的遗传稳定性[10]。细胞周期的正常运行需要经过严格的调控,其中发挥主要作用的是细胞周期调控蛋白。在本研究中,周期相关蛋白P21表达下调,APC/C蛋白表达上调,P21蛋白被认为是细胞分裂周期蛋白Cdc42的效应蛋白[11],而APC/C蛋白则主要通过调控Cyclin B1蛋白在细胞周期调控中发挥重要作用[12]。
进一步通过相互作用网络分析,HSPA1B与纤维黏连蛋白-1(FN1)是蛋白质相互作用网络的关键性节点,提示这几种蛋白质可能在重离子照射后发挥重要的作用。其中,HSPA1B蛋白是热休克蛋白家族成员之一,热休克蛋白也称应激蛋白,是生物细胞在受到外界刺激如热刺激、过氧化、紫外线、外伤感染、毒物和重金属等应激源刺激后,发生热休克反应所产生的、热休克基因编码的、高度保守的细胞保护蛋白,主要参与细胞的损伤修复,具有抗凋亡和抗氧化作用[13 - 14]。近年来研究表明,热休克蛋白的过表达对细胞的辐射损伤具有保护作用[15]。本研究结果显示,不同剂量重离子作用后,HSPA1B表达均降低,使其对细胞的辐射防护作用减小,提示可能与细胞的辐射损伤过程密切相关。
纤维黏连蛋白(FN)、FN1是细胞外基质(ECM)的重要组成成分,主要由肝细胞、血管内皮细胞、巨噬细胞、纤维母细胞合成、分泌。FN广泛存在于细胞表面、细胞外液、结缔组织基质、大部分基底膜及体液中,分成细胞型FN(cFN)、血浆型FN(pFN)与胎儿型FN(fFN)3种。FN最重要的生理功能是促进细胞与基质、细胞之间的黏连,具有维持细胞形态,控制细胞迁移,诱导细胞分化和影响免疫细胞功能等多种生物学作用[16 - 17]。本研究证实,FN1蛋白在0.5和2.0 Gy剂量组中表达升高,推测12C6+离子束作用后,该蛋白表达水平的升高可能与促进受照细胞的分化和修复有关。
综上所述,iTRAQ技术用于辐射损伤的蛋白质组学研究是一种可行的策略。本研究利用iTRAQ技术与生物信息学技术,初步研究了不同剂量重离子照射淋巴细胞的分子损伤机制,初步筛选出SZT2、HSPA1B、FN1与Arfaptin-1相似等蛋白,为进一步研究重离子照射的损伤机制、寻找辐射损伤早期诊断标志物提供了基础资料。下一步将会针对iTRAQ技术筛选的差异蛋白质进行Western blot验证和重离子辐射相关性进行深入研究。
利益冲突 本研究主要是进行重离子辐射生物效应的相关研究,本人与本人家属、其他研究者,未进行该研究而接受任何不当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 张睿凤负责研究方案的设计,蛋白质组数据的整理与分析、研究论文的撰写;党旭红、原雅艺和董娟聪负责淋巴细胞培养与样本制备等工作;张忠新与任越负责细胞照射等工作;左雅慧负责对实验的总体指导;段志凯负责对论文的审查
| [1] | 王洪斌, 卫萍, 房殿春. 胃癌蛋白质组学研究进展[J]. 胃肠病学和肝病学杂志 , 2008, 17 (3) : 192-193 Wang HB, Wei P, Fang DC. Research advance of proteomics in gastric cancer[J]. Chin J Gastroenterol Hepatol , 2008, 17 (3) : 192-193 |
| [2] | Matharoo-Ball B, Miles AK, Creaser CS, et al. Serum biomarker profiling in cancer studies:a question of standardisation[J]. Vet Comp Oncol , 2008, 6 (4) : 224-247 DOI:10.1111/j.1476-5829.2008.00171. |
| [3] | 白鋆. 蛋白组学在系统性红斑狼疮中的应用现状[J]. 医学综述 , 2013, 19 (23) : 4246-4248 Bai Y. Application status of proteomics technology in systemic lupus erythematosus[J]. Med Recap , 2013, 19 (23) : 4246-4248 DOI:10.3969/j.issn.1006-2084.2013.23.009. |
| [4] | Basel-Vanagaite L, Hershkovitz T, Heyman E, et al. Biallelic SZT2 mutations cause infantile encephalopathy with epilepsyand dysmorphic corpus callosum[J]. Am J Hum Genet , 2013, 93 (3) : 524-529 DOI:10.1016/j.ajhg.2013.07.005. |
| [5] | Michelle F, Kemal O. An amino acid deletion in SZT2 in a family with non-syndromic intellectual disability[J]. PLoS One , 2013, 8 (12) : 1-4 DOI:10.1371/journal.pone.0082810. |
| [1] | 马彬光. 蛋白折叠、结构平衡与进化[D]. 苏州: 苏州大学, 2007. Ma BG. Protein folding, structure balance and evolution[D]. Suzhou: Soochow University, 2007. |
| [7] | 刘树铮. 辐射免疫学研究的回顾与展望[J]. 中华放射医学与防护杂志 , 2005, 25 (2) : 193-200 Liu SZ. Review and prospect of research on radioation immunology[J]. Chin J Radiol Med Prot , 2005, 25 (2) : 193-200 DOI:10.3760/cma.j.issn.0254-5098.2005.02.048. |
| [8] | Polyak K, Xia Y, Zweier KW, et al. A model for P53 induced apoptosis[J]. Nature , 1997, 389 (6648) : 300-305 DOI:10.1038/38525. |
| [9] | 刘红艳, 党旭红, 左雅慧, 等. 12C重离子束对人淋巴细胞增殖、周期和凋亡的影响[J]. 中华放射医学与防护杂志 , 2015, 35 (2) : 107-110 Liu HY, Dang XH, Zuo YH, et al. Effects of 12C heavy-ion irradiation on cell growth, cell cycle and apoptosis of human peripheral blood lymphocytes[J]. Chin J Radiol Med Prot , 2015, 35 (2) : 107-110 DOI:10.3760/cma.j.issn.0254-5098.2015.02.007. |
| [10] | Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys , 2004, 59 (4) : 928-942 DOI:10.1016/j.ijrobp.2004.03.005. |
| [11] | Chetan KR, Audrey M. P21 activated kinases structure, regulation, and functions[J]. Small GTPases , 2014, 5 : 1-13 DOI:10.4161/sgtp.28003. |
| [12] | Shang ZF, Tan W, Liu XD, et al. DNA-PKcs negatively regulates cyclin B1 protein stability through facilitating its ubiquitination mediated by Cdh1-APC/C pathway[J]. Int J Biol Sci , 2015, 11 (9) : 1026-1035 DOI:10.7150/ijbs.12443. |
| [13] | Todryk SM, Gough MJ, Pockley AG. Facets of heat shock protein 70 show immunotherapeutic potential[J]. Immnology , 2003, 110 (1) : 1-9 DOI:10.1046/j.1365-2567.2003.01725. |
| [14] | 张芳, 刘红芝, 张兆成, 等. 大鼠缺血性脑损伤后HSP72保护神经元的作用机制探讨[J]. 山东医药 , 2009, 49 (2) : 31-33 Zhang F, Liu HZ, Zhang ZC, et al. The study of the function and mechanism on HSP72 protect neurons after the ischemic brain injury in rats[J]. Shandong Med J , 2009, 49 (2) : 31-33 |
| [15] | Robert B. Heat shock protein 70 enhanced deoxyribonucleic acid base excision repair in human leukemic cells after ionizing radiation[J]. Cell Stress Chap , 2006, 11 (3) : 240-249 DOI:10.1379/CSC-185R.1 |
| [16] | Prasad ML, Pellegata NS, Huang Y, et al. Galectin-3, fibronectin-1, CITED-1, HBME1 and cytokeratin-19 immunohistochemistry is useful for the differential diagnosis of thyroidtumors[J]. Modern Pathol , 2005, 18 (1) : 48-57 DOI:10.1038/modpathol.3800235. |
| [17] | 王菲菲. microRNA-1在喉鳞状细胞癌HEp2细胞中靶向调节fibronectiu 1基因[D]. 天津:天津医科大学, 2010. Wang FF. microRNA-1 targets fibronecin 1 in human laryngeal carcinoma cell line HEp2[D]. Tianjin: Tianjin Medical University, 2010. |
 2016, Vol. 36
2016, Vol. 36


