2. 300072 天津大学生命科学院(房蕾、常津)
2. Tianjin University,School of Life Sciences,Tianjin 300072,China(Fang L, Chang J)
肺癌是国内外最常见及死亡率最高的恶性肿瘤之一[1]。整合素αvβ3在正常细胞中可少量表达,而在大部分肿瘤细胞及肿瘤新生血管表面可大量表达,如肺癌、乳腺癌、结肠癌等[2-3]。随着分子影像技术的不断进步,放射性核素标记小分子蛋白多肽在肿瘤的显像及治疗中受到关注。目前,已有很多靶向特异性药物作用于肿瘤表面或肿瘤血管表面受体。精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)肽是一种小分子肽类,能特异性地与整合素结合。多项研究提示,核素标记的RGD纳米载体在肿瘤中的摄取率存在差异,与肿瘤类别、药物剂量、RGD结构及其他结构的修饰等有关。本研究应用放射性核素131I标记的RGD肽纳米载体,对非小细胞肺癌细胞系NCI-H460进行相关体内外研究,探讨其对NCI-H460荷瘤裸鼠模型SPECT/CT显像效果及其对肿瘤的抑制作用。
材料与方法1. 细胞及主要试剂:RGD肽、纳米脂质体BSA-PCL(bovine serum albumin-phosphate buffer solution,BSA-PCL)由天津大学材料学院常津教授实验室课题组提供、设计并合成RGD-BSA-PCL。131I购自中国中核高通公司;氯氨T及偏重硫酸钠均购自北京鼎国生物试剂公司。非小细胞肺癌细胞系NCI-H460细胞由本实验室保存;DMEM高糖型培养基购自美国Invitrogen公司;胎牛血清购自美国GIBCO公司。
2. 实验动物:BALB/c-nu/ nu品系(SPF级)裸鼠购自中国医学科学院北京协和医学院北京实验动物中心,饲养在天津医科大学实验动物中心无特定病原体级无菌层流室中,恒温(22~25℃)、恒湿(55±5)%饲养。
3. H460细胞对纳米脂质体摄取:将两种荧光标记的纳米载体(FITC-RGD-BSA-PCL及FITC-BSA-PCL)加入到铺满H460细胞的共聚焦小皿内,分别继续培养1、8 h后,4%多聚甲醛固定细胞。DAPI染色,在激光共聚焦显微镜(Leica,德国GmbH公司)下观察两种纳米脂质体在H460细胞中的富集情况。
4. 131I标记纳米脂质体及测定:采用氯胺T标记法。1 mg/ml纳米载体100 μl,加入氯胺T(chloramine-T,CHT)100 μl,加入新鲜Na131I溶液37 MBq,振荡反应60 s,加入100 μl偏重硫酸钠(5 mg/ml),继续振荡60 s终止反应。测定混合物放射性活度后,以5 000 r/min离心30 min,离心半径5 cm。测定产物的标记率及放化纯。
5. 细胞凋亡实验:6孔板培养H460细胞,当细胞数目达104~105/ml时,在细胞超净台内向6孔板中加样,分为 3 组:Na131I、131I-RGD-BSA-PCL和131I-BSA-PCL组,放射性活度均为18.5 MBq/ml。常规培养12 h后去除上清液,加入DMEM继续培养24 h;收集细胞,1 000 r/min离心5 min,离心半径5 cm;采用AnnexinV-FITC/碘化丙啶凋亡试剂盒染色,流式细胞仪检测。
6. 肿瘤模型建立:裸鼠右肩碘伏消毒,将已调整好密度的H460细胞悬液接种于该部位,每只动物接种约2×106细胞。当肿瘤直径为10 mm左右时,用于动物实验。实验前1 d,每只裸鼠腹腔内注射无菌过氯酸钾溶液1 ml(1 mg/ml)。并保持裸鼠饮水中加入过氯酸钾(1mg/ml)。每隔2日测肿瘤大小,即肿瘤的长、宽、高。肿瘤体积计算公式:体积=1/6×π×长(mm)×宽(mm)×高(mm)。
7. 组织分布:采用简单随机抽样法将荷瘤裸鼠随机分为4组,每组5只,分别为131I-RGD-BSA-PCL组、131I-BSA-PCL组、Na131I组及生理盐水组。每只裸鼠瘤内注射37 MBq药物,生理盐水组瘤内注射100 μl 生理盐水。在注药后24、72 h,处死裸鼠,取心、肝、脾、肺、肾、胃、肠、脑及肿瘤,称重,计算其放射性计数率及荷瘤裸鼠各脏器的每克组织注射剂量百分比(%ID/g)。
8. 抑瘤效果观察:分组方法相同,其中生理盐水组为对照组,核素纳米载体组为治疗组。每只裸鼠瘤内注射111 MBq药物,观察肿瘤体积变化趋势,肿瘤抑制率=(1-治疗组瘤重量/对照组瘤重量)×100%。3组裸鼠(除外生理盐水组)分别在给药后1、2、3、7、10、15和21 d,进行SPECT/CT断层显像。
9. 统计学处理:各组数据均采用x±s表示。采用SPSS 17.0统计软件进行处理,组间均数比较采用独立样本t检验和单因素方差分析。P<0.05为差异有统计学意义。
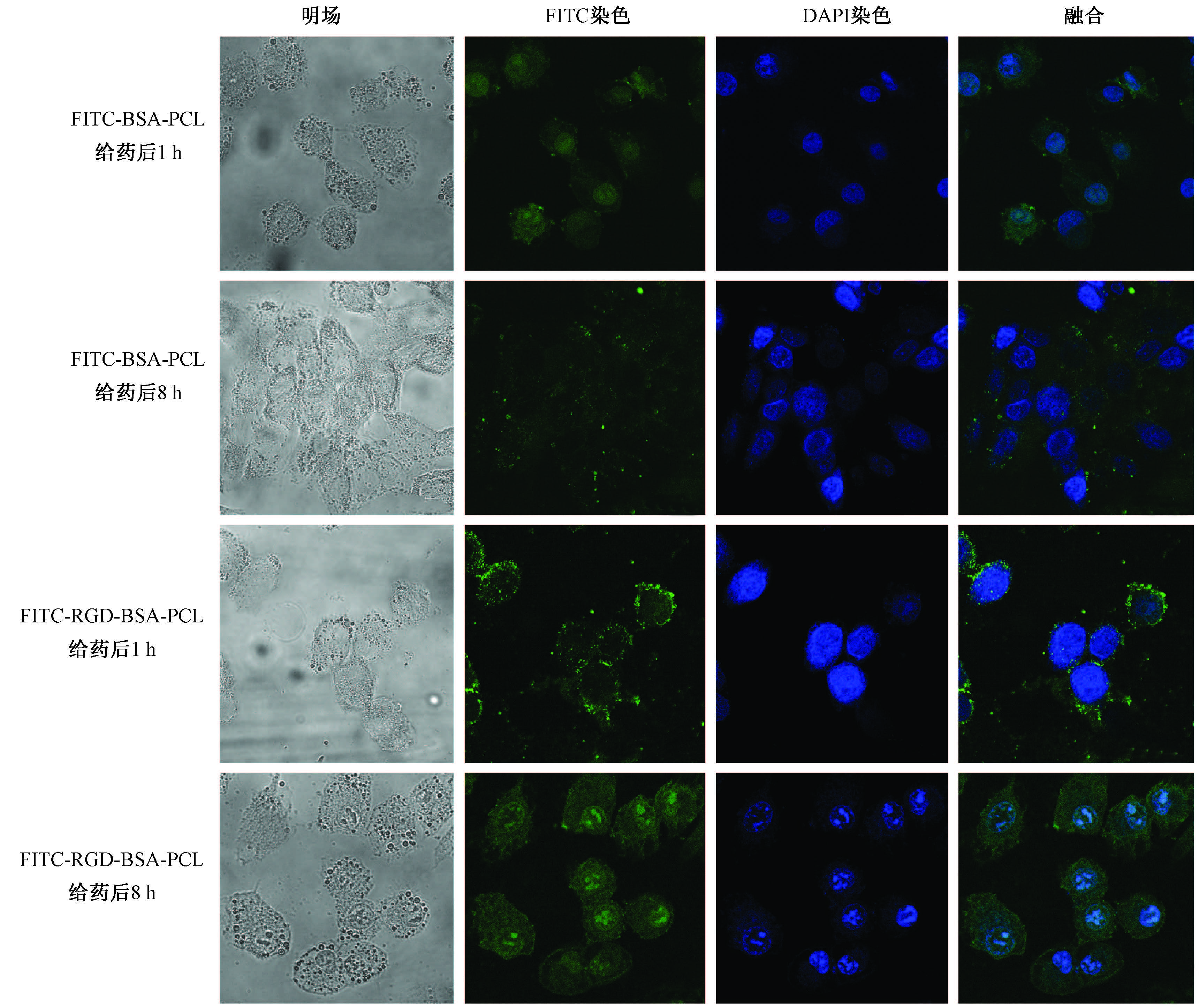
结 果1. H460细胞对纳米脂质体摄取:共聚焦镜下H460细胞对纳米载体的摄取情况如图 1所示。共聚焦镜下可见H460细胞对这两种纳米载体均有明显摄取,纳米载体分布于细胞质及细胞核内。H460对FITC-BSA-PCL纳米脂质体摄取较快,1 h时,于细胞质及细胞核内均可见荧光信号,FITC-RGD-BSA-PCL纳米载体组细胞质内有较多荧光信号,而细胞核荧光信号较弱。8 h时,FITC-BSA-PCL纳米载体组H460细胞质内可见荧光信号,细胞核内原有的摄取基本消失;FITC-RGD-BSA-PCL纳米载体组细胞质及核内仍可见较强荧光信号。
|
图 1 共聚焦镜下H460 细胞对纳米载体的摄取情况 绿色荧光部分为细胞质,蓝色信号为DAPI 染色细胞核,绿色和蓝色叠加图为融合图像 Figure 1 The cellular uptake of liposomes into H460 cells by confocal microscopy |
2. 标记率及放化纯:最终标记后的纳米药物载体131I-RGD-BSA-PCL和131I-BSA-PCL,标记率为50%~75%之间,放化纯为95%~98%。
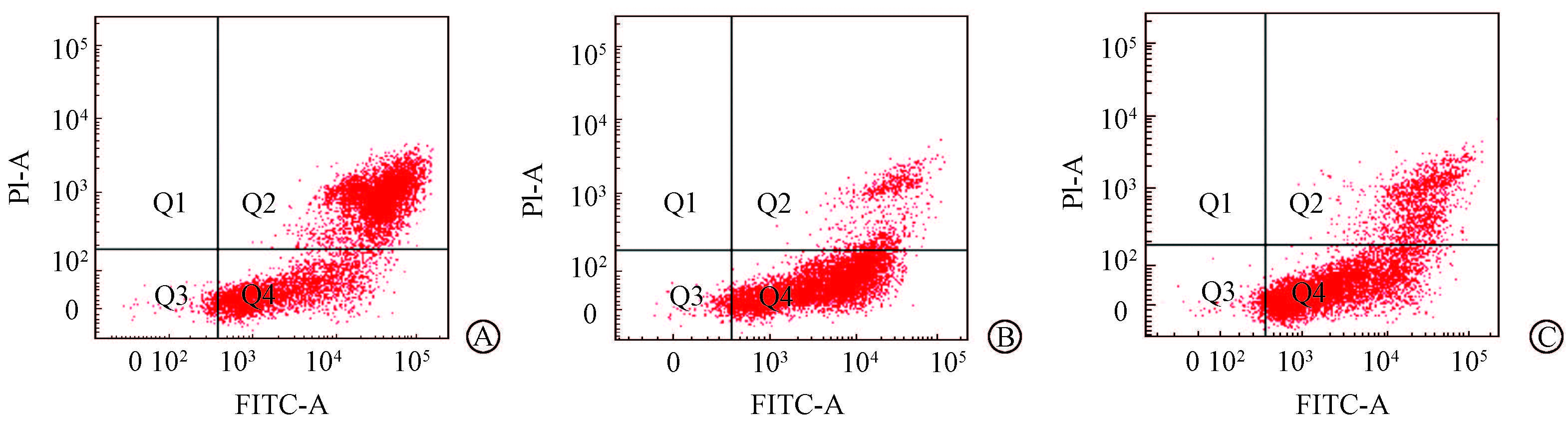
3. 流式细胞术:核素纳米载体对H460细胞系的凋亡作用结果如图 2所示。当Na131I、131I-BSA-PCL、131I-RGD-BSA-PCL浓度为37 MBq/ml时,H460细胞的早期凋亡率分别为(33.3±12.5)%、(68.4±8.0)%、(70.5±12.2)%,表明131I-BSA-PCL及131I-RGD-BSA-PCL诱导细胞的凋亡作用强于Na131I。
|
图 2 核素纳米载体对H460细胞系的凋亡作用 A. Na131I组; B. 131I-BSA-PCL组; C. 131I-RGD-BSA-PCL组 Q1. 坏死细胞;Q2. 晚期凋亡细胞;Q3. 活细胞;Q4. 早期凋亡细胞 Figure 2 Apoptosis assays of H460 cell line induced by radionuclide nanoparticles A. Na131I group; B. 131I-BSA-PCL group; C. 131I-RGD-BSA-PCL group |
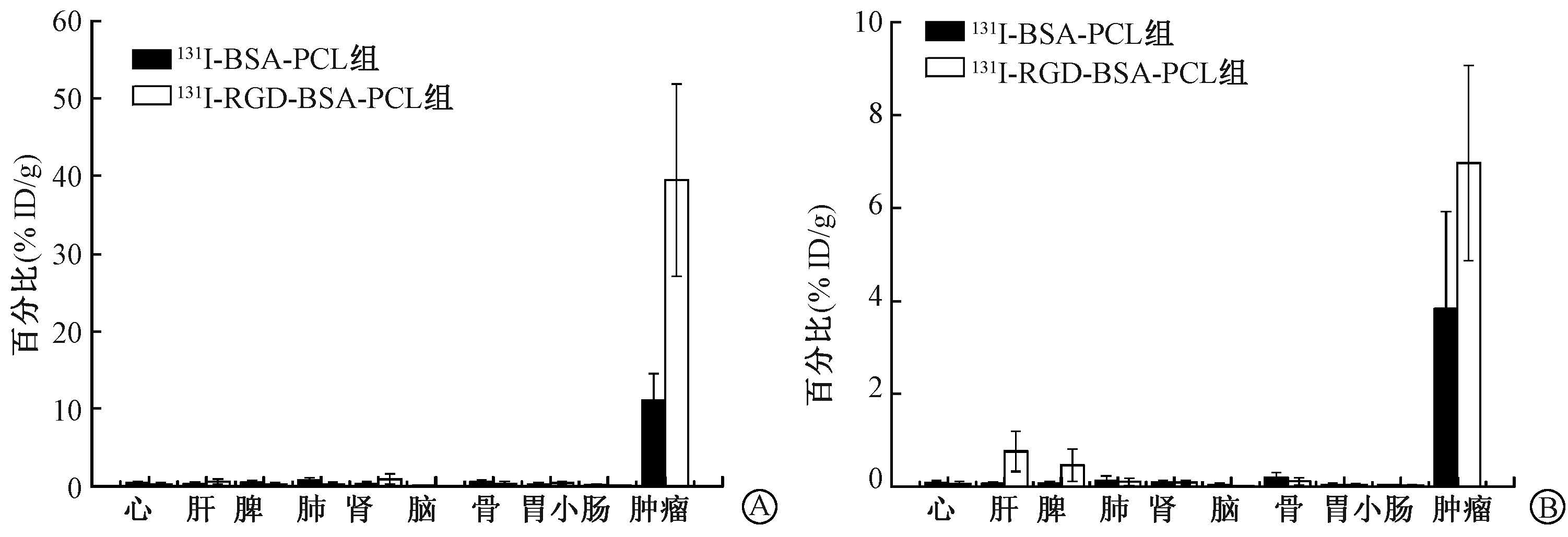
4. 组织分布:H460荷瘤裸鼠瘤内注射药物后纳米载体的组织分布情况结果如图 3所示。在给药24及72 h后,与裸鼠主要脏器(心、肝、脾、肺、肾、胃、小肠、骨)相比,131I标记的两种纳米载体被肿瘤组织吸收明显。裸鼠正常组织对两种不同纳米载体的摄取无明显差异,而肿瘤对核素摄取有差异。131I-BSA-PCL组在肿瘤内24及72 h后的摄取率分别为(11.06±2.15)和(3.83±0.87)% ID/g,131I-RGD-BSA-PCL组分别为(39.49±6.06)和(6.90±1.43)% ID/g,均高于131I-BSA-PCL组(t=9.53、5.03,P<0.01)。
|
图 3 H460荷瘤裸鼠瘤内注射37 MBq药物后24和72 h两种纳米载体的组织分布情况 A.给药后24 h;B.给药后72 h 与131I-BSA-PCL组相比,at=9.53,P<0.01;bt=5.03,P<0.01 Figure 3 Biodistribution of 131I-RGD-BSA-PCL and 131I-BSA-PCL in NCI-H460 tumor-bearing nude mice at 24 h and 72 h after injection A.24 h after injection;B.72 h after injection |
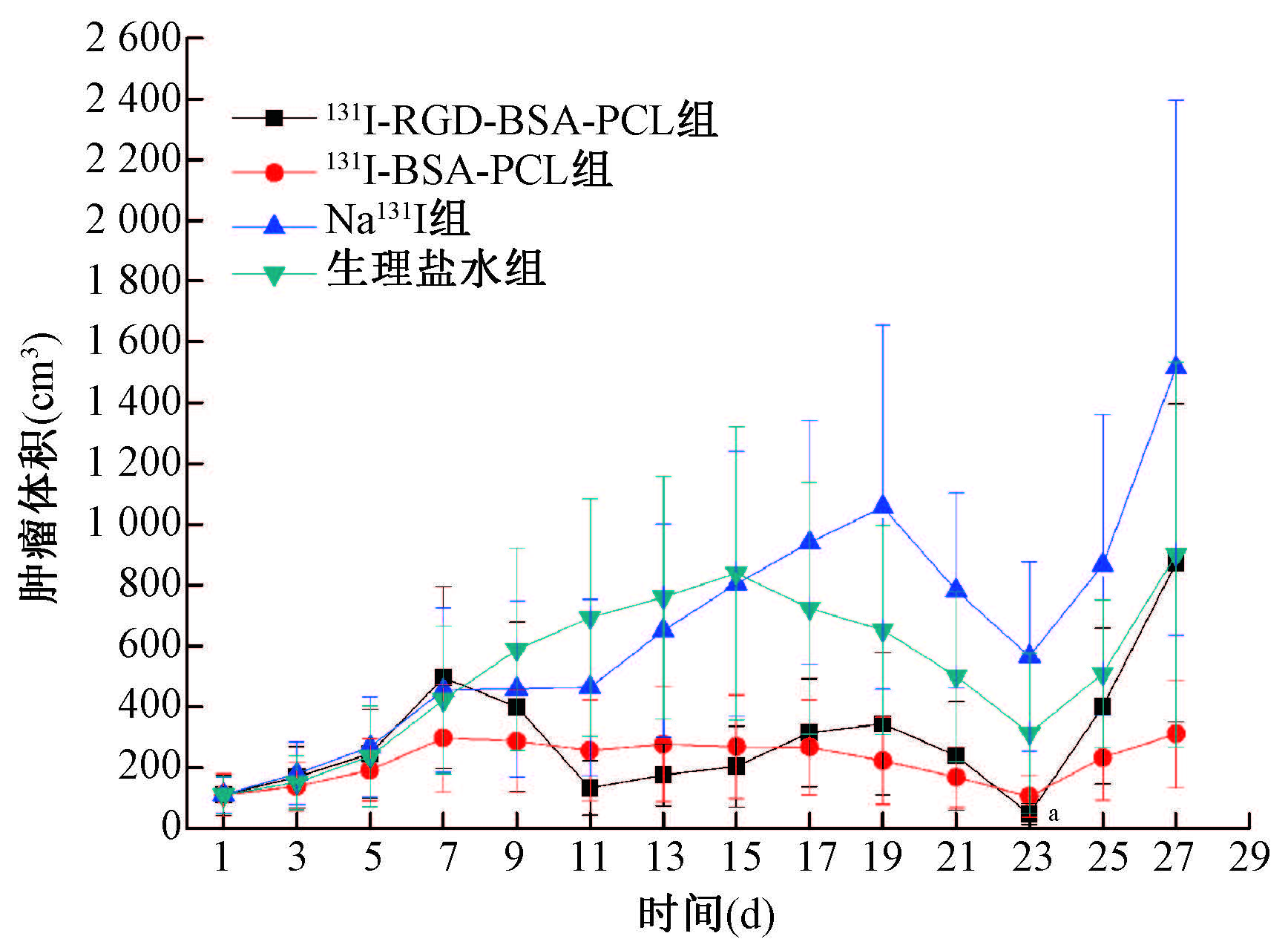
5. 肿瘤体积变化:各组荷瘤裸鼠给药后不同时间肿瘤体积的变化如图 4所示,各组裸鼠给药后,随着时间的延长,Na131I组及生理盐水组中可见肿瘤快速生长,在给药后7 d,肿瘤体积接近500 cm3。而131I-BSA-PCL及 131I-RGD-BSA-PCL组中荷瘤裸鼠肿瘤增长缓慢。在给药后23 d,与131I-BSA-PCL组相比,131I-RGD-BSA-PCL组肿瘤体积抑制最明显,肿瘤抑制率为84.71%(t=126.44,P<0.01)。各组裸鼠在给药后23 d起,肿瘤再次出现快速增长。
|
图 4 组荷瘤裸鼠给药后不同时间肿瘤体积的变化 a与131I-BSA-PCL组相比,t=126.44,P<0.01 Figure 4 Tumor volume changes of xenograft-bearing nude mice intra-tumoral injected with drugs |
6. SPECT/CT断层显像:各组荷瘤裸鼠在给药后不同时间的SPECT/CT断层显像结果如图 5所示。放射性核素浓集于荷瘤部位,其他部位均未见明显摄取,呈本底水平。Na131I组裸鼠药物血液清除较快,前3 d放射性核素浓集水平微弱,并呈逐步减弱趋势,并于注药后7 d信号基本消失。而131I-RGD-BSA-PCL及131I-BSA-PCL治疗组均可见纳米载体在肿瘤内长时间停留。在给药后15 d,两个治疗组裸鼠肿瘤内仍可见较强放射性信号。给药后21 d,131I-RGD-BSA-PCL组肿瘤内信号强度明显强于131I-BSA-PCL组。
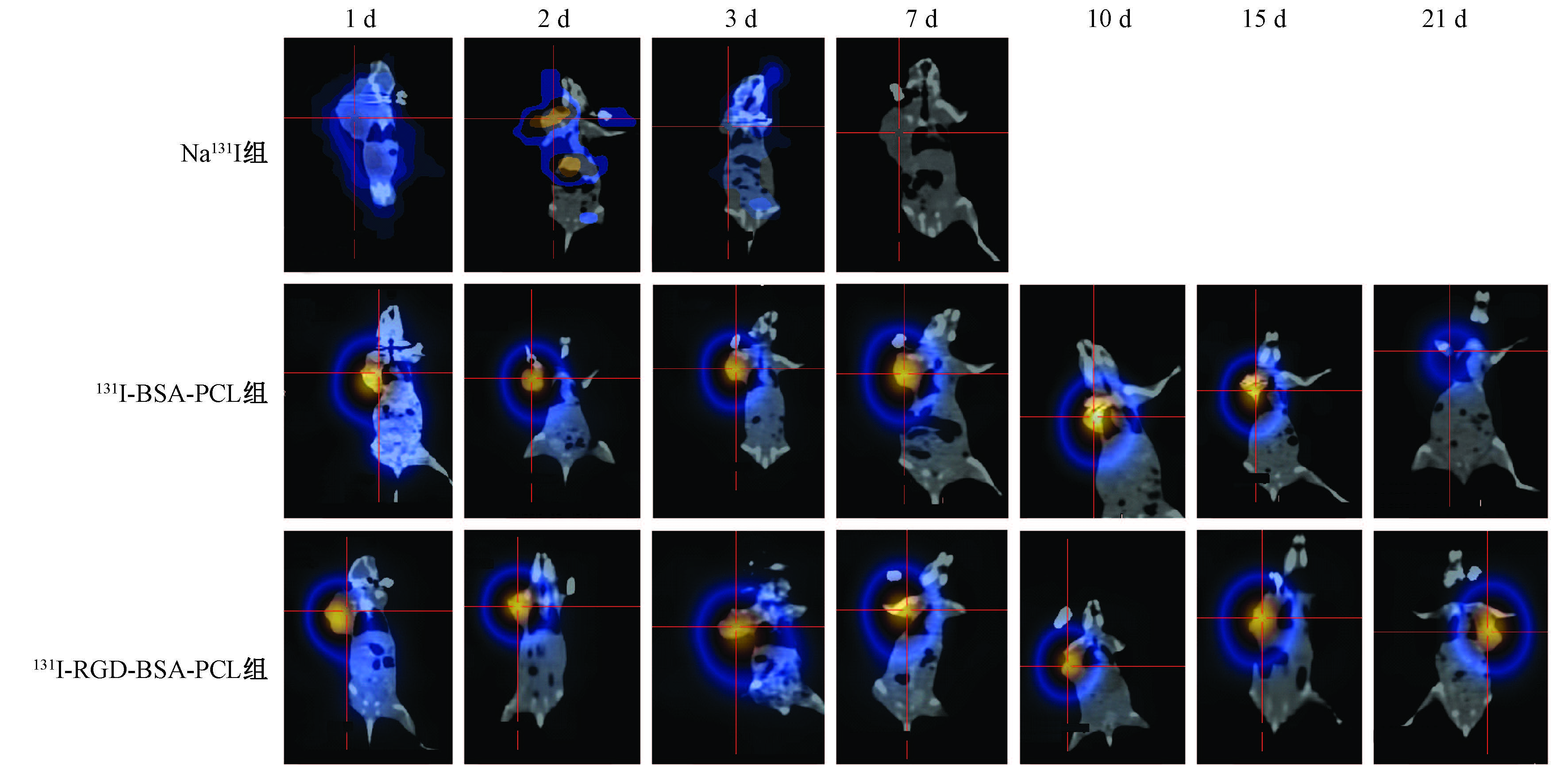
|
图 5 各组荷瘤裸鼠在给药后不同时间的SPECT/CT断层显像 Figure 5 SPECT/CT tomography of xenograft-bearing nude mice intra-tumoral injected with drugs at different time |
讨 论
整合素是细胞黏附分子家族的重要成员之一,是细胞外基质的异二聚体跨膜糖蛋白,由两个跨膜糖蛋白亚基α、β以非共价键组成,可以识别细胞外多种成分[4]。在24种整合素受体家族中,αvβ3对于肿瘤的血管再生及转移起着重要作用[5],成为目前研究最多的整合素之一。精氨酸-甘氨酸-天冬氨酸是细胞外基质上纤维连接蛋白中的一段序列小分子肽,能和高表达整合素αvβ3或αvβ5受体的肿瘤血管特异结合,抑制其内皮细胞的增殖、黏附和减少血管的生成[6]。
与正常组织相比,实体肿瘤组织血管丰富、血管壁间隙较宽、结构完整性差,大分子类物质和纳米颗粒不易透过正常组织处的血管壁而在肿瘤组织处具有选择性、高通透性,同时由于肿瘤组织的淋巴回流缺失,使得大分子类物质和纳米颗粒滞留在肿瘤组织处。多功能纳米粒子拥有治疗及靶向显像功能,在体内能特异性地转运药物,可定量的调控其治疗疗效[7-8]。将RGD连接于纳米载体中,使用放射性核素标记,可用于肿瘤的诊断及治疗[9-10]。Hernandez等[11]用 64Cu标记RGD纳米药物用于肿瘤PET显像,发现高表达整合素αvβ3的肿瘤显影清晰,且对于腹部肿瘤具有独特显影能力。Zhai等[12]合成了RGD聚合物,将其标记上89Zr,通过体外稳定性、组织分布及小动物PET/CT显像实验证实89Zr-RGD聚合物具有受体特异靶向性,且骨组织未见摄取,提示其可作为一种络合剂用于PET显像。由于RGD合成困难以及药物动力学欠佳,故目前主要是通过合成环形RGD药物以增加药物稳定性,提高药物在肿瘤内的存留时间。
由于肿瘤对18F-FDG的摄取与肿瘤类型有关,且多项报道及临床资料表明18F-FDG在诊断常出现误差。而99Tcm-甲氧基异丁基异腈(MIBI)肿瘤显像,能检测到肺癌中的P-糖蛋白,但其对肿瘤缺乏特异性。整合素受体有很多优势:特异性高、亲和力好、血液清除率高、显像质量高,而且能对局部进行示踪剂定量[9,13]。
研究显示,环形RGD虽然可以增加固态纳米粒子在乳腺癌细胞中滞留的时间,但由于单核吞噬系统的吞噬作用,致使纳米载体到达肿瘤部位的量大大减少[14]。RGD肽可结合到肿瘤细胞表面及新生血管内皮细胞表面,近年研究显示,在黑色素瘤的治疗中,用125I标记含RGD肽的复合物,该化合物具有选择性结合高表达整合素的黑色素瘤模型的能力,可用于小动物SPECT显像研究。且125I复合物能够调控黑色素瘤模型的生长[15],在肿瘤内有很好的靶本比[16],并在注射未标记的肽时其摄取明显减低[17]。在联合RGD-金纳米棒及光热效应探索对黑色素的治疗作用中,研究显示,RGD-金纳米棒可以在细胞膜及细胞质内探及,认为放射治疗+近红外照射+RGD-金纳米棒可明显提高凋亡率,降低细胞的比例,同时增强放疗敏感度[18]。目前,双受体靶向分子显像剂已成功地应用到很多肿瘤的分子显像中,与单分子探针相比,它能提高肿瘤的摄取,增强显像信号[19]。
本实验首先构建了两种纳米脂质体RGD-BSA-PCL及BSA-PCL,利用 BSA 组成中含有酪氨酸这一特性,在BSA-PCL结合体制备的纳米组装体上标记放射性131I,并对纳米载体进行靶向修饰,利用纳米载体的优势,提高放射性131I被细胞摄取量和在细胞中的存留时间,提高核素治疗的效果。RGD-BSA-PCL可与NCI-H460肿瘤细胞及肿瘤血管表面高表达整合素αvβ3结合,加强肿瘤组织对纳米载体的被动靶向性。本研究构建RGD纳米脂质体,在体外细胞水平上,通过荧光共聚焦实验、摄碘实验,证明了靶向性纳米载体RGD-BSA-PCL及BSA-PCL均具有明显的肿瘤靶向性内吞作用,且RGD-BSA-PCL在肿瘤细胞内存留的时间长于非RGD靶向纳米载体。然后,构建荷瘤裸鼠模型,研究核素纳米载体在荷瘤裸鼠体内的组织分布、各组荷瘤裸鼠SPECT/CT断层显像及各治疗组对肿瘤的抑瘤效果观察等。结果表明,131I标记的两种纳米脂质体131I-RGD-BSA-PCL和131I-BSA-PCL可聚集于肺癌裸鼠移植瘤部位,并滞留相当长一段时间,而对荷瘤裸鼠生存期无明显影响。纳米载体具有主动靶向性及被动靶向性,本实验通过移植瘤瘤内注射药物的方式是利用纳米载体的被动靶向性,若实验组中有尾静脉给药途径组,那么结果将更具有说服力,此为本实验不足之处。
总之,本研究在非小细胞肺癌体外实验及移植瘤裸鼠模型中证明131I-RGD-BSA-PCL及131I-BSA-PCL能特异性地大量聚集在肿瘤细胞及组织中,且动物实验移植瘤显像清晰,在移植瘤内滞留时间较长,移植瘤生长受到明显抑制。适用于大量表达整合素αvβ3的肿瘤显像,并有望用于治疗这类肿瘤的复发和转移灶。
利益冲突 本文作者与单位没有因此项研究工作接受过第三方的资助或服务。不存在与本工作职责相冲突的任何个人经济利益或非经济利益以及任何直接或间接的义务和责任可能影响或潜在影响稿件的内容作者贡献声明 明慧、高景美、李玮设计研究方案,收集数据后统计并起草论文;房蕾负责纳米脂质体的合成及质量测试;李承霞、季艳会辅助指导细胞实验;申一鸣、胡袆明在动物实验显像方面予以大力支持;常津、谭建指导及监督实验进行,修改论文
| [1] | Herbst RS. Targeted therapy using novel agents in the treatment of non-small-cell lung cancer[J]. Clin Lung Cancer , 2002, 3 (Suppl 1) : S30-S38 DOI:10.3816/CLC.2002.s.006 |
| [2] | Ko HY, Choi KJ, Lee CH, et al. A multimodal nanoparticle-based cancer imaging probe simultaneously targeting nucleolin,integrin αvβ3 and tenascin-C proteins[J]. Biomaterials , 2011, 32 (4) : 1130-1138 DOI:10.1016/j.biomaterials.2010.10.034 |
| [3] | Yoshimasu T, Sakurai T, Oura S, et al. Increased expression of integrin α3β1 in highly brain metastatic subclone of a human non-small cell lung cancer cell line[J]. Cancer Sci , 2004, 95 (2) : 142-148 DOI:10.1111/cas.2004.95.issue-2 |
| [4] | Meineke V, Gilbertz KP, Schilperoort K, et al. Ionizing radiation modulates cell surface integrin expression and adhesion of COLO-320 cells to collagen and fibronectin in vitro[J]. Strahlenther Onkol , 2002, 178 (12) : 709-714 DOI:10.1007/s00066-002-0993-9 |
| [5] | Pontes-Junior J, Reis ST, Dall'Oglio M, et al. Evaluation of the expression of integrins and cell adhesion molecules through tissue microarray in lymph node metastases of prostate cancer[J]. J Carcinog , 2009, 8 : 3 DOI:10.4103/1477-3163.48453 |
| [6] | Pesonen S, Diaconu I, Cerullo V, et al. Integrin targeted oncolytic adenoviruses Ad5-D24-RGD and Ad5-RGD-D24-GMCSF for treatment of patients with advanced chemotherapy refractory solid tumors[J]. Int J Cancer , 2012, 130 (8) : 1937-1947 DOI:10.1002/ijc.26216 |
| [7] | Liu Z, Dong C, Wang X, et al. Self-assembled biodegradable protein-polymer vesicle as a tumor-targeted nanocarrier[J]. ACS Appl Mater Interfaces , 2014, 6 (4) : 2393-2400 DOI:10.1021/am404734c |
| [8] | Ge J, Neofytou E, Lei J, et al. Protein-polymer hybrid nanoparticles for drug delivery[J]. Small , 2012, 8 (23) : 3573-3578 DOI:10.1002/smll.201200889 |
| [9] | Shi J, Fan D, Dong C, et al. Anti-tumor effect of integrin targeted 177Lu-3PRGD2 and combined therapy with Endostar[J]. Theranostics , 2014, 4 (3) : 256-266 DOI:10.7150/thno.7781 |
| [10] | Chen X, Sievers E, Hou Y, et al. Integrin αvβ3-targeted imaging of lung cancer[J]. Neoplasia , 2005, 7 (3) : 271-279 DOI:10.1593/neo.04538 |
| [11] | Hernandez R, Czerwinski A, Chakravarty R, et al. Evaluation of two novel Cu-labeled RGD peptide radiotracers for enhanced PET imaging of tumor integrin αvβ3[J]. Eur J Nucl Med Mol Imaging , 2015, 42 (12) : 1859-1868 DOI:10.1007/s00259-015-3085-7 |
| [12] | Zhai C, Summer D, Rangger C, et al. Novel bifunctional cyclic chelator for 89Zr labeling-radiolabeling and targeting properties of RGD conjugates[J]. Mol Pharm , 2015, 12 (6) : 2142-2150 DOI:10.1021/acs.molpharmaceut.5b00128 |
| [13] | Liu B, Feng Y, Zhang JY, et al. Imaging of bronchioloalveolar carcinoma in the mice with the αvβ3 integrin-targeted tracer 99Tcm-RGD-4CK[J]. Transl Res , 2013, 162 (3) : 174-180 DOI:10.1016/j.trsl.2013.06.006 |
| [14] | Shan D, Li J, Cai P, et al. RGD-conjugated solid lipid nanoparticles inhibit adhesion and invasion of αvβ3 integrin-overexpressing breast cancer cells[J]. Drug Deliv Transl Res , 2015, 5 (1) : 15-26 DOI:10.1007/s13346-014-0210-2 |
| [15] | Bianchini F, Fabbrizzi P, Menchi G, et al. Radiosynthesis and micro-SPECT analysis of triazole-based RGD integrin ligands as non-peptide molecular imaging probes for angiogenesis[J]. Bioorg Med Chem , 2015, 23 (5) : 1112-1122 DOI:10.1016/j.bmc.2014.12.065 |
| [16] | Bianchini F, Cini N, Trabocchi A, et al. 125I-radiolabeled morpholine-containing arginine-glycine-aspartate(RGD)ligand of αvβ3 integrin as a molecular imaging probe for angiogenesis[J]. J Med Chem , 2012, 55 (11) : 5024-5033 DOI:10.1021/jm2016232 |
| [17] | Trabocchi A, Menchi G, Cini N, et al. Click-chemistry-derived triazole ligands of arginine-glycine-aspartate(RGD)integrins with a broad capacity to inhibit adhesion of melanoma cells and both in vitro and in vivo angiogenesis[J]. J Med Chem , 2010, 53 (19) : 7119-7128 DOI:10.1021/jm100754z |
| [18] | Li P, Shi YW, Li BX, et al. Photo-thermal effect enhances the efficiency of radiotherapy using Arg-Gly-Asp peptides-conjugated gold nanorods that target αvβ3 in melanoma cancer cells[J]. J Nanobiotechnology , 2015, 13 : 113-117 DOI:10.1186/s12951-015-0113-5 |
| [19] | Liu Z, Wang F. Dual-targeted molecular probes for cancer imaging[J]. Curr Pharm Biotechnol , 2010, 11 (6) : 610-619 DOI:10.2174/138920110792246546 |
 2016, Vol. 36
2016, Vol. 36


